На данном этапе нужно было определить, какое из альтернативных положений остатка аргинина 39 наиболее стабильно в данной структуре белка
Попробуем понять по числу возможных контактов, какое альтернативное положение будет в приоритете, а потом посмотрим на PDB-файл и что там cказано про эти положения
Красным цветом обозначаю водородные связи, синим - ионные взаимодействия (солевой мостик)

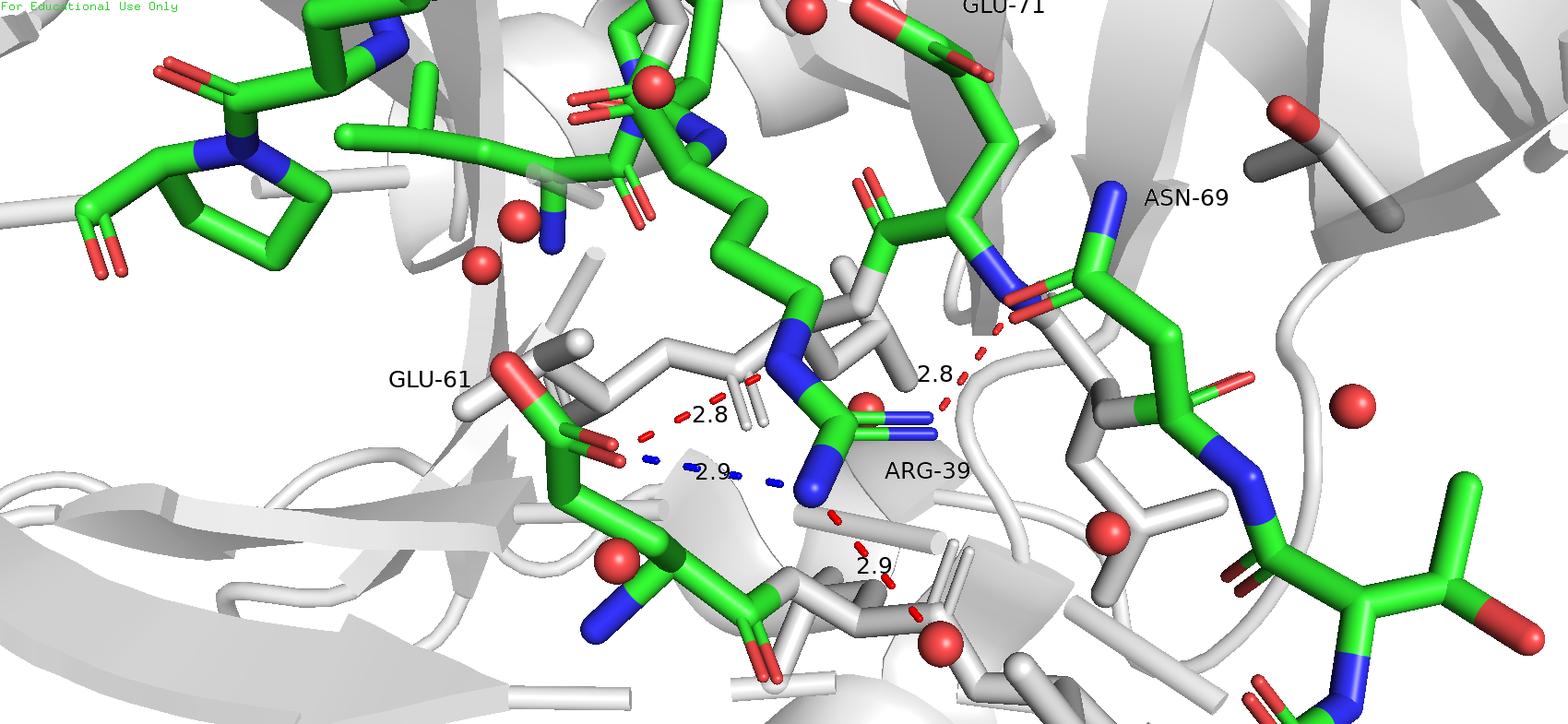
Рис.1. Взаимодействия аргинина 39 в положении "А"
Здесь можно наблюдать водородную связь между азотом NE аргиниа и кислородом OE1 глутамата 61. Длина связи вполне соответствует таковой у водородной, также как и угол. Также атом азота NH2 может взаимодействовать с молекулой растворителя. Как правило, аргинин заряжен положительно, поэтому здесь вполне возможно образование солевого мостика с боковым радикалом глутамата 61 (как правило несёт отрицательный заряд). Также ещё возможно наличие водородной связи скислородом OD1 аспарагина 69. Больше возможных взаимодействий обнаружено не было
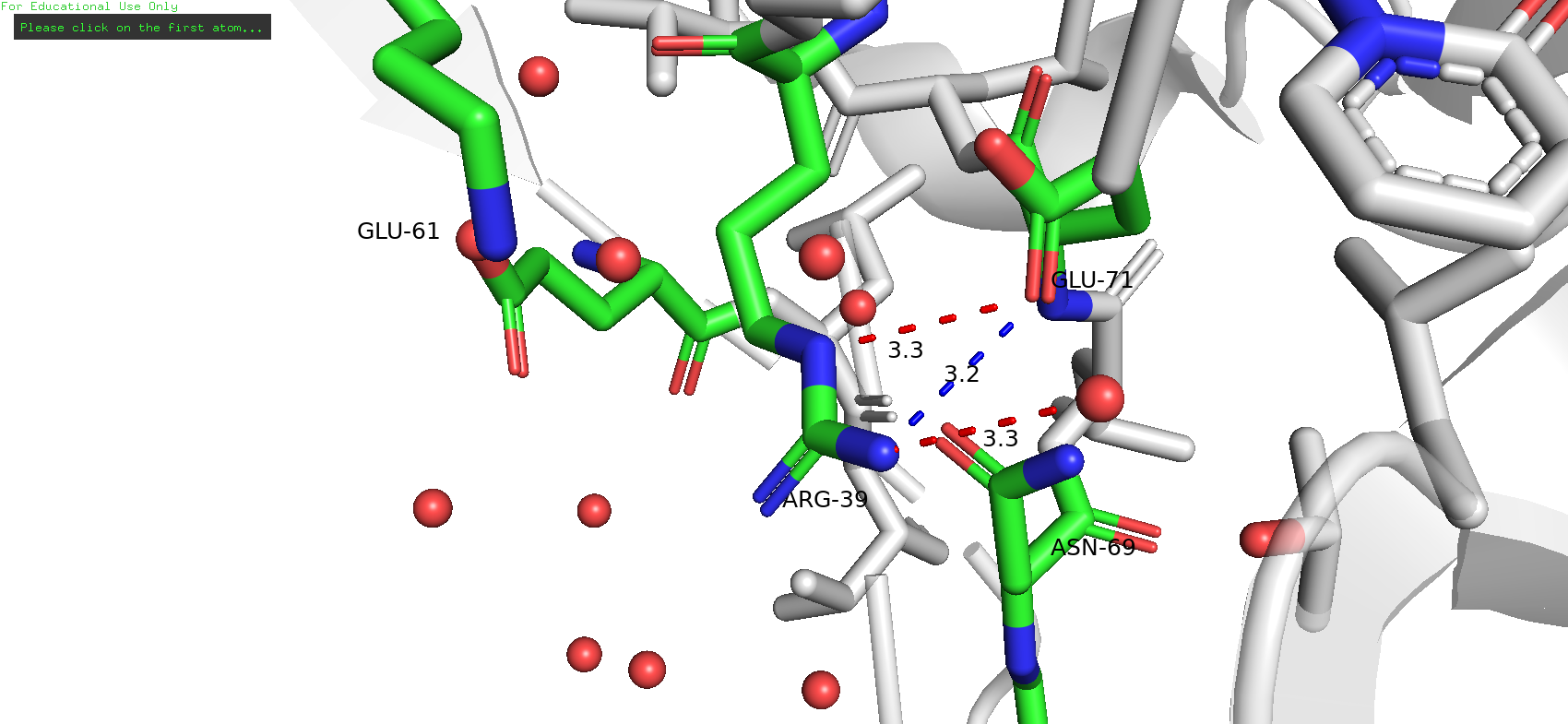
Рис.2. Взаимодействия аргинина 39 в положении "B"
В данном случае можно выделить взаимодействие азота NE аргиниа с кислородом OE1 глутамата 71. по критериям она подходит под водородную, хотя и длина почти предельная. Также возможно взаимодействие с молекулой растворителя. Можно ещё выделить солевой мостик с заряженной отрицательно группой глутамата 71. При этом ещё возможных связей не удалось обнаружить. Можно было бы предположить взаимодействие с аспарагином 69, но здесь или длина выходит слишком большая, или угол очень неприятный
Таким образом, по числу возможных контактов лидирует аргинин 39 в положении "A", следовательно, можно предположить, что такое положение самое распространённое для данной структуры. Что же скажут данные из файла PDB?
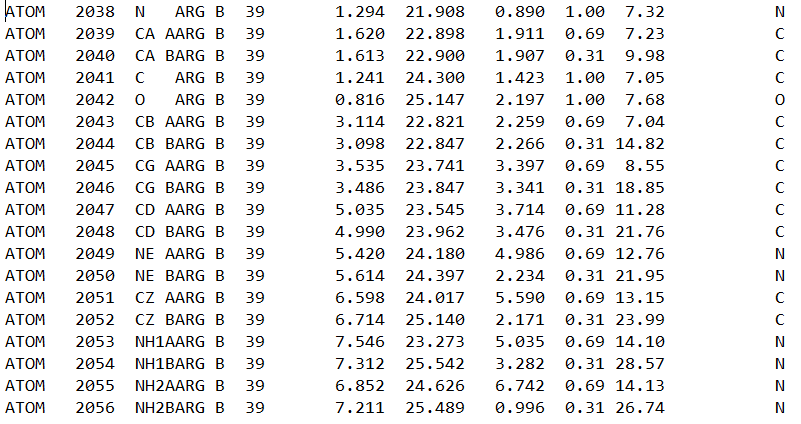
Рис.3. Данные PDB-файла об остатке аргинина 39
Можно заметить, что у атомов с альтернативным положением "А" населённость составляет 0.69, а у атомов с альтлоком "B" - 0.31. Таким образом, ячеек в кристалле с атомами в положении "А" больше всего, что собственно и соответствуе предположениям, полученным в результате анализа структуры.
В данном задании нам нужно будет раскрасить молекулу белка по B-фактору, сначала остов, затем остатки, и определить как распределение B-фактора связано с картой эдектронной плотности.
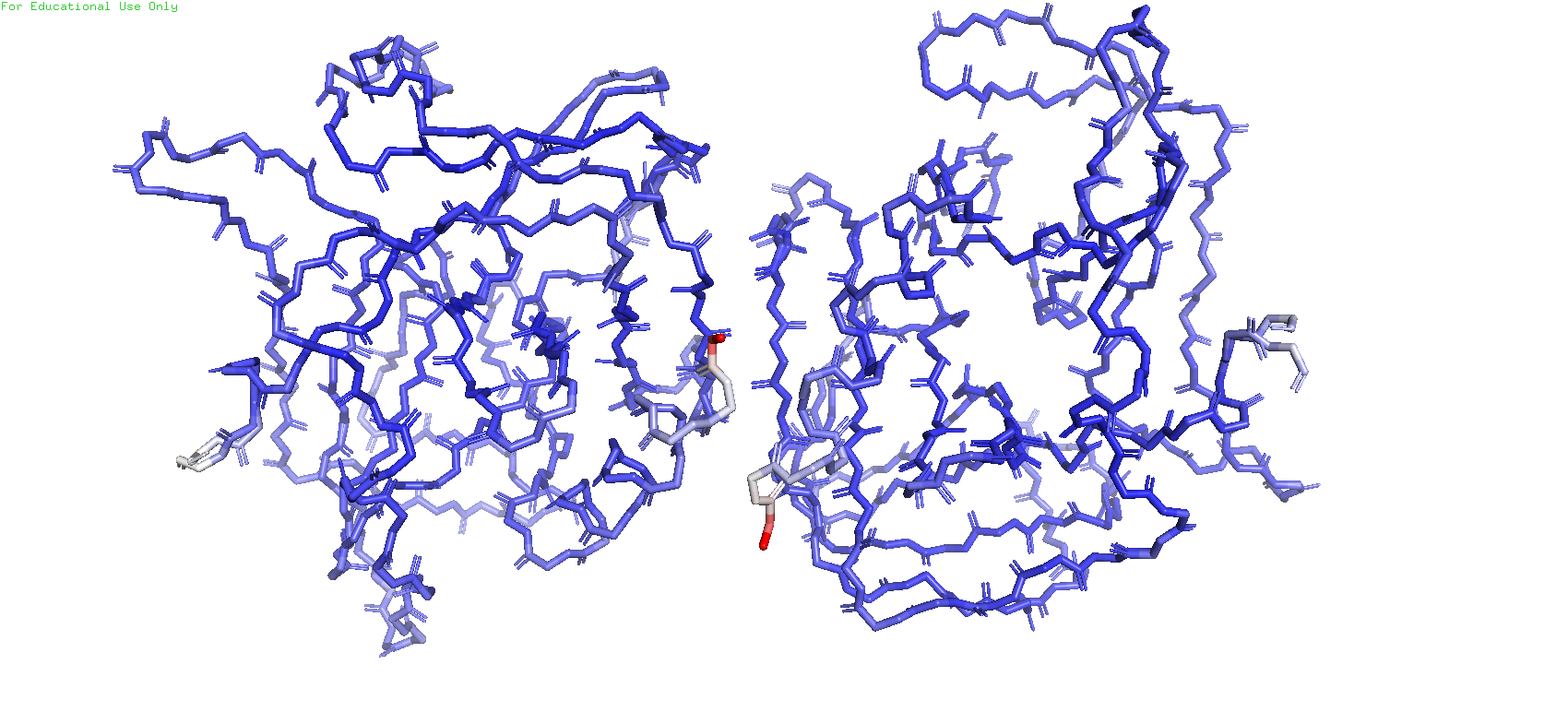
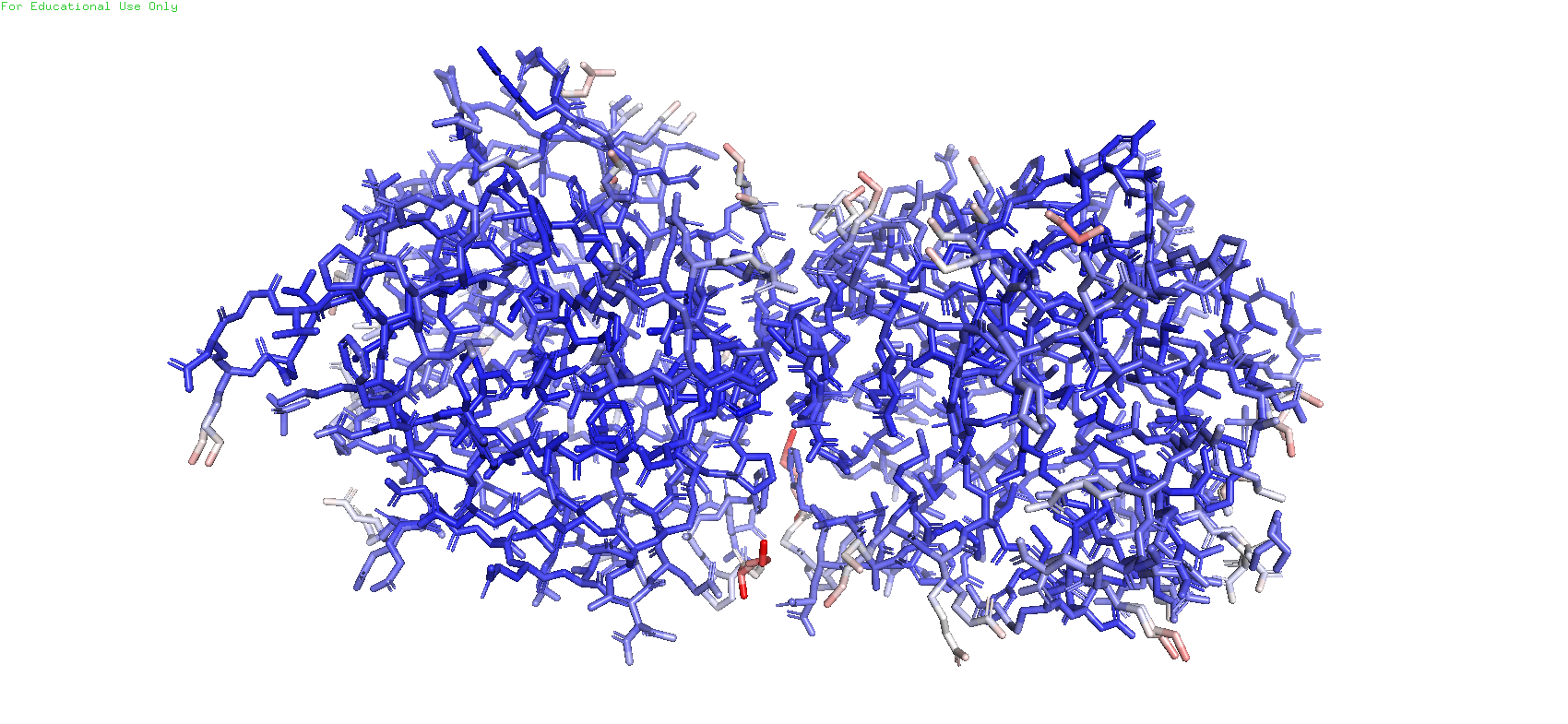
Рис.4. Раскраска атомов остова по B-фактору
B-фактор показвает смещение атомов от их среднего положения в кристаллической структуре, по сути показывает уровень подвижности атомов. Синий цвет - наименее подвижные, белый - средней подвижности, красный - наиболее подвижные.
По приведённым выше изображениям можно заметить, что беловатые и красные участки, т.е. наиболее подвижные, располагаются больше на периферии белка, а синие и тёмно-синие, т.е. наименее подвижные - наоборот, больше внутри глобулы. Это вполне можно объяснить, что участки остова во внутренней части глобулы более стабилизированы взаимодействиями друг с другом и более "скованы" в своих движениях. На переферии же есть больше свободы для двежиния, поэтому вполне возможно это одна из причин того, почему белые и красные части остова в основном расположены снаружи от глобулы.
На следующем этапе по В-фактору также были раскрашены ещё и остатки помимо остова, при этом с отображением карты электронной плотности на 3-х уровнях подрезки. Параметр carve был выбран = 1.5
Стоит отметить, что при полном отображении молекулы огромная "масса" электронной плотности сильно уменьшает видимость, поэтому с целью лучшего отображения был выбран небольшой ярко окрашенный участок, на котором очень хорошо видно, как изменяется покрытие электронной плотностью при увеличении уровня подрезки.
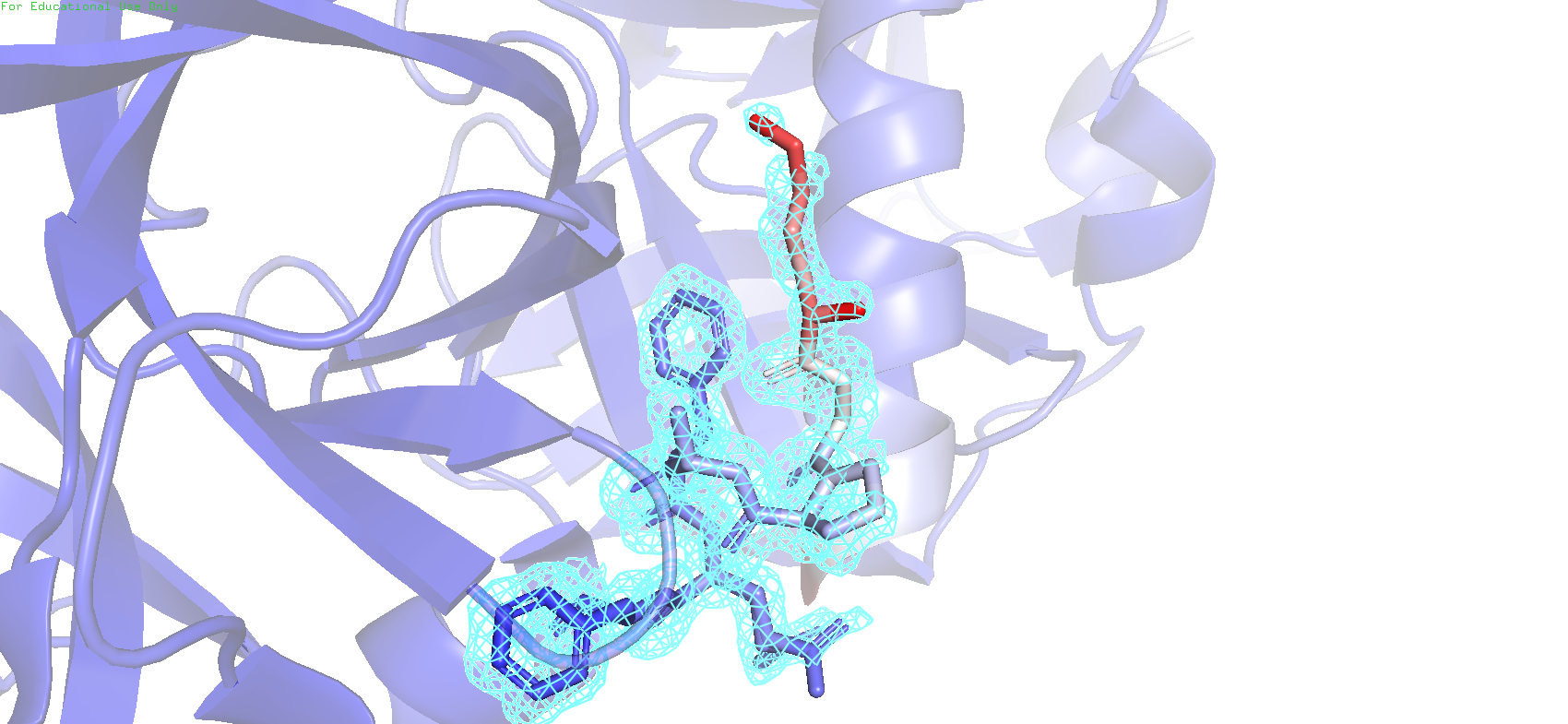
Рис.5. Раскраска по B-фактору вместе с картой электронной плотности на уровне подрезки 1
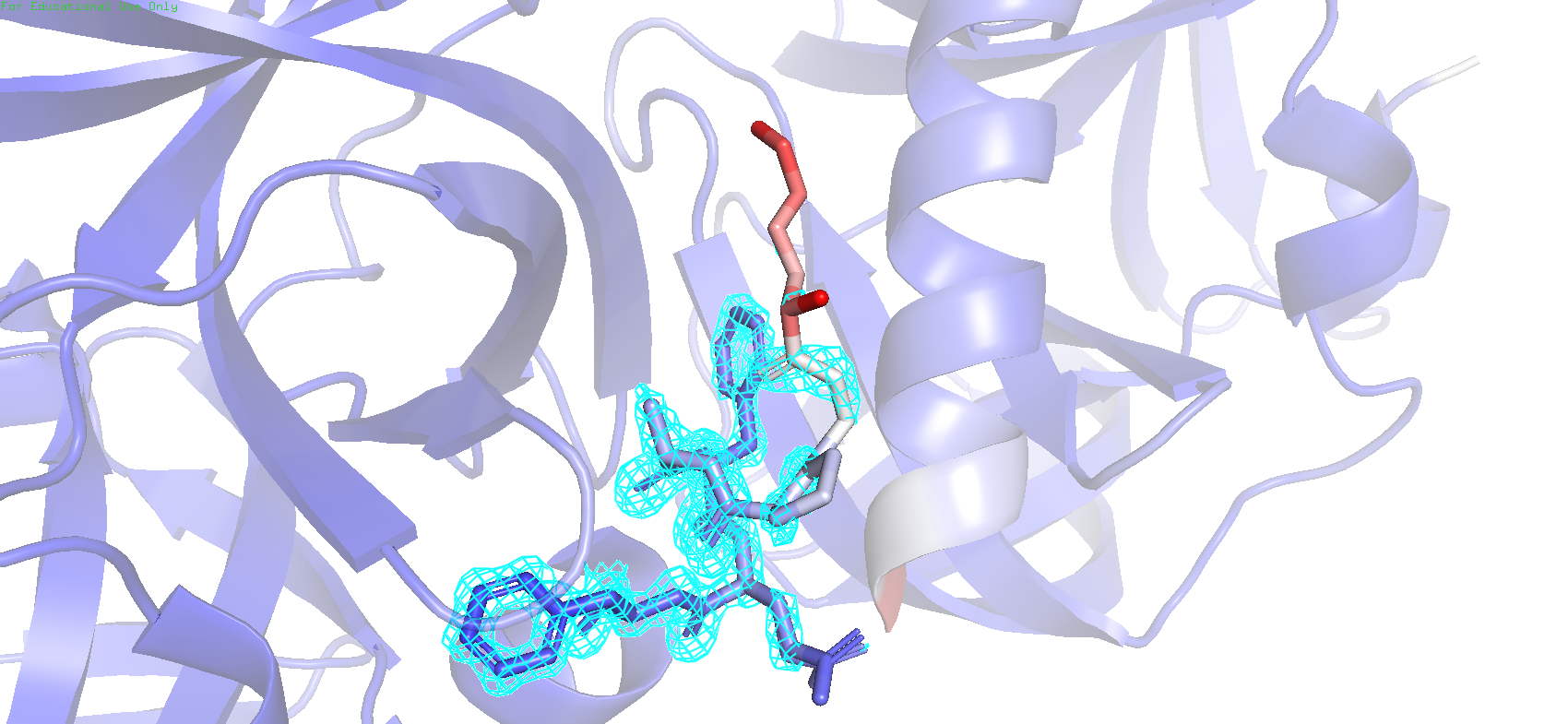
Рис.6. Раскраска по B-фактору вместе с картой электронной плотности на уровне подрезки 2
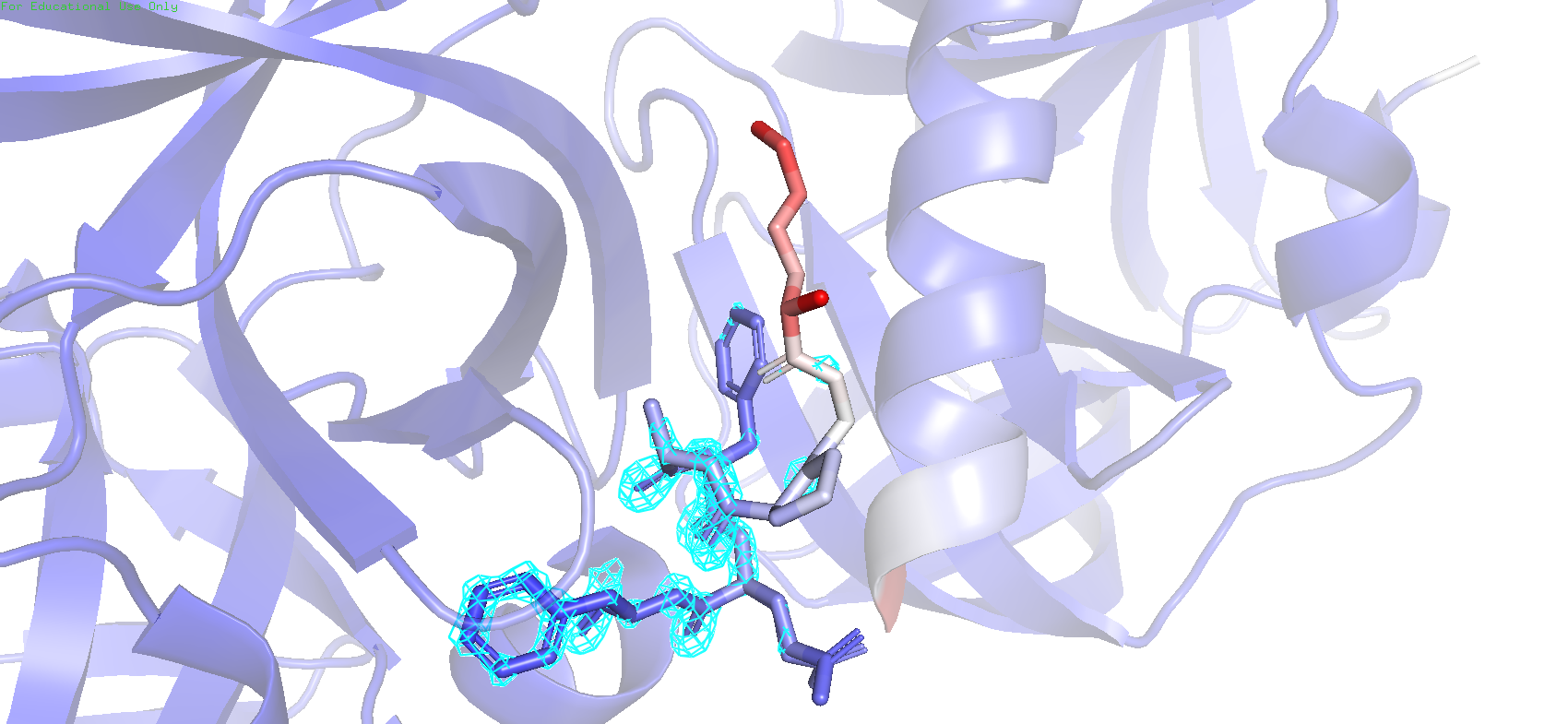
Рис.7. Раскраска по B-фактору вместе с картой электронной плотности на уровне подрезки 3
Можно заметить, что с красных участков на более ранних уровнях подрезки начинает понемногу пропадать отображение электронной плотности, в виду их выскокой подвижности, вследствие чего возникает размытие электронной плотности, и из-за неопределённости расположения ЭП сигнал слабеет.
Белок при анализе его РСА находится не в вакууме или растворе, а в кристалле, и на данном этапе нам нужно восстановить его кристал.

Рис.8. Отображение кристалла белка
Данное отображение было получено при уровне подсечки в 100 ангстрем, и здесь можно увидеть расположение белка в кристалле. Посмотрим же, сколько молекул непосредственно контактирует с исходной молекулой нашего белка. Чтобы лучше видеть зоны контаков был выбран режим surface.
Исходный белок (выделен красным цветом) непосредственно контактирует с 8 молекулами.
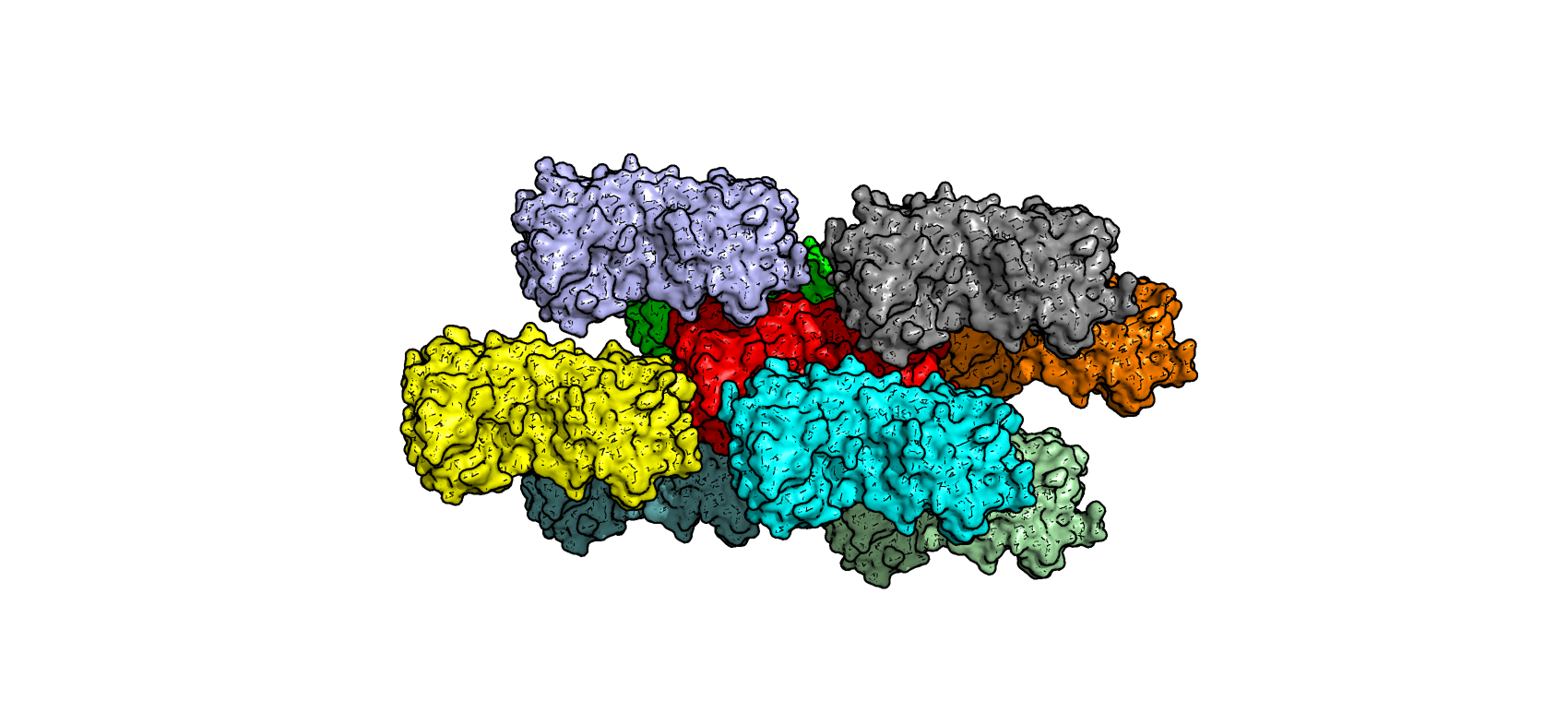
Рис.9. Белок и его соседи по кристаллу
Всего удалось обнаружить примерно 4 уникальные по строению зоны контактов.
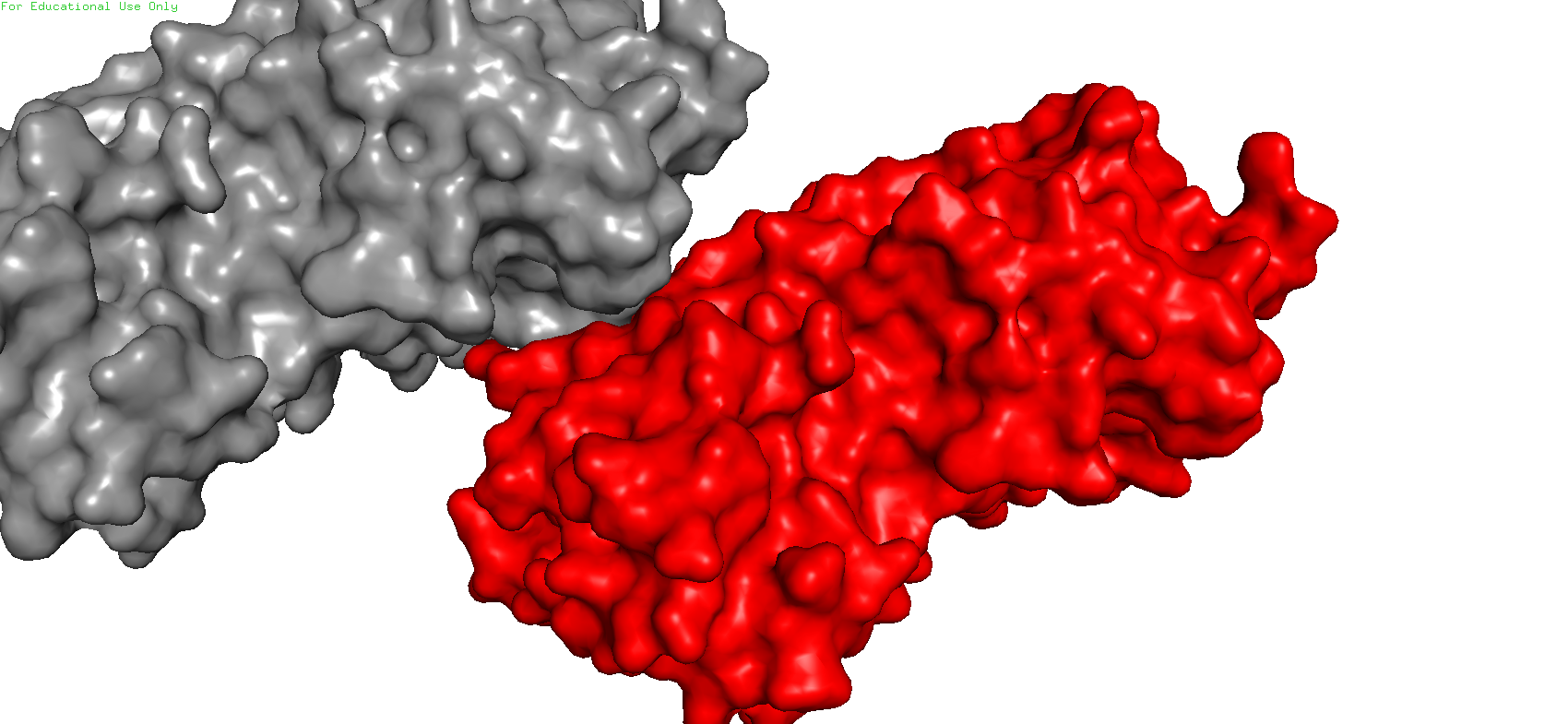
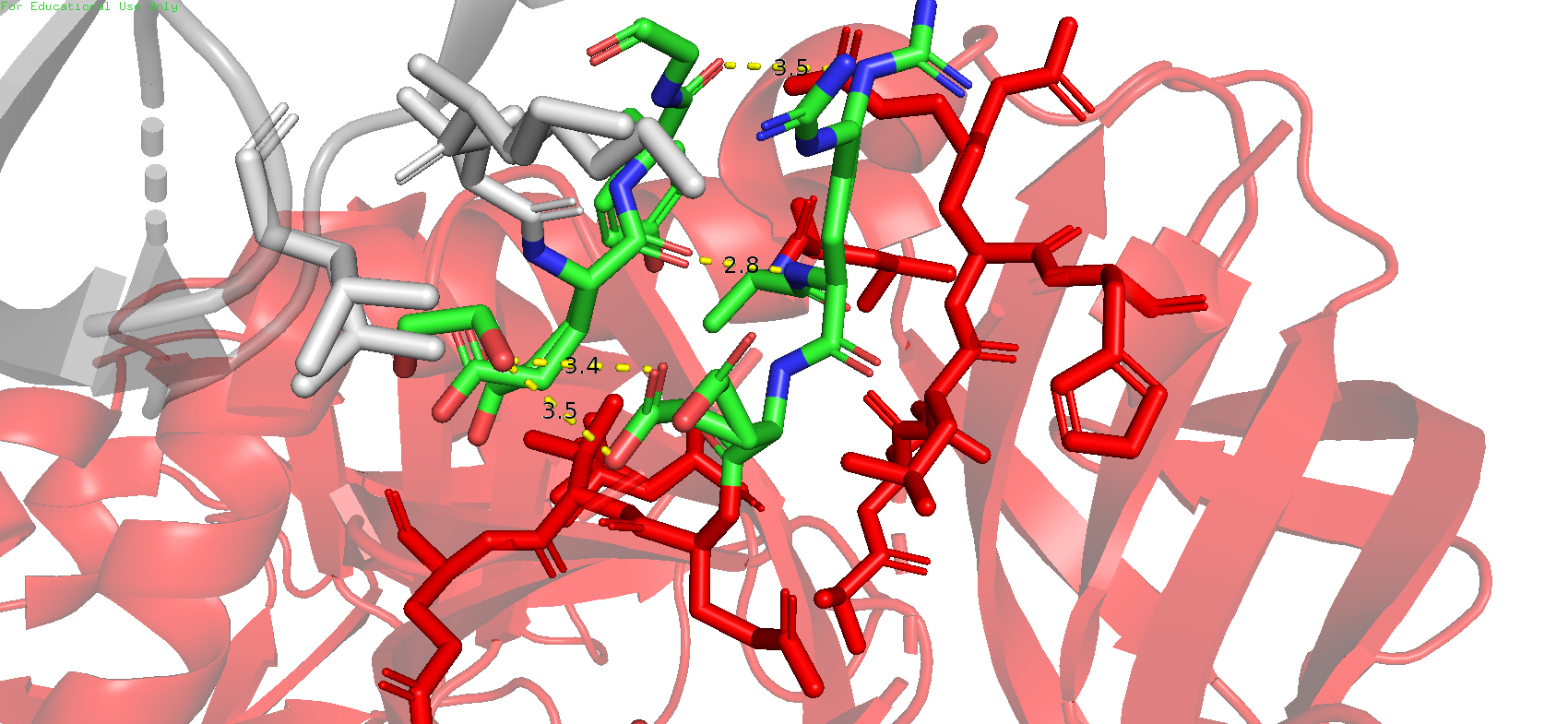
Рис.10. Зона контакта 1. Красный - исходный белок, серый - сосед
Вполне возмонжо, что область контакта 1 поддерживается водородными и ионными взаимодействиями.
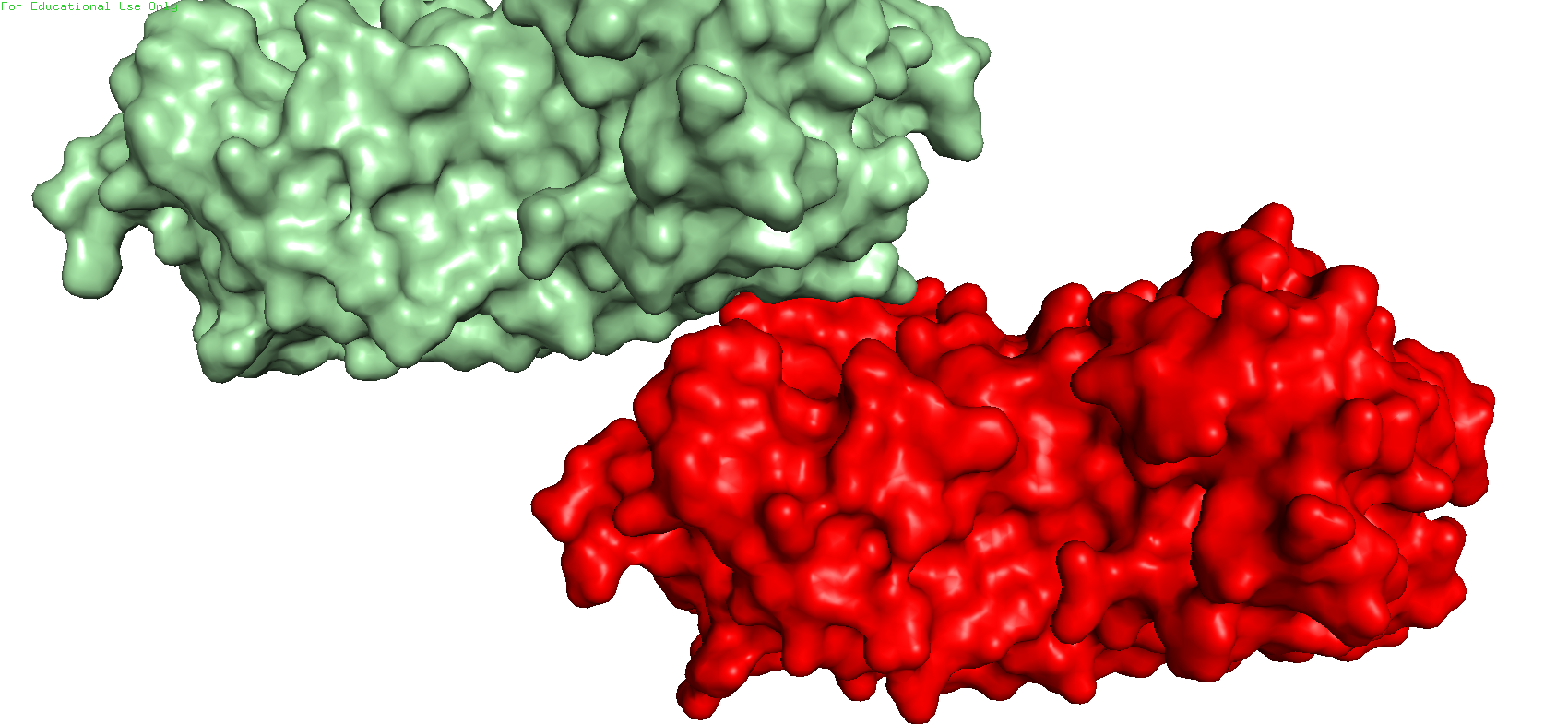
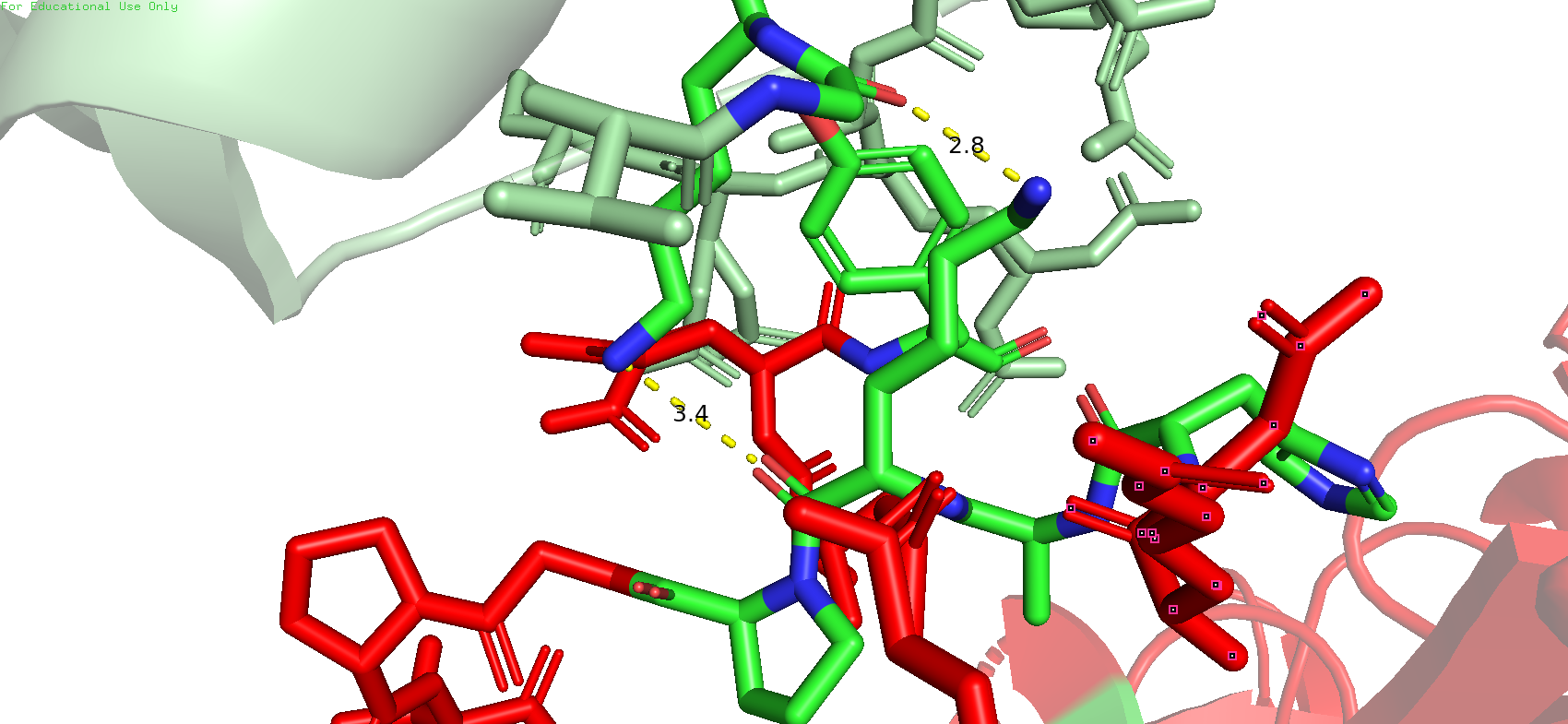
Рис.11. Зона контакта 2. Красный - исходный белок, болотный - сосед
В области контакта 2 также возможно удерживание водородными связями, но выглядет не очень прочно, возможно имеются другие взаимодействия.
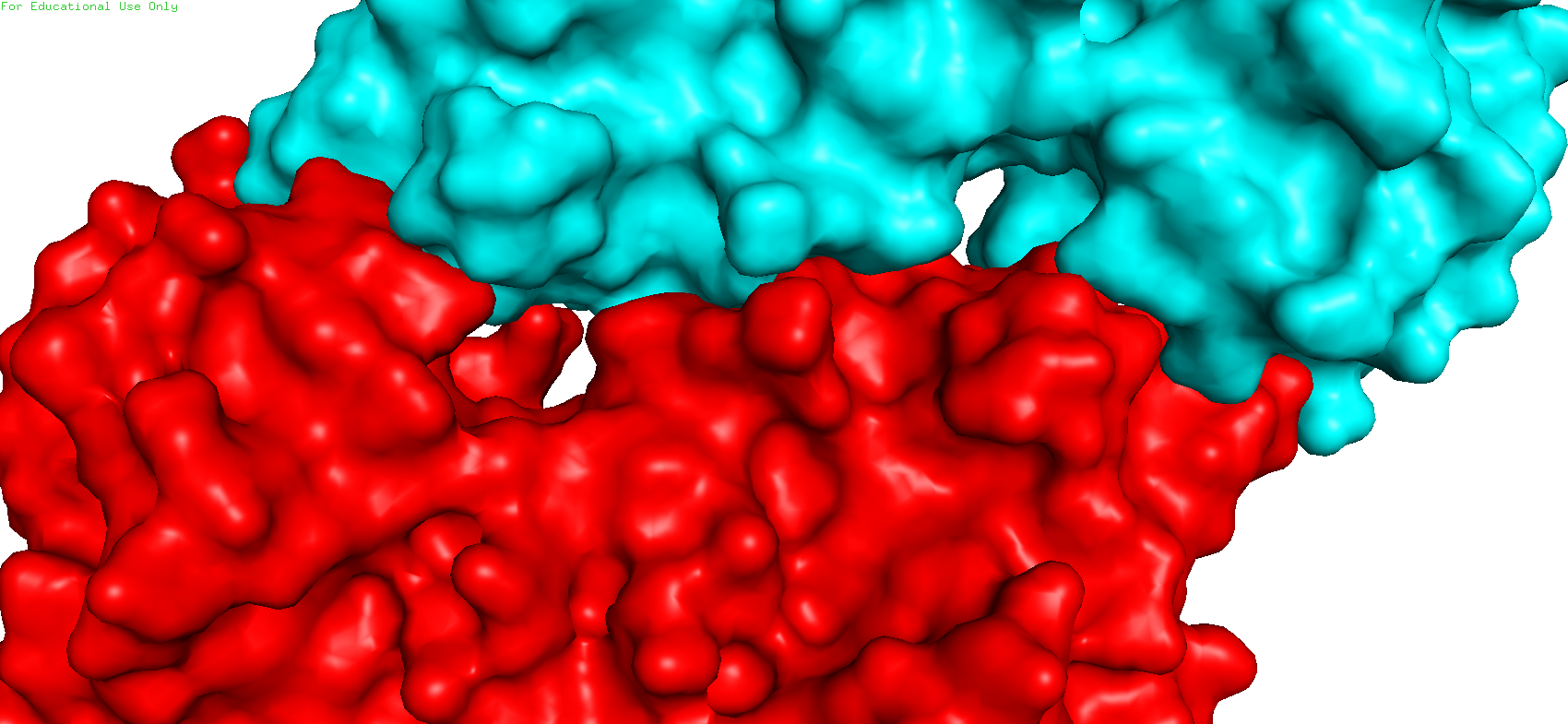
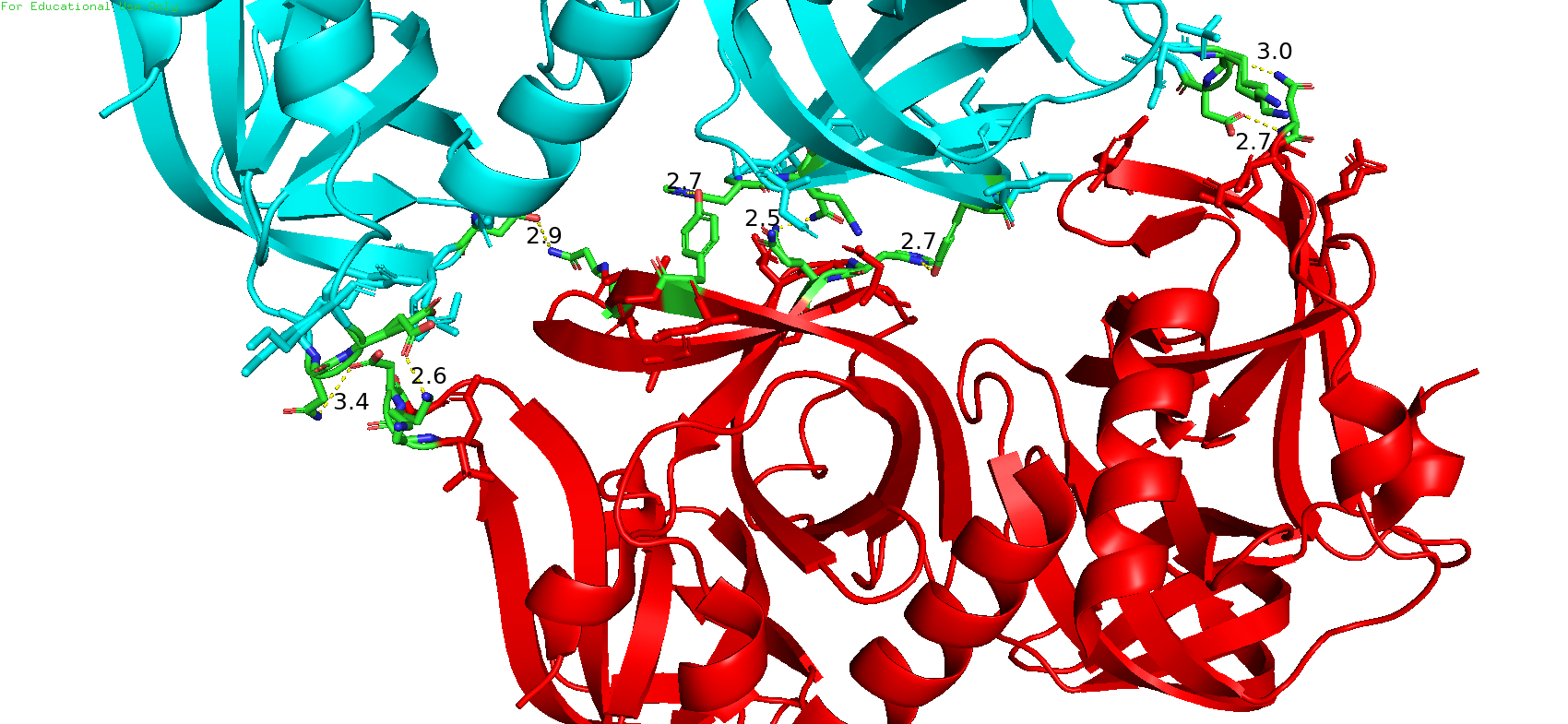
Рис.12. Зона контакта 3. Красный - исходный белок, цианистый - сосед
В данном случае зона контакта 3 довольно обширная, наблюдается довольно немалое число предполагаемых водородный и ионных связей, при этом также вполне возможно наличие и гидрофобных взаимодействий.
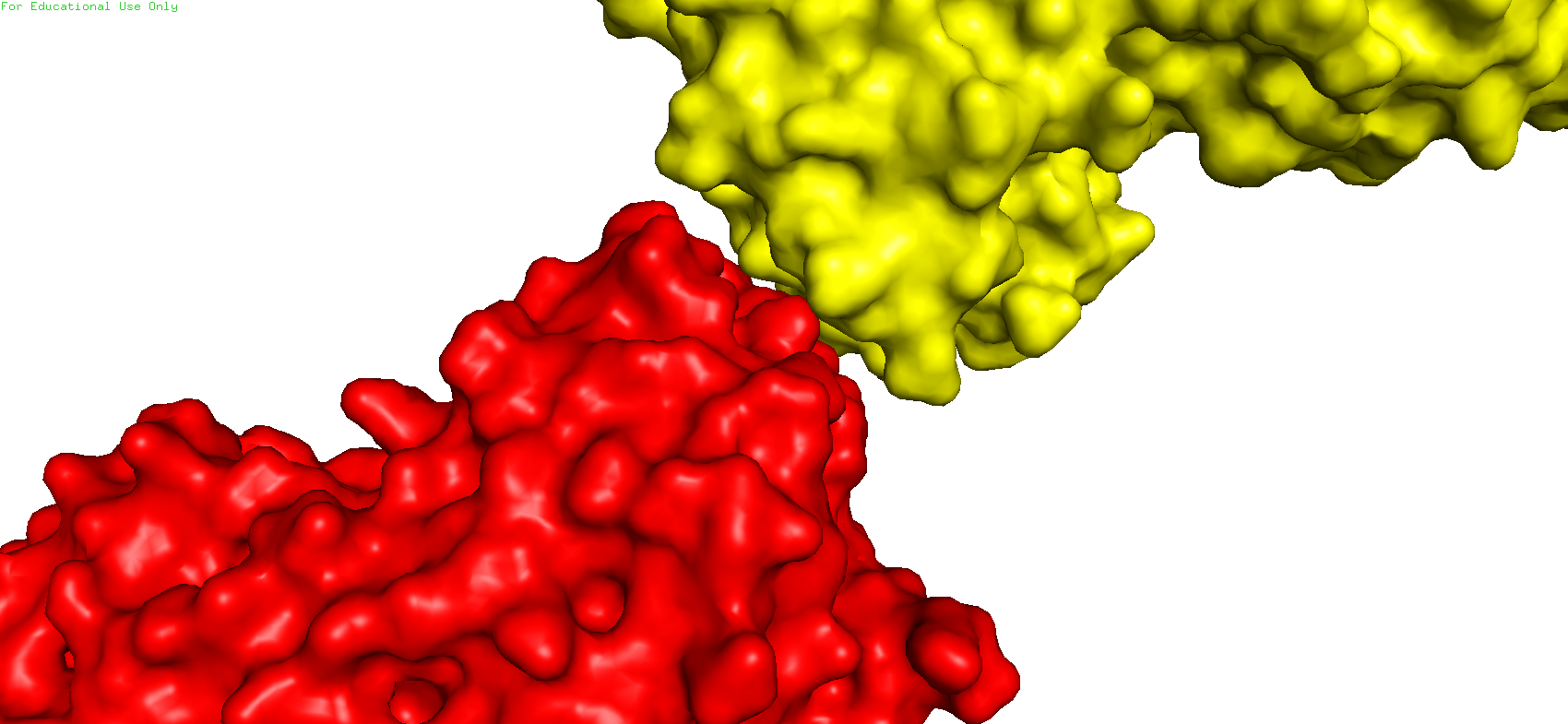
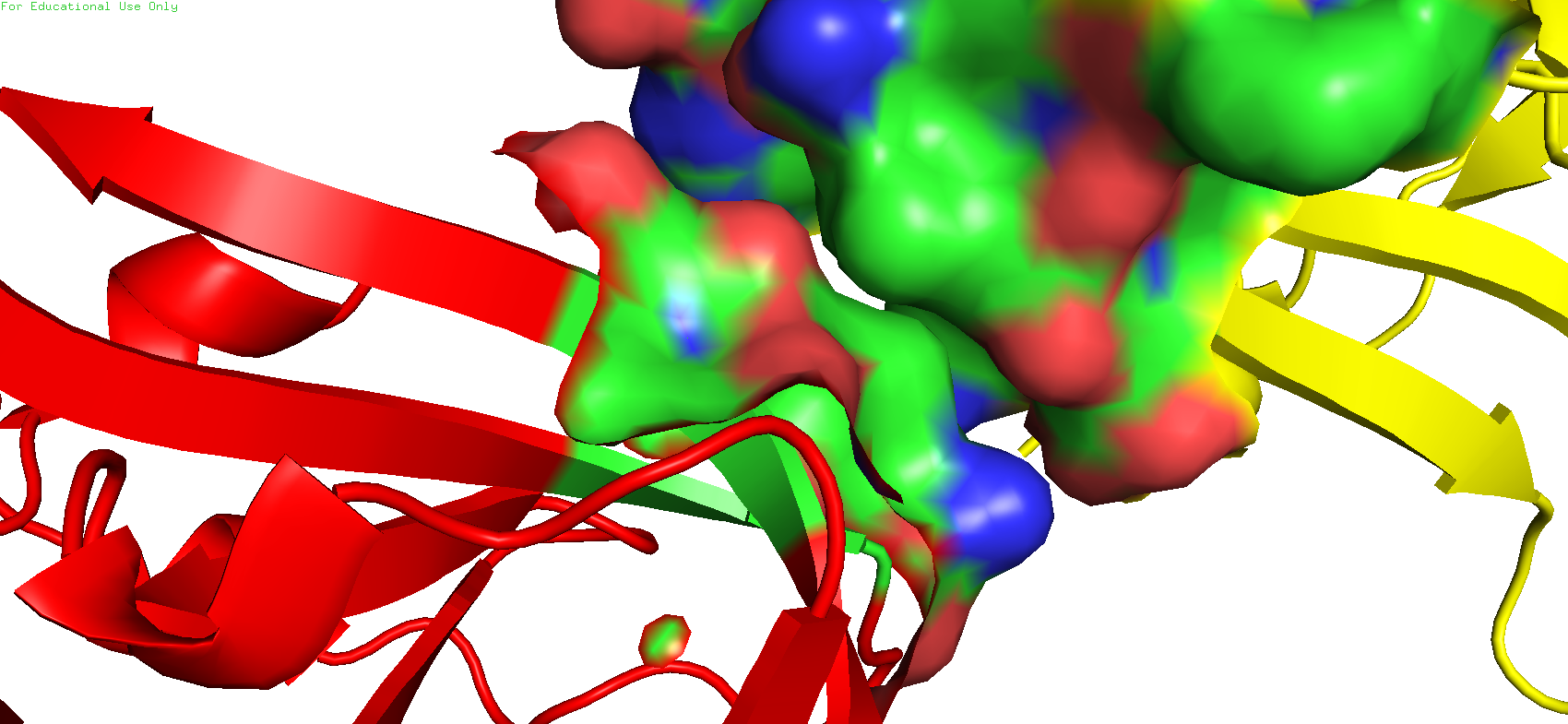
Рис.13. Зона контакта 4. Красный - исходный белок, жёлтый - сосед
В данном же случае больше похоже на то, что контакт поддерживается гидрофобными взаимодействиями.
Об этом вполне свидетельствуют два близко расположенных лейцина, боковые радикалы которых являются гидрофобными
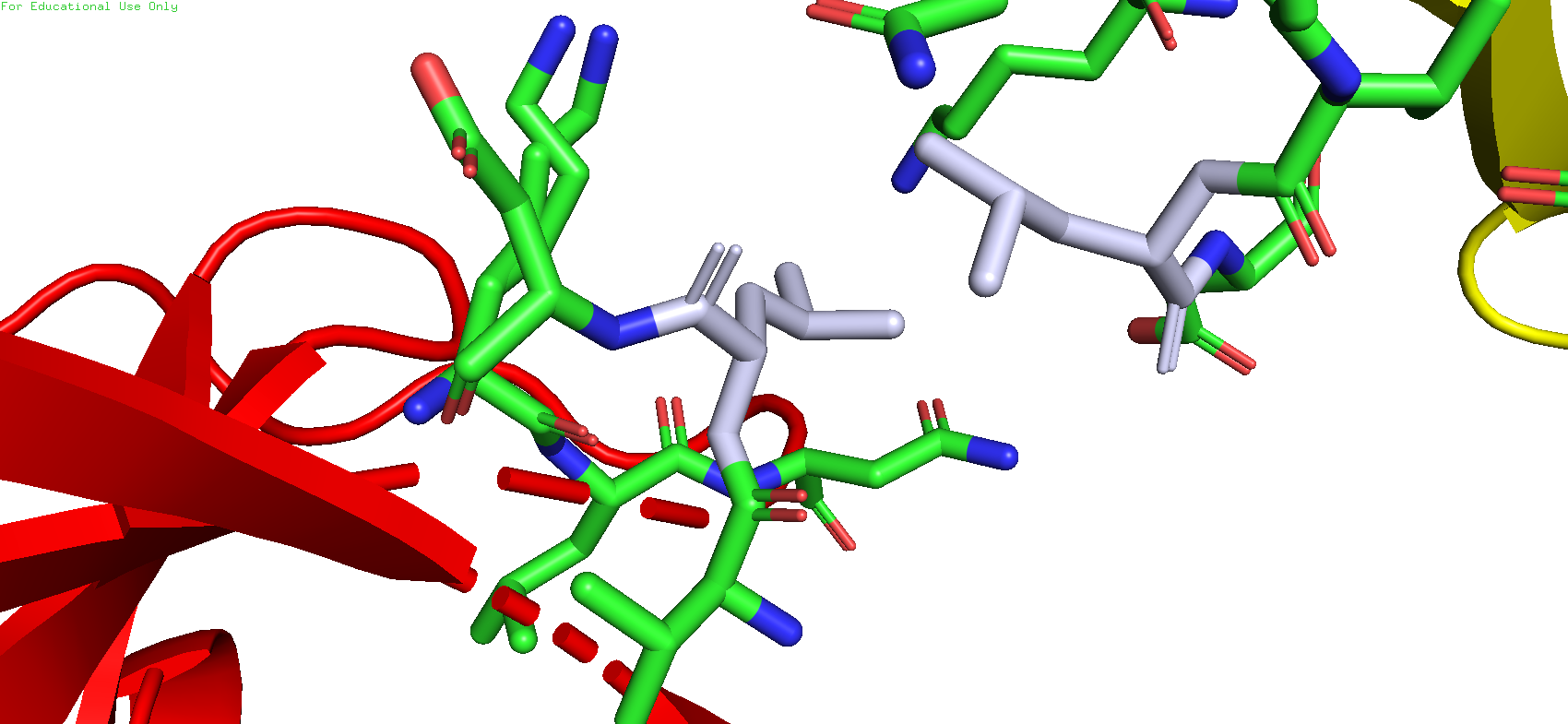
Рис.14. Лейцины (серебристые) в зоне контакта 4
Как по мне, то такие взаимодействия в той или иной степени могут существовать помимо кристалла и в природе, но более реалистичной в этом плане мне кажется зона контакта 3. Остальные также могут быть, но наверное менее вероятно.
© Иззи Антон,2020