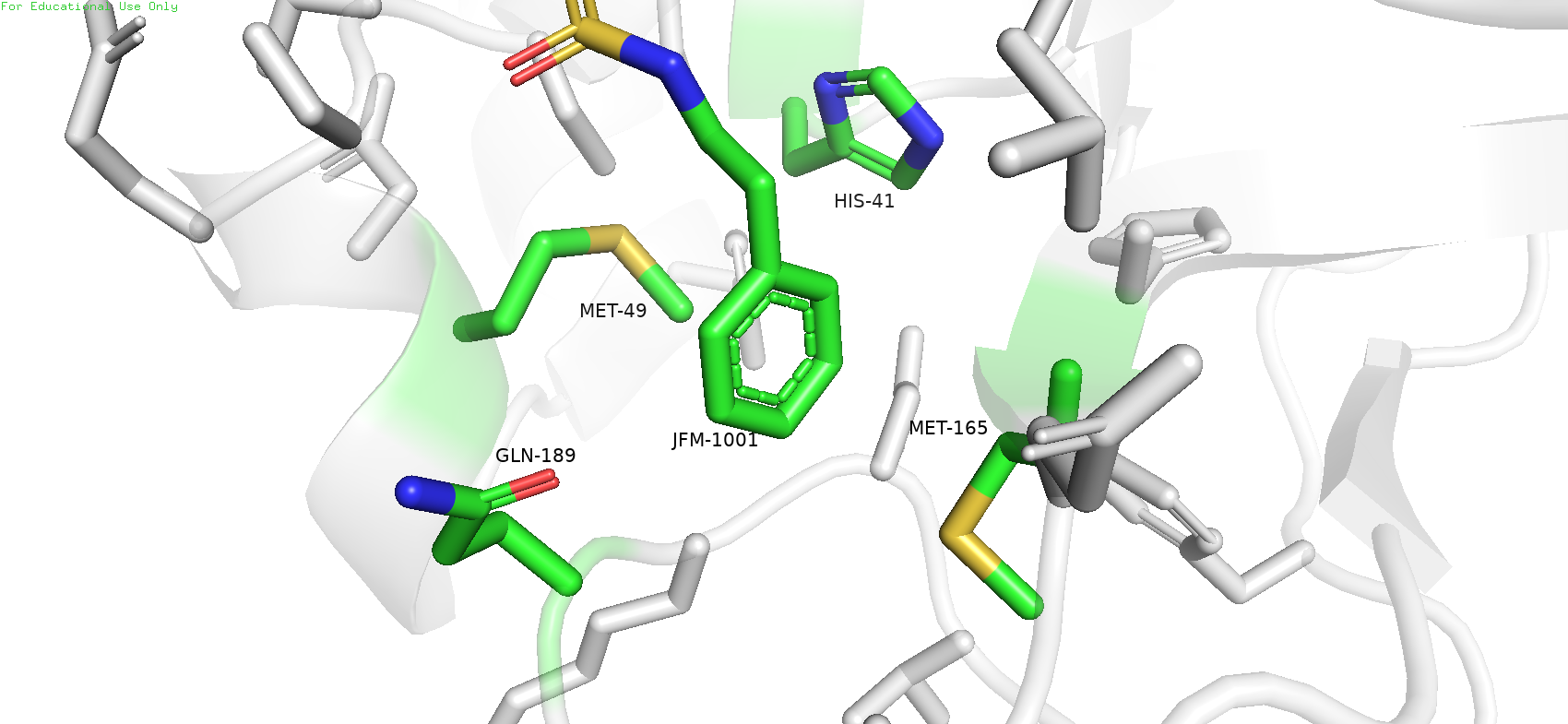
На данном этапе нужно было обработать с помощью Pymol структуру белковый молекулы и показать наиболее значимые взаимодействия с лигандом. PDB_ID: 5R7Y

Рис.1. Лиганд JFM и его окружение
В данном случае были выделены два метионина 49 и 165, 41-й гистидин и 189-глутамин. Мне кажется, что эти остатки могут иметь важное значение при взаимодействии с лигандом (даже несмотря на то, что они не образуют с ним водородных связей, по крайней мере так показал Pymol)
Ссылка на сессию: Сессия
При загрузке двух белковых структур огромной разницы на первый взгляд не наблюдалось, разве что у первого образца было отображено большее число молекул воды.
Однако уже при загрузке электронной плотности наблюдается интересная картина. В качестве объекта для рассмотрения был выбран не весь белок, а остов остатков с 49 по 62.
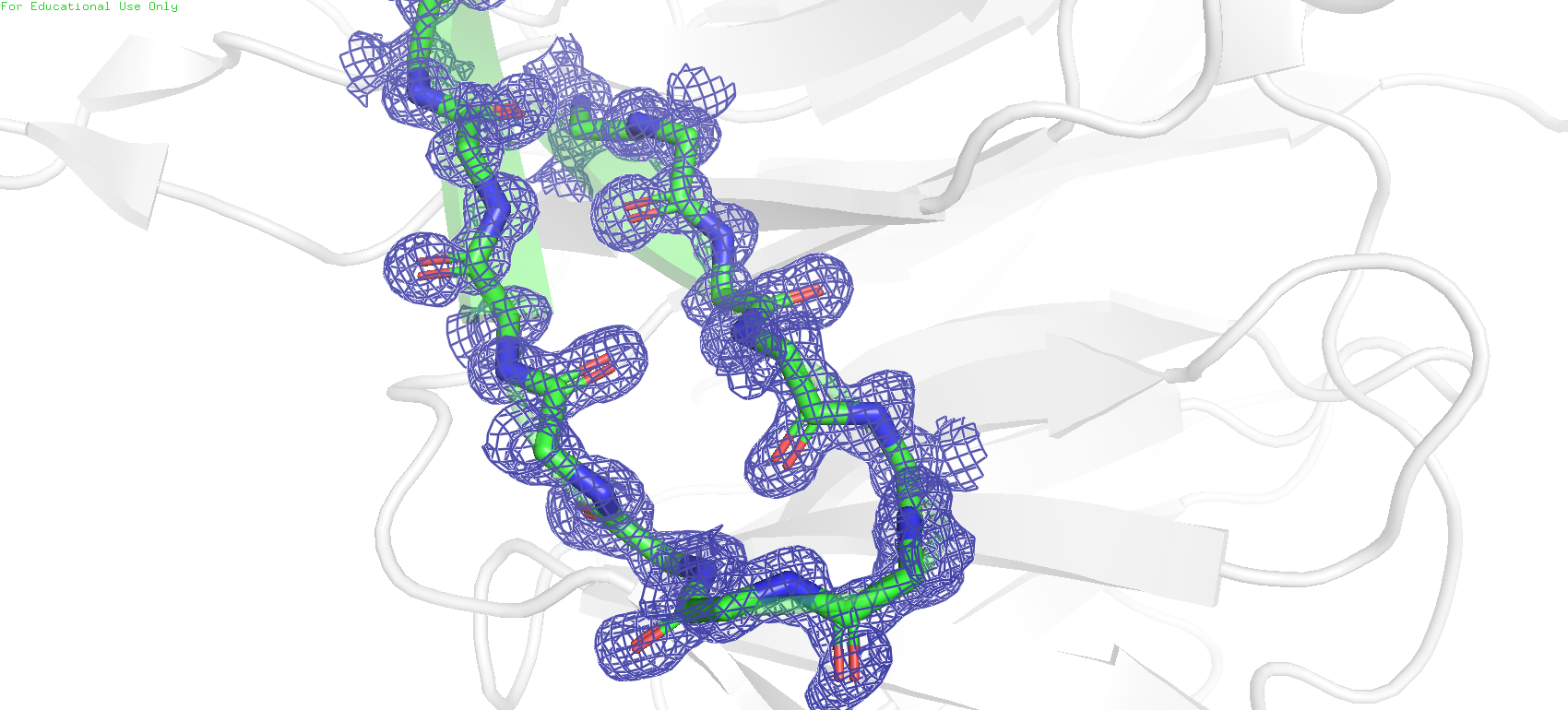
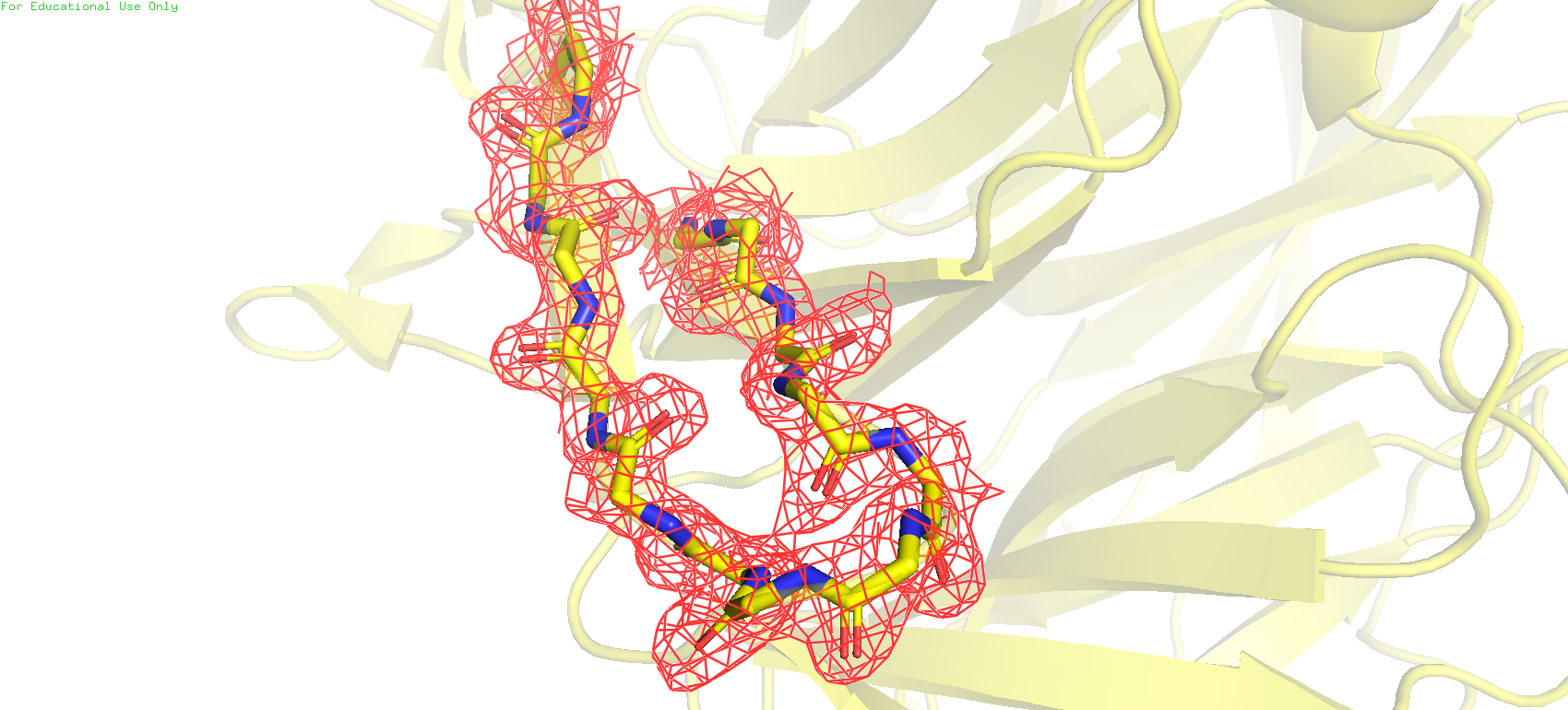
Рис.2. Визуализация карты электронной плотности для двух моделей белка. Параметры: уровень подрезки = 1, carve = 1.8
При сравнении этих двух карт сразу же в глаза бросается одна интересная деталь. В первом объекте электронная плотность изображена в якобы "округлой", гладкой форме, так что вполне возможно различить очертания отдельных атомов. Во втором же случае плотность имеет форму "полигонов", неаккуратная, очертания отдельных атомов различить нельзя, совершенно другое качество.
Также тут можно заметить ещё один интересный момент, если посмотреть на остовы 52 и 56 остатков в структуре второго образца. Создаётся ощущение, что здесь электронная плотность кислорода 52 остатка перекрывается с таковой у азота 56 остатка.
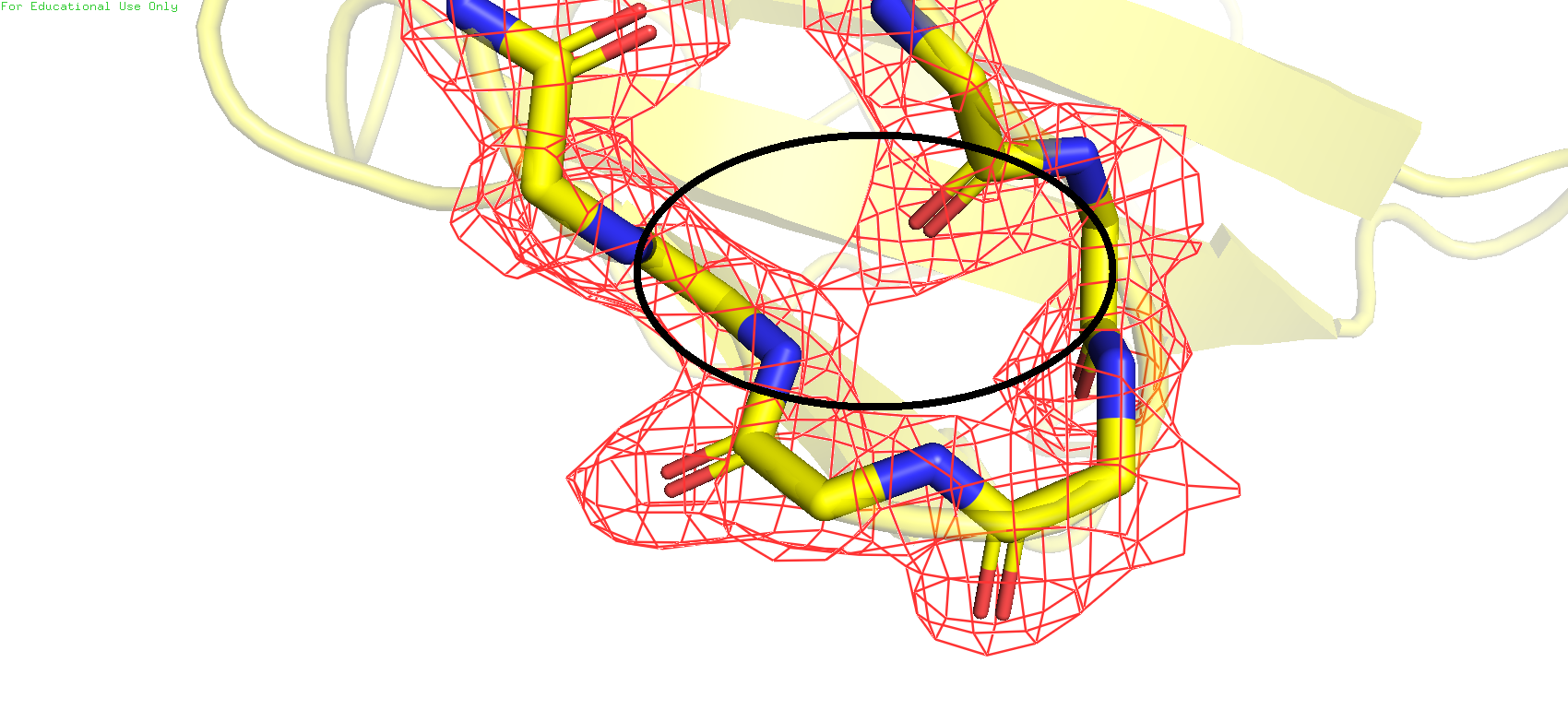
Рис.3. ЭП остатков 52 и 56 в структуре 2GVX
При этом если посмотреть на электронные плотности остатков 52 и 56 первой структуры, то ничего подобного заметить нельзя. Это при том, что обе карты были получены при одинаковом значении подрезки = 1 и carve = 1.8
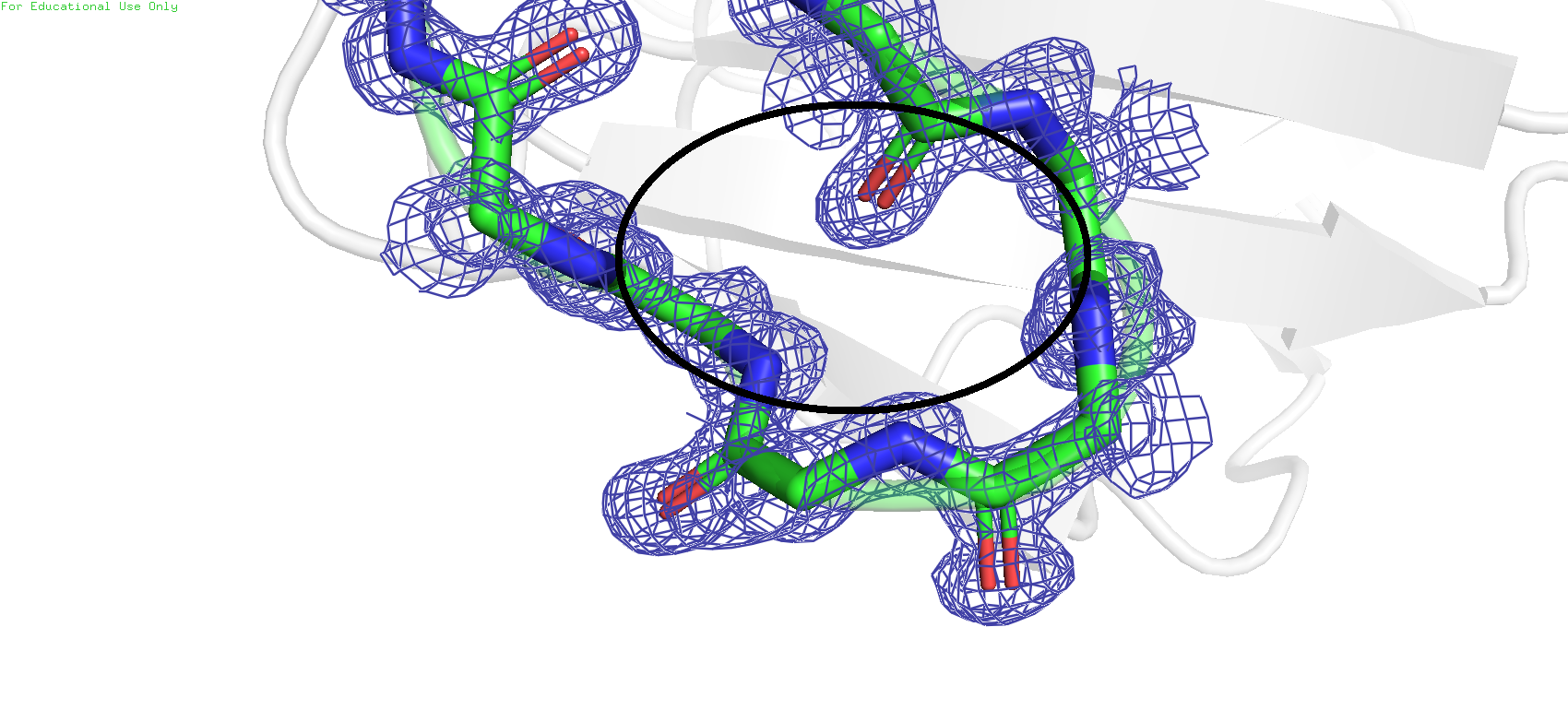
Рис.4. ЭП остатков 52 и 54 в структуре 1PJX
Это также свидетельствует о существенных различиях в качестве моделей, возможно из-за более низкого уровня обработки второго образца и создаётся ощущение перекрывания электронных плотностей остова этих двух остатков, чего нет в первом объекте. Пока что можно сделать вывод, что качество карты электронной плотности у объекта 2GVX довольно сильно хромает. Посмотрим какая информация о них хранится на страницах этих PDB
Собственно, ожидания подтвердились. Разрешение структуры 1PJX составляет 0.85 ангстрем, а разрешение структуры 2GVX - целых 2.00 ангстрема. Обе структуры были получены методом X-ray diffraction, и возможно проблема кроется в том, как проводились эксперименты по получению данных структур. Заглянем в раздел Experiments и посмотрим, какая информация там хранится. В первом случае про процесс кристаллизации расписано мало, единственная информация которая дана - рН = 6.5, для образца 2GVX же указано название метода (VAPOR DIFFUSION, HANGING DROP), и помимо pH ещё и температура. К сожалению, по этим параметрам сравнить данные структуры полноценно не получится. По содержанию растворителя сами кристаллы практически одинаковы - 43.34 у 1PJX и 43.4 у 2GVX. Источники излучения у обоих объектов также одинаковы - синхротроны. Есть различия в детекторах - у 1PJX это IMAGE PLATE, у 2GVX это CCD. Про различие самих детекторов на данный момент сказать не могу, но полагаю, что они вполне могли сыграть роль в различиях карты электронных плотностей. Про используемую длину волны трудно сказать, у 2GVX она составляла 1.05 ангстрем, а у 1PJX она не указана. В принципе для первого ID некоторое количество важных данных пропущено, поэтому к сожалению трудно сделать определённый вывод по процессу подготовки карты образцов. Но то что у 2GVX она качеством хуже чем у 1PJX - это факт.
По данному ID была построеная карта электронной плотности остова всего белка с тремя разными уровнями подрезки. Чтобы ничего не мешалось и ничего лишнего не было убрано, был выбран параметр carve = 1.5
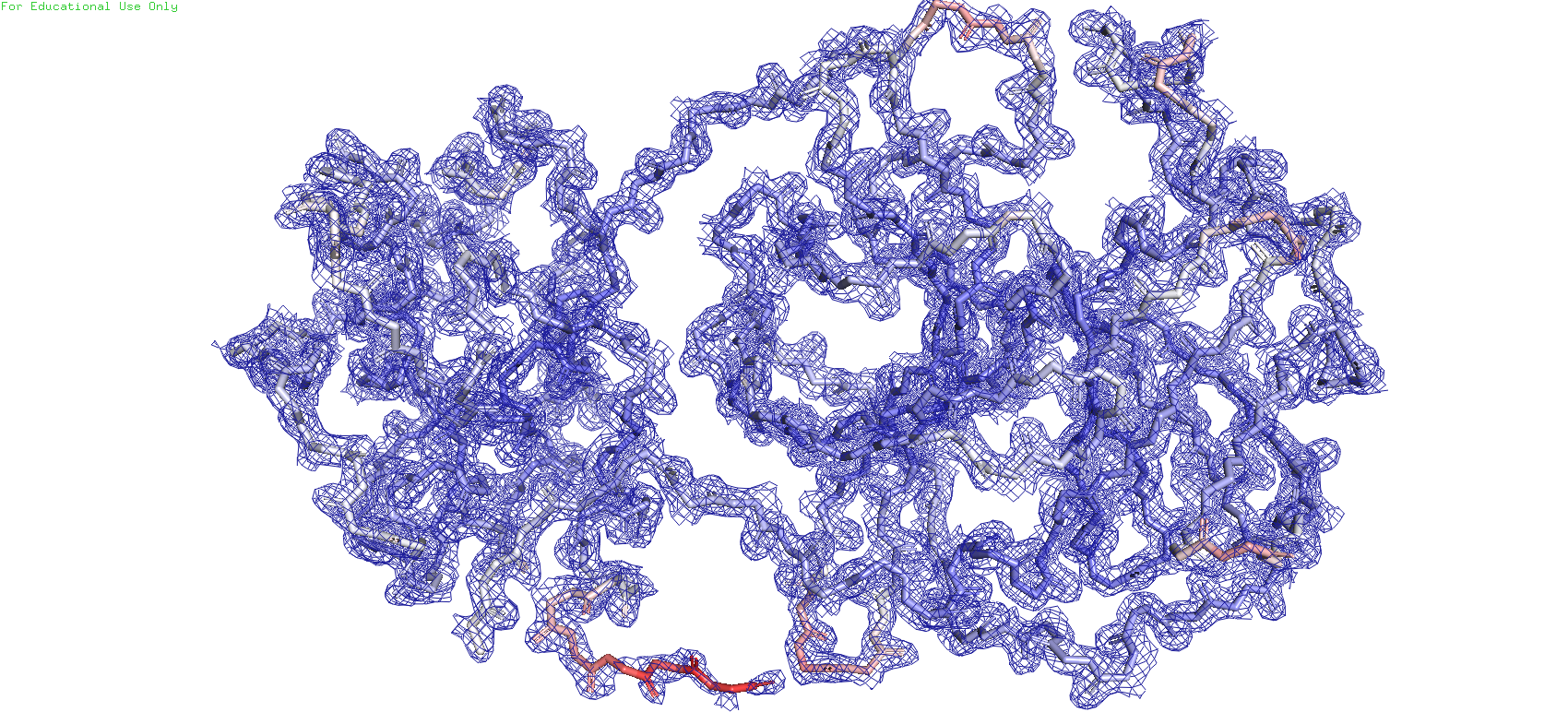
Рис.5. Карта ЭП с уровнем подрезки = 1
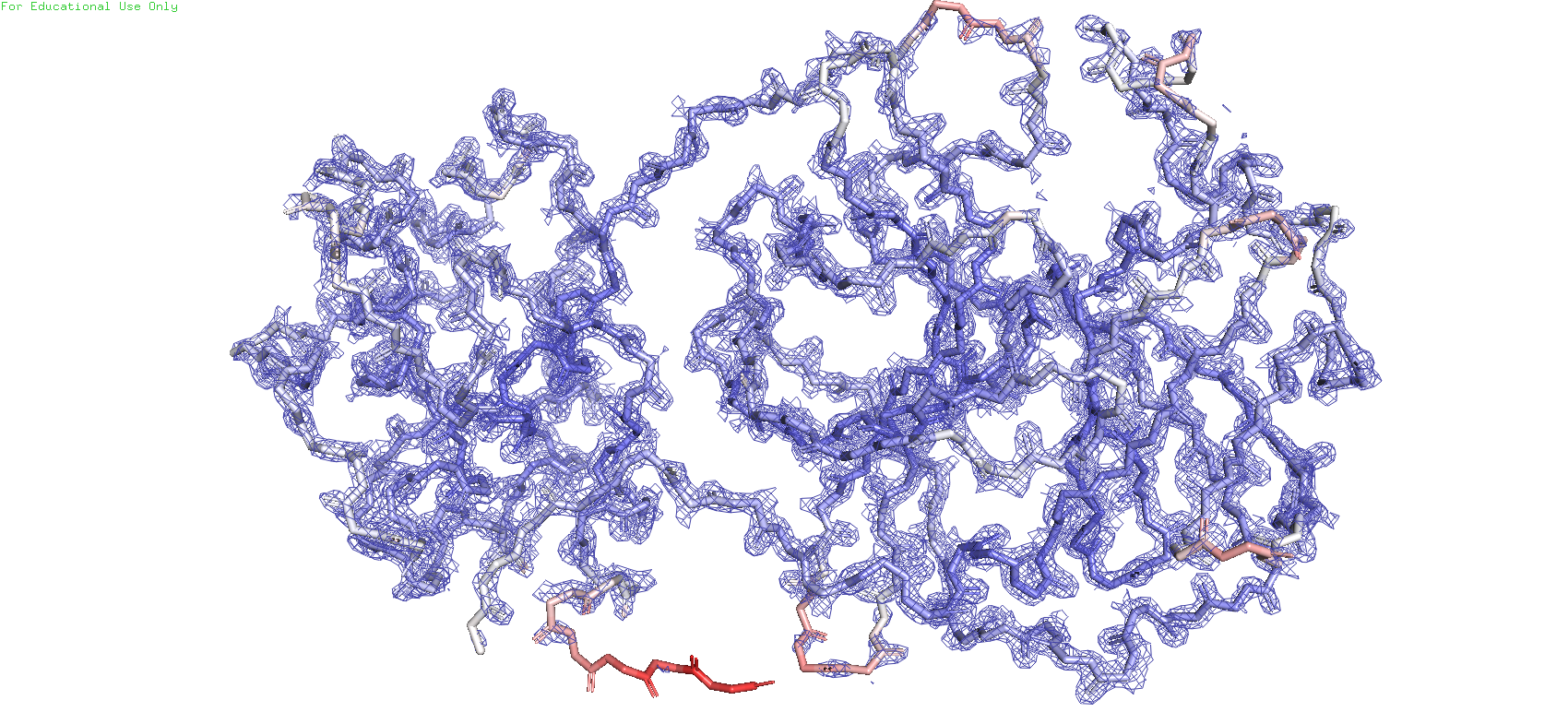
Рис.6. Карта ЭП с уровнем подрезки = 2
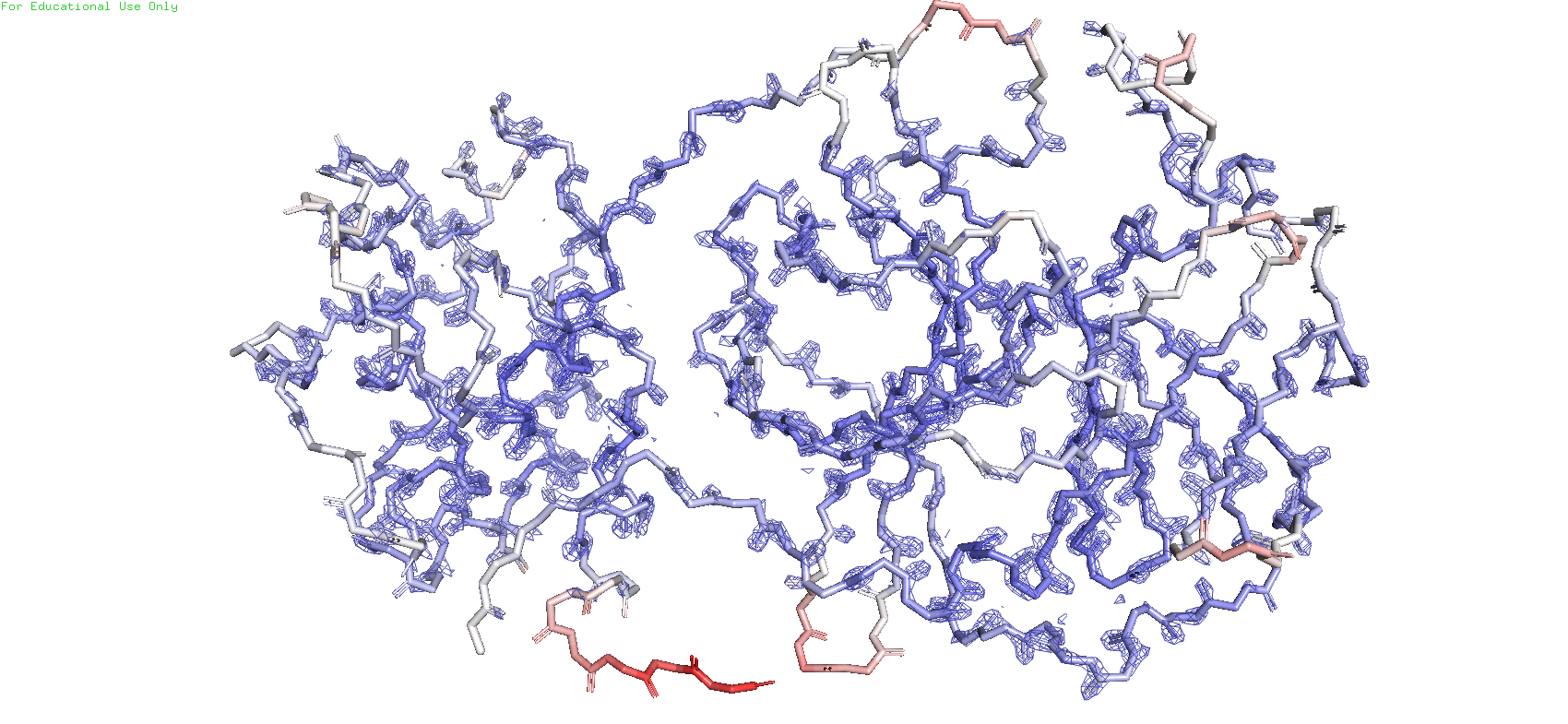
Рис.7. Карта ЭП с уровнем подрезки = 3
Можно заметить, что при увеличении значения уровня подрезки mesh начинает пропадвть на некоторых участках остава, при этом сохраняясь на остальных. А на части остатков 304 и 302 он отсутствует даже при уровне подрезки = 1. С чем же это может быть связано? Раскрасим остов по B-фактору, который показывает смещение атомов от их среднего положения в кристаллической структуре. Иными словами, данная раскраска покажет, на каком уровне подвижности находятся атомы. Синий - наименее подвижные, белый - средней подвижности, розоватый - повыше среднего, красный - наиболее подвижные. Изначально максимальное значение покраски стояло 73, но для большей вариации я решил взять поменьше - 60. И таким образом можно заметить, что красные участки остова ввмду своей активной подвижности начинают терять mesh на самых низких уровнях подрезки, белые полностью лишь в конце, а синие даже на самом высоком уровне подрезки сохраняют участки с mesh'ем. Возможно это связано с тем, что ввиду подвижности атомов ЭП начинает размазываться, что возможно может влиять на сигнал. Также ещё стоит учесть, что на самом последнем уровне подрезки на светло-синих участках остова mesh сохраняется в основном вокруг атомов кислорода и азота, которые являются электроотрицательными атомами, и поэтому более сконцентрированная вокруг них ЭП может давать наиболее сильный сигнал при рентгеноструктурном анализе.
На данном этапе также нужно было рассмотреть карту электронной плотности белка с ID 5R7Y при разных уровнях подрезки, но уже вокруг лиганда. Значение carve также было выбрано 1.5
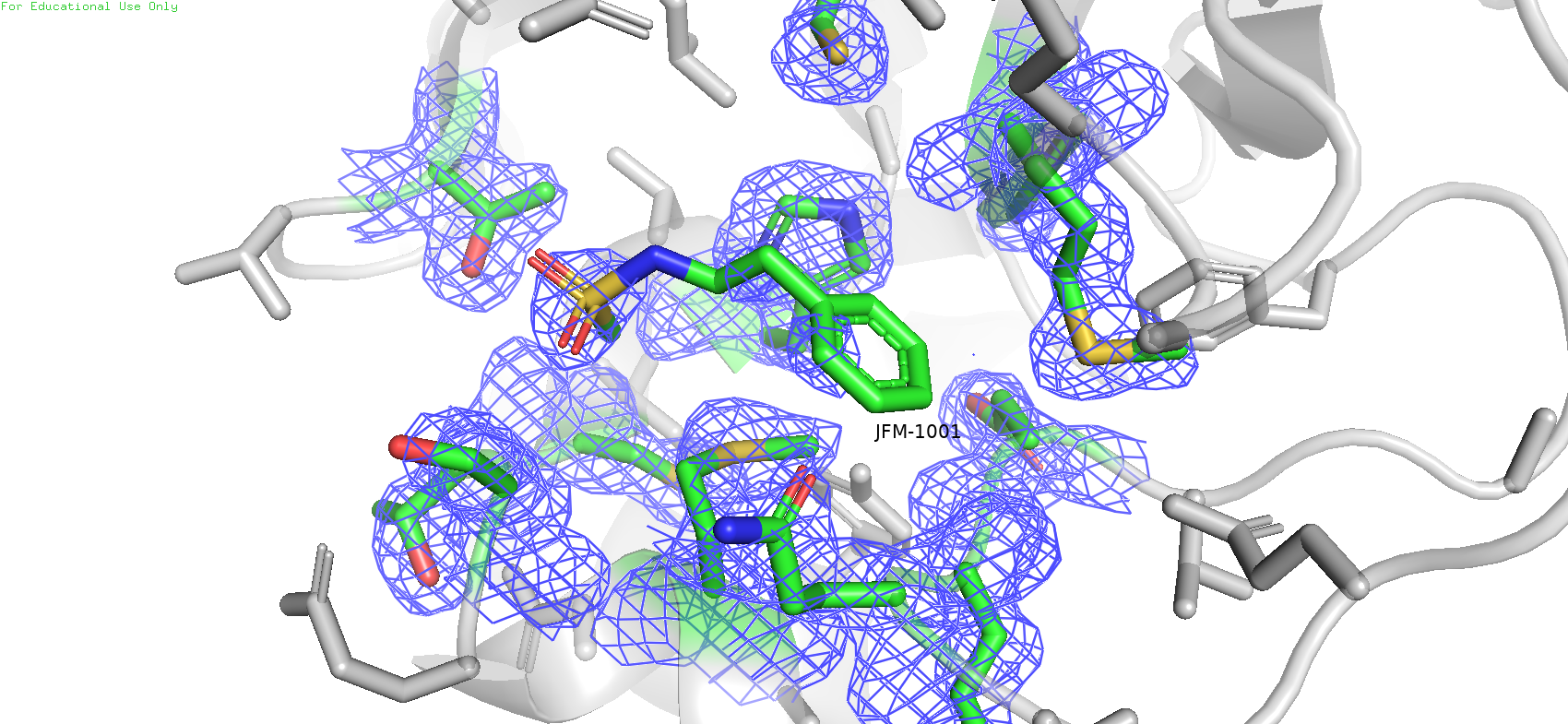
Рис.8. Карта ЭП области вокруг лиганда с уровнем подрезки = 1
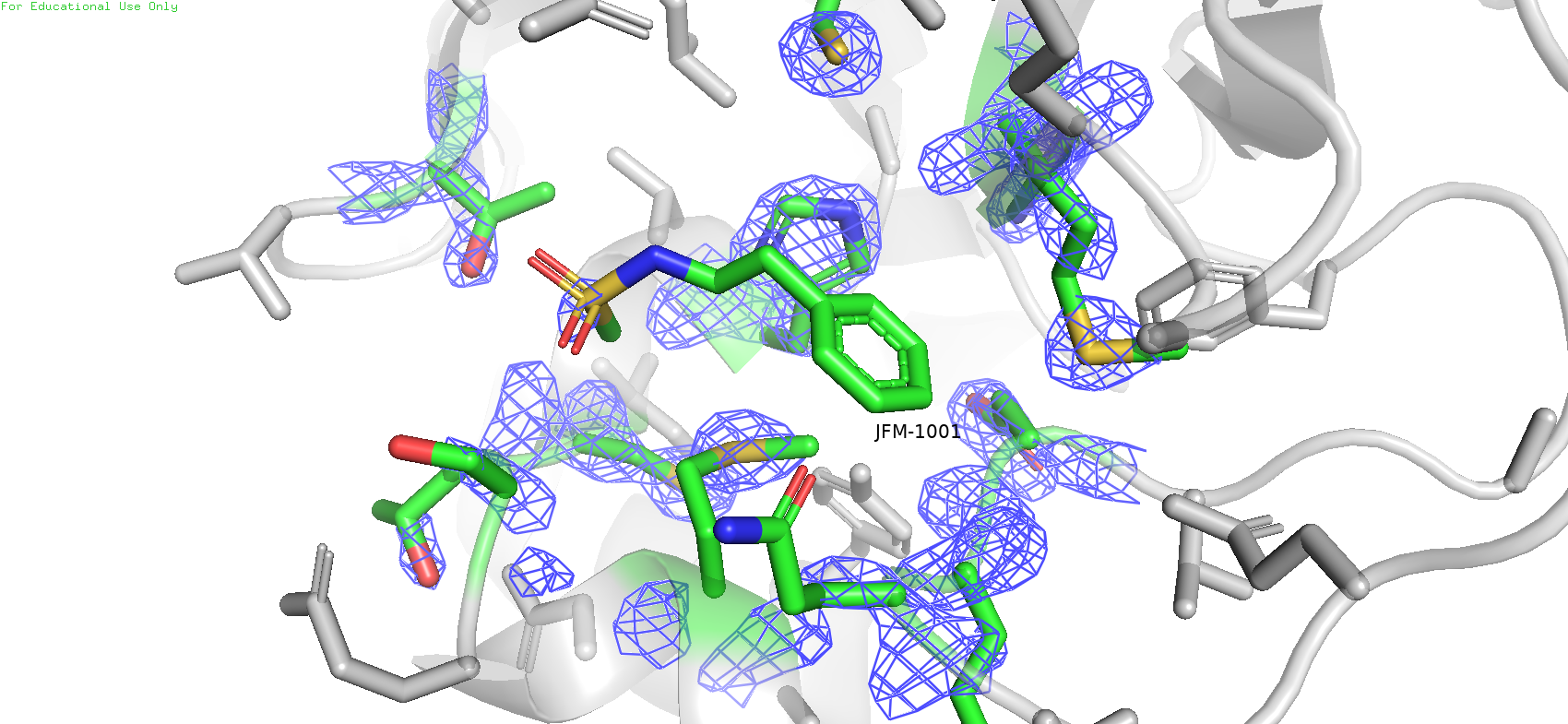
Рис.9. Карта ЭП области вокруг лиганда с уровнем подрезки = 2
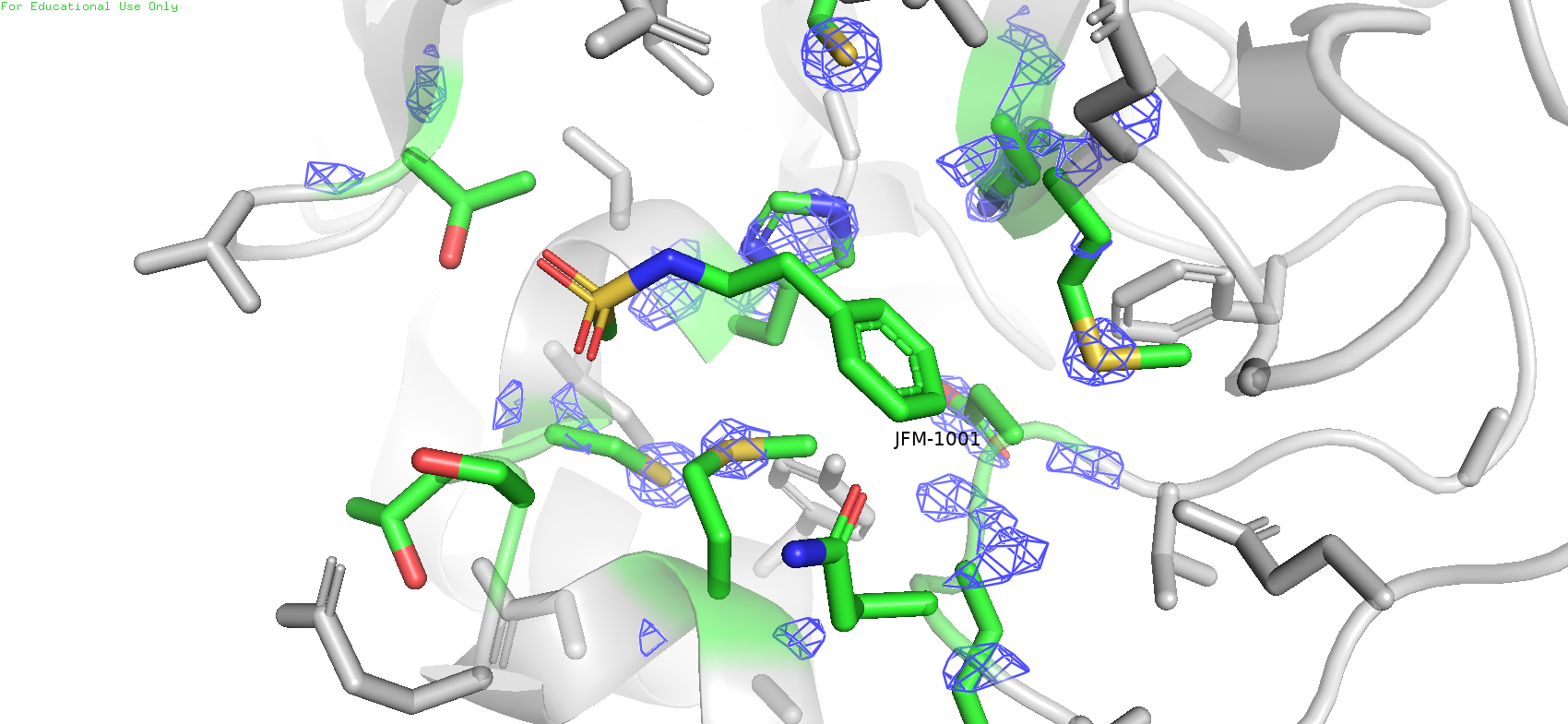
Рис.10. Карта ЭП области вокруг лиганда с уровнем подрезки = 3
В данном случае также заметно уменьшение уровня покрытия mesh'ем с увеличением уровня подрезки. Причём на более высоком уровне плотность остаётся в основном на атомах с большим числом электронов, таких как сера у метионинов, и ещё на имидазольном кольце гистидина. Причём что интересно, если ещё больше поднять уровень подрезки (напр. до 5), то плотность на гистидине пропадёт, однако на некоторых серах метионинах ещё останется, но не на всех:
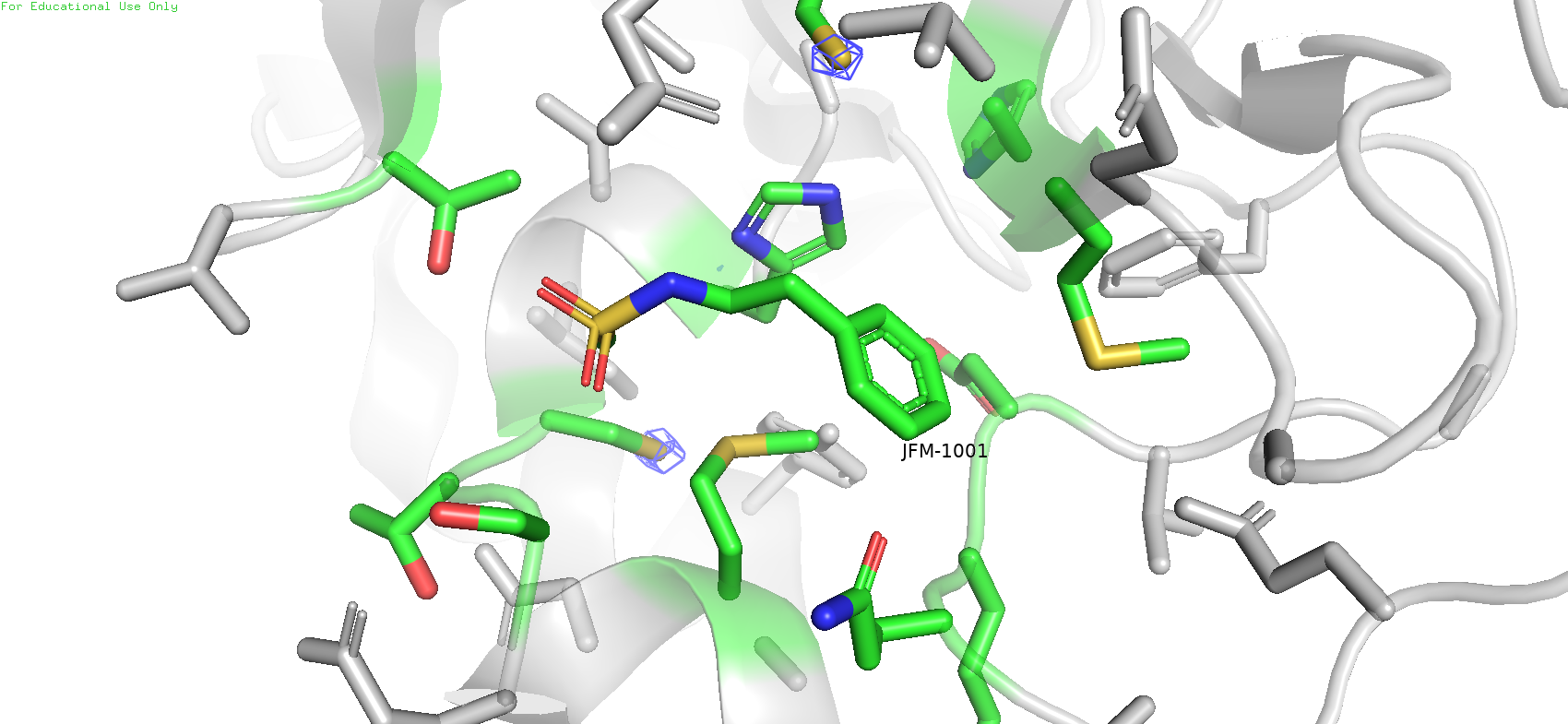
Рис.11. Карта ЭП вокруг лиганда с уровнем подрезки 5
А теперь нюансы. С самого начала можно заметить, что на лиганде практически отсутствует покрытие mesh'ем, за исклюыением сульфоамидной группы. А также при большом уровне подрезки с атомов серы некоторых метионинов пропадает ЭП, но на некоторых всё равно остаётся. На данный момент единственное объяснение, которое приходит в голову - подвижность атомов. Из-за размазывание плотности её становится тяжело уловить. Но вполне возможно, что этому есть и другое объяснение, на 100% точно утверждать не могу. И ведь что интересно, на уровне подрезки 0.5 она вполне имеется у лиганда:
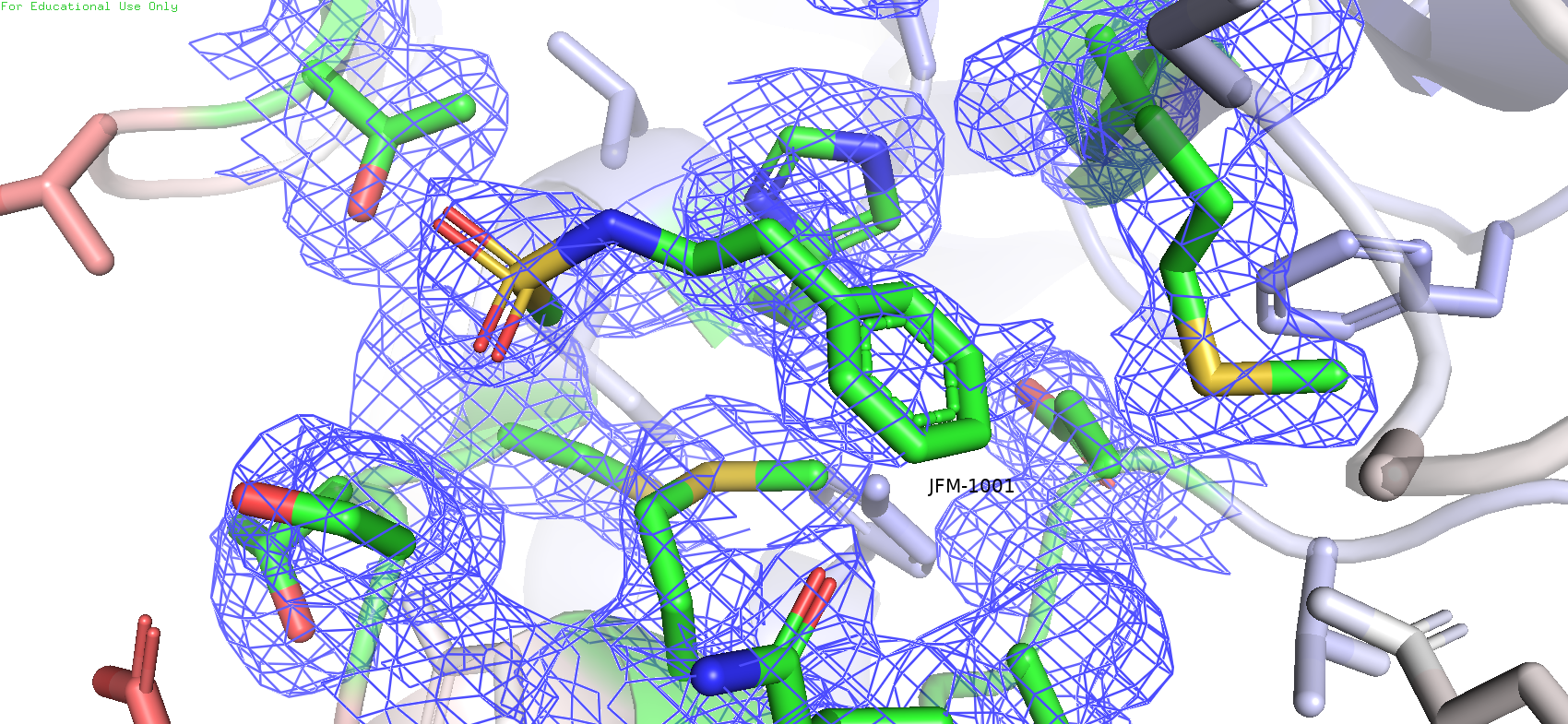
Рис.12. Карта ЭП вокруг лиганда с уровнем подрезки 0.5
© Иззи Антон,2020