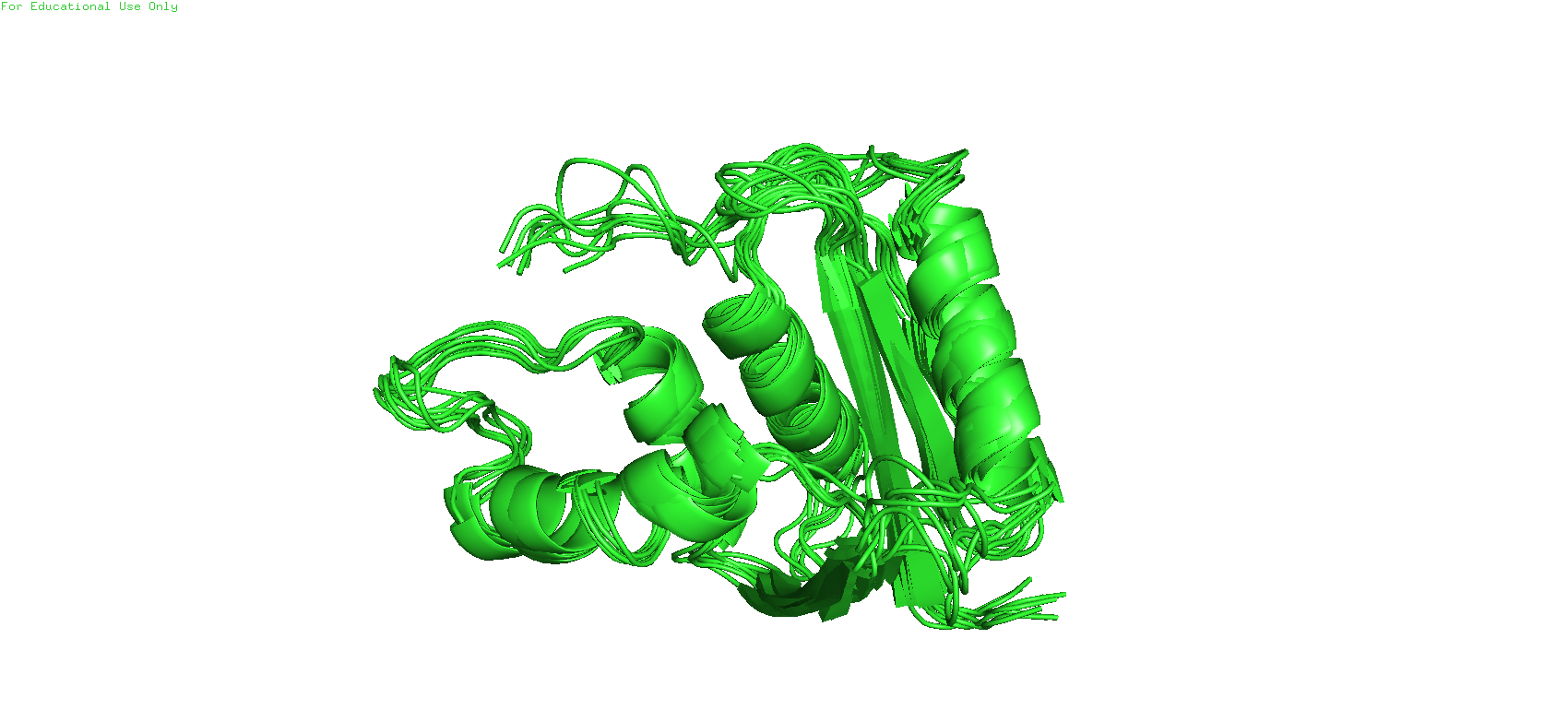
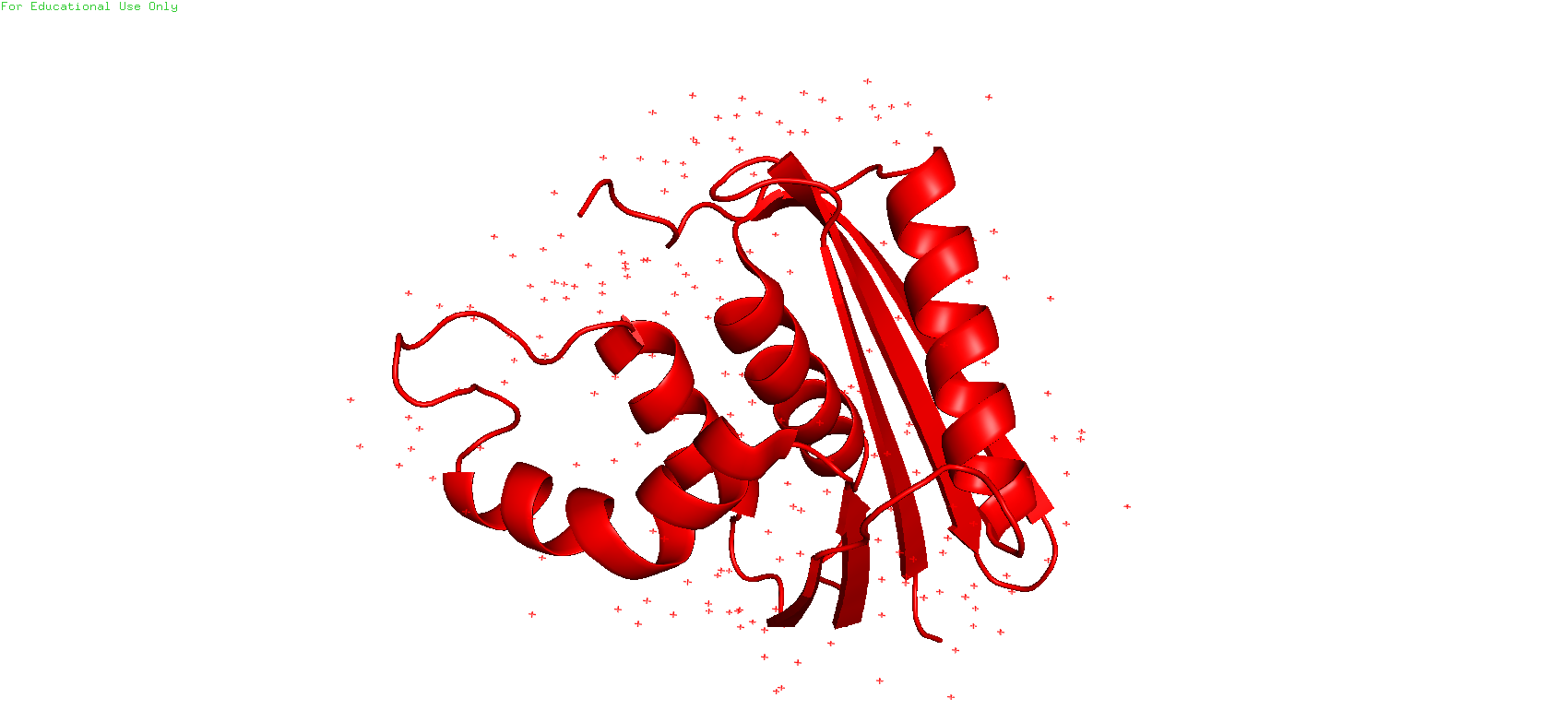
В данном задании было предостаавлено два PDB_ID. 1RCH соответствует структуре, полученной методом ЯМР, 1JL1 - полученной методом РСА. Белок называется D10A E. coli ribonuclease HI.
Всего представлено 8 моделей ЯМР для 1RCH. Разрешение РСА для 1JL1 составляет 1.3 ангстрем.


Рис.1. Структуры рибонуклеазы HI, полученные с помощью ЯМР (слева) и РСА (справа).
С данных фотографий трудно разглядеть существенные различия между моделями (разве что в многослойности ЯМР-модели - "толстая" структура левой картинки - наложения друг на друга ЯМР-моделей). Поэтому детали нужно рассмотреть поближе, при наложении друг на друга этих двух структур.
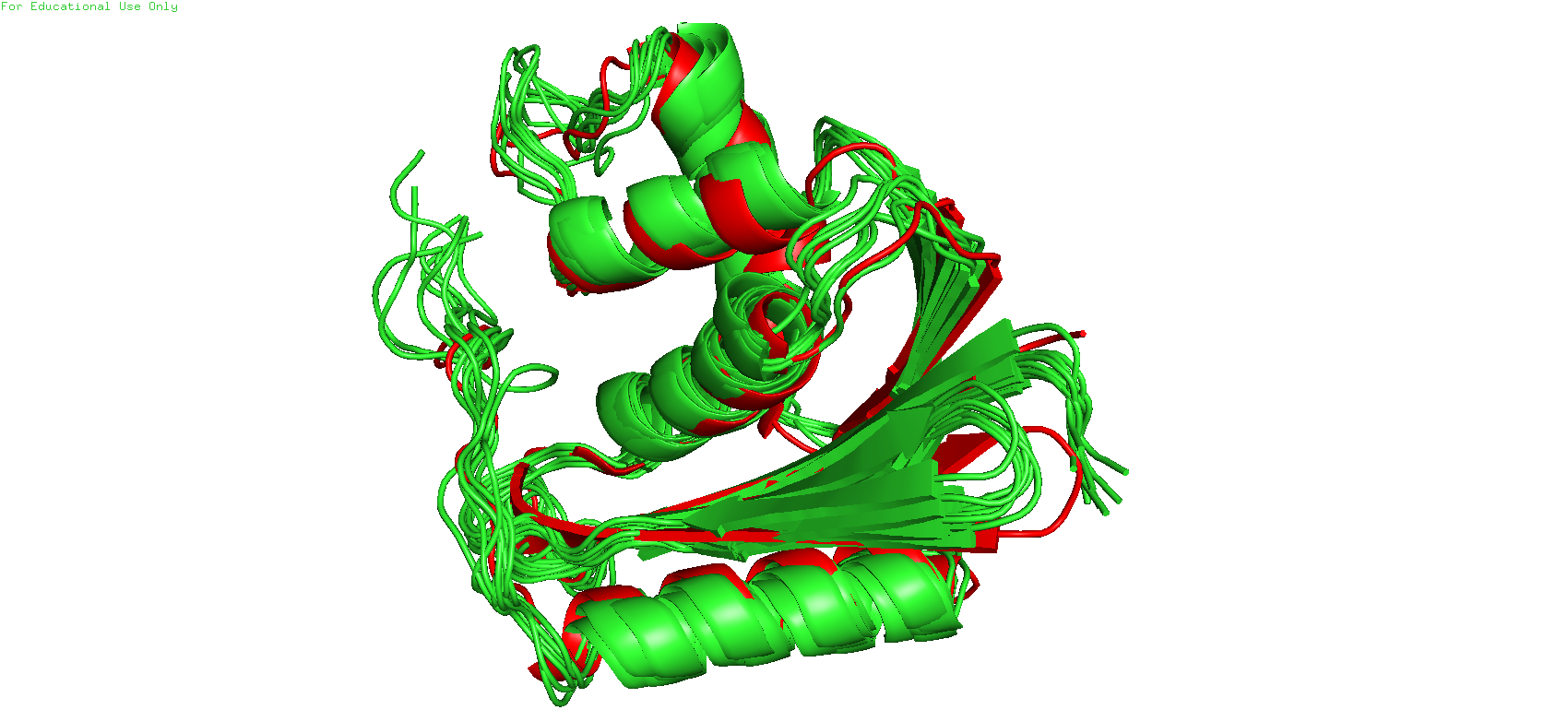
Рис.2. Наложение двух моделей друг на друга
Первое что можно заметить при общем просмотре двух налоденных друг на друга моделей - несовпадение неструктурированных участков. Практически ни в каком месте они не выравниваются нормально друг на друга в двух моделях, в отличие от напимер альфа-спиралей, налодение которых во многом вполне нормальное2.
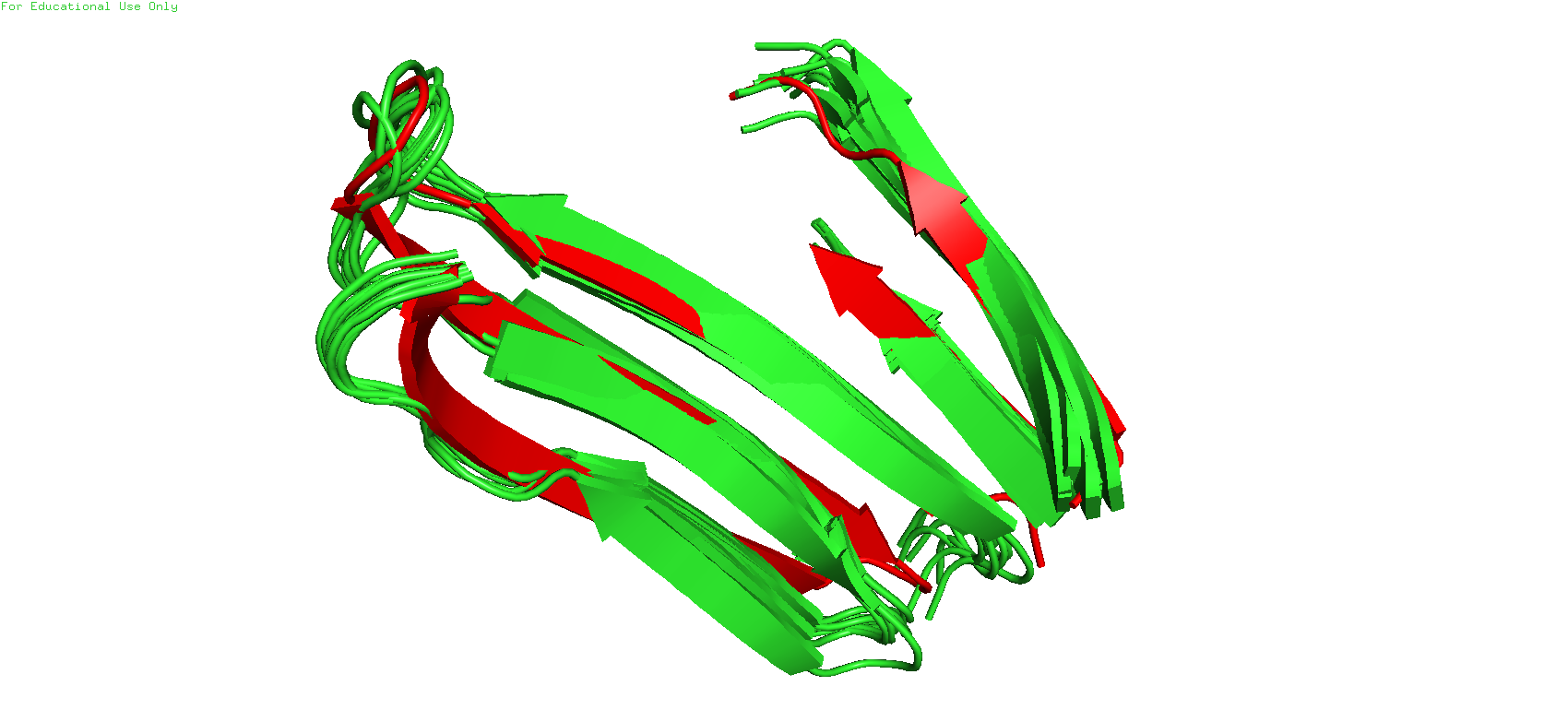
Рис.3. Бета-тяжи в двух моделях
Также при детальном рассмотрении можно заметить нестыковку в бета-листе. В двух моделях бета-тяжи не очень хорошо друг на друга накладываются, в отличие от тех же альфа-спиралей. Где-то в ЯМР-модели они длиннее, где-то - в РСА-модели. Это можно объяснить тем, что в при переходе от альфа-спирали к бета-листу и к петле происходит увеличение степеней свободы остатков, что в свою очередь затрудняет восстановление их точное положение по неполным данным ЯМР-эксперимента, при этом в кристалле такие участки стабилизированы хуже, что может приводить к "размазыванию" ЭП при её детекции.
Вдобавок стоит ещё отметить, что молекулы растворителя можно видеть лишь на РСА-модели, т.к. в ЯМР-эксперименте используется тяжёлая вода, которая не будет детектироваться.
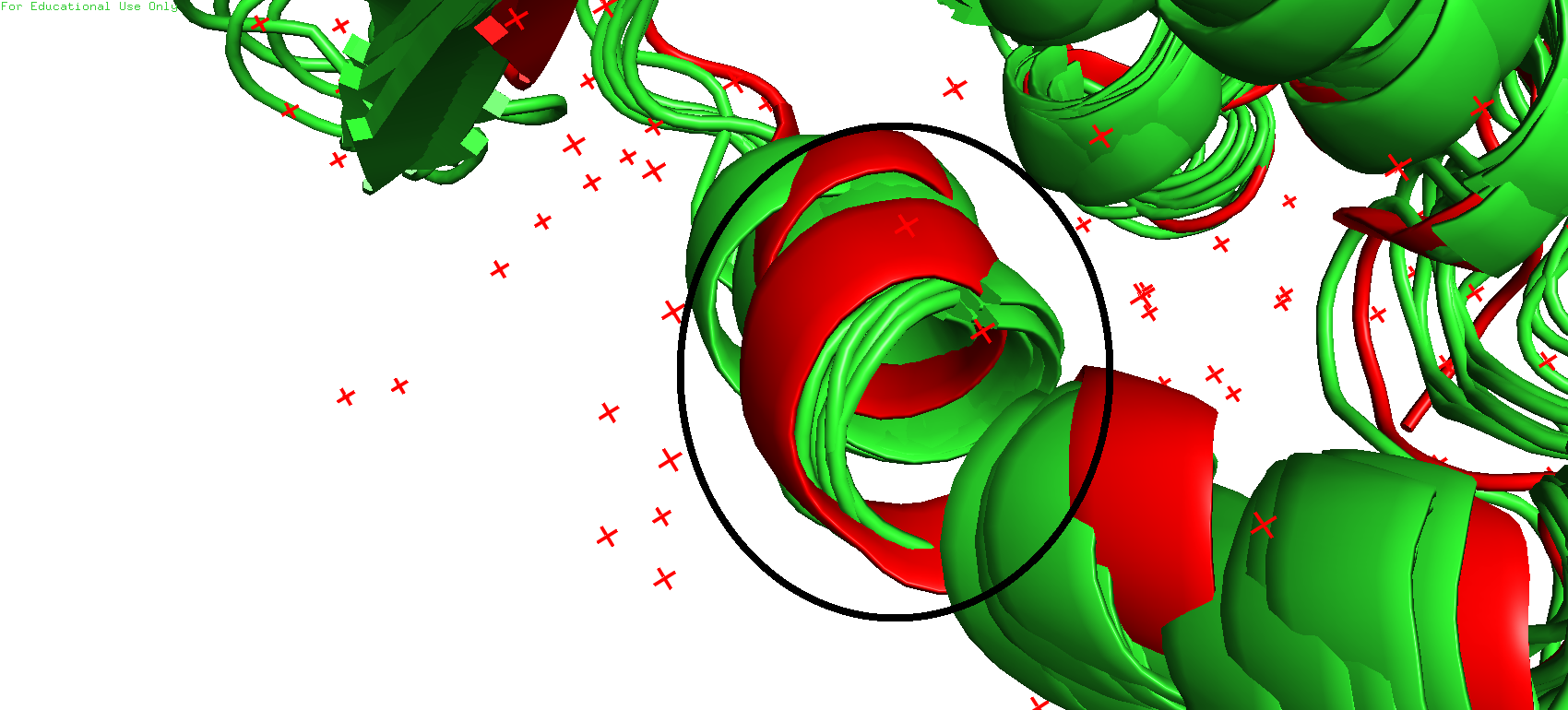
Рис.4. Странная альфа-спираль
Однако в одной альфа-спирали был замечен интересный момент. Видно, что спираль из РСА-модели (красная) полноценная и нигде не прерывается в середине. А спираль из ЯМР-модели имеет в своей середине неструктурированный участок. Тут могут быть разные варианты, например такое может произойти ввиду неполноты данных в ЯМР-эксперименте, или же наоборот, при моделировании РСА-структуры автор мог вписать спираль туда, где её нет. Вполне возможно, что здесь может быть две альфа-спирали, соединённые петлёй, что собственно и показал ЯМР, а в РСА всё интерпретировалось одной спиралью.

Рис.5. Странная альфа-спираль. РСА - слева, ЯМР - справа.
Если рассмотреть эту спираль отдельно для каждого метода, то можно заметить, что в случае РСА спираль получилась немного "гнутой", что смторится довольно подозрительно, в отличие от более удачной структуры, полученной с помощью ЯМР.
Теперь можно рассмотреть ещё более детально, на микроуровне, по отдельным остаткам. К примеру, рассмотрим участок бета-листа и сравним у двух моделей.
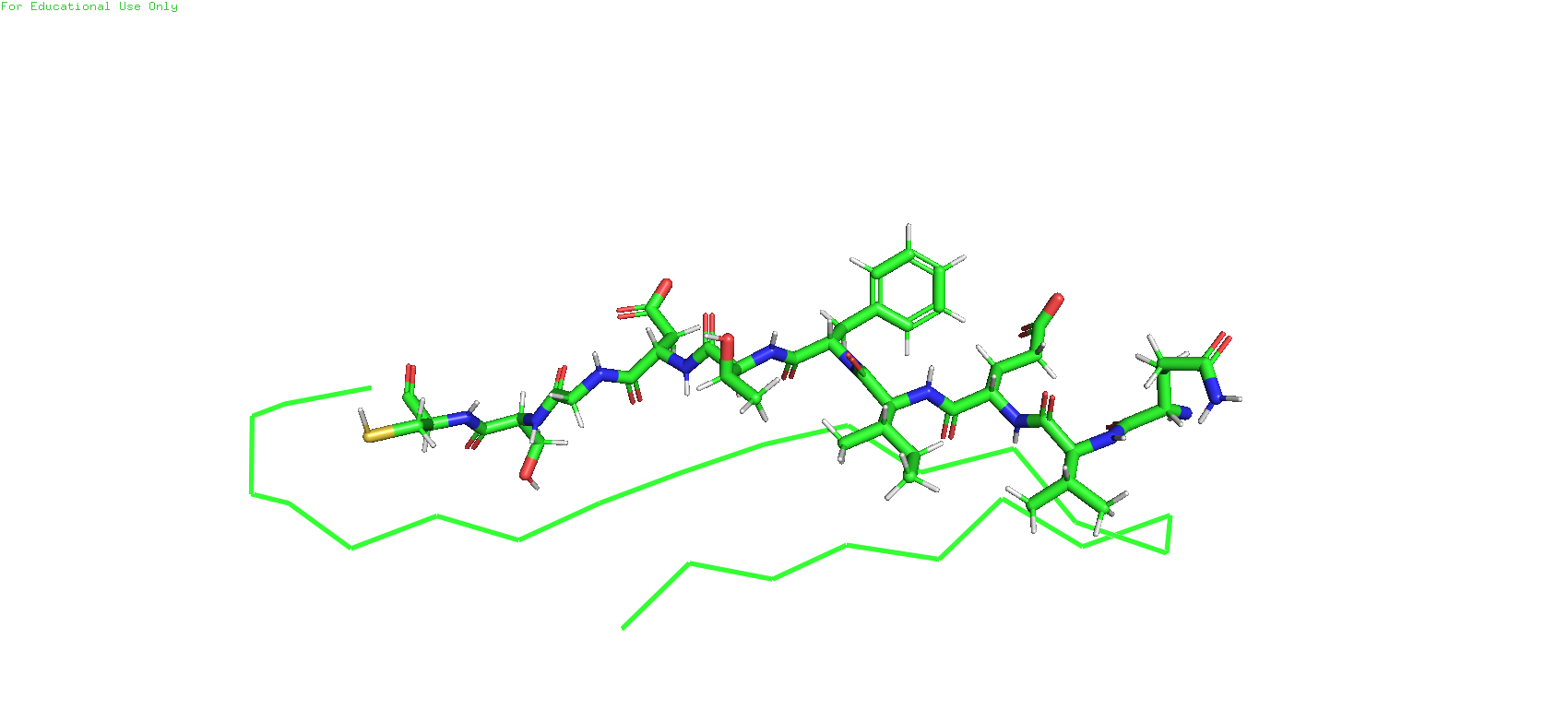
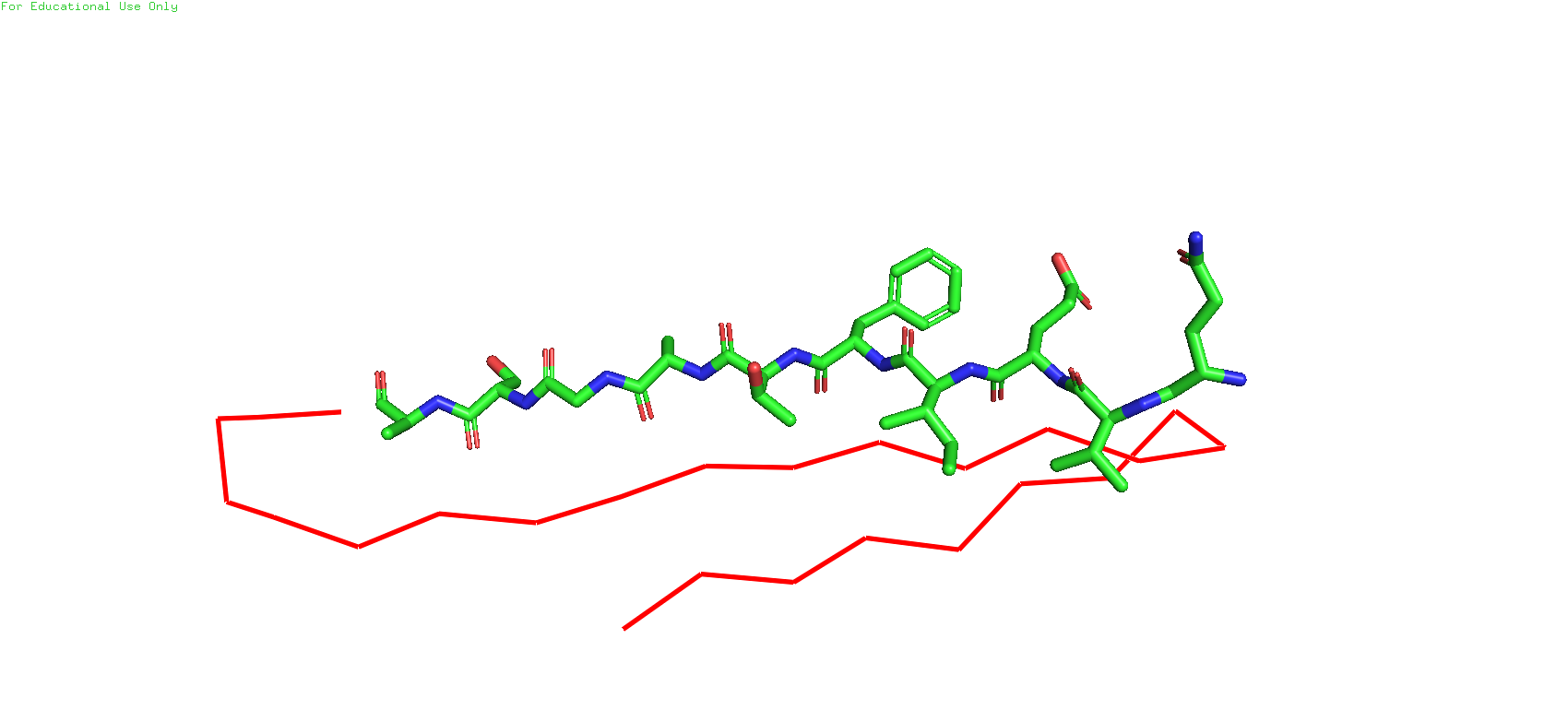
Рис.6. Участок бета-листа у структур, полученных с помошью ЯМР (слева) и РСА (справа)
Сразу же можно заметить, что в структуре, полученной с помощью ЯМР, есть атомы водорода, поскольку данный метод позволяет их различить, в отличие от РСА. И тут же, если посмотреть налево, то в глаза бросается ещё одно различие - атом серы.
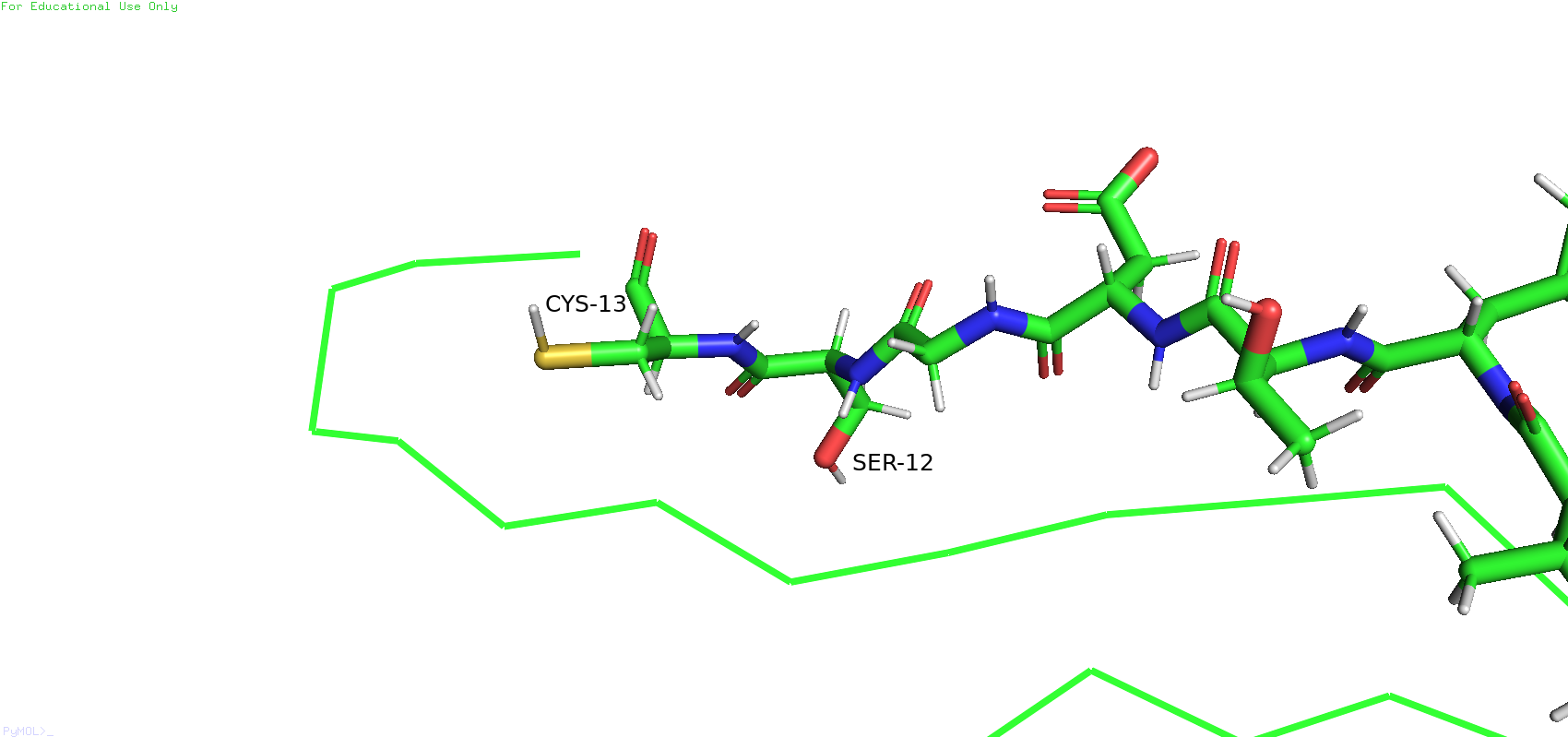
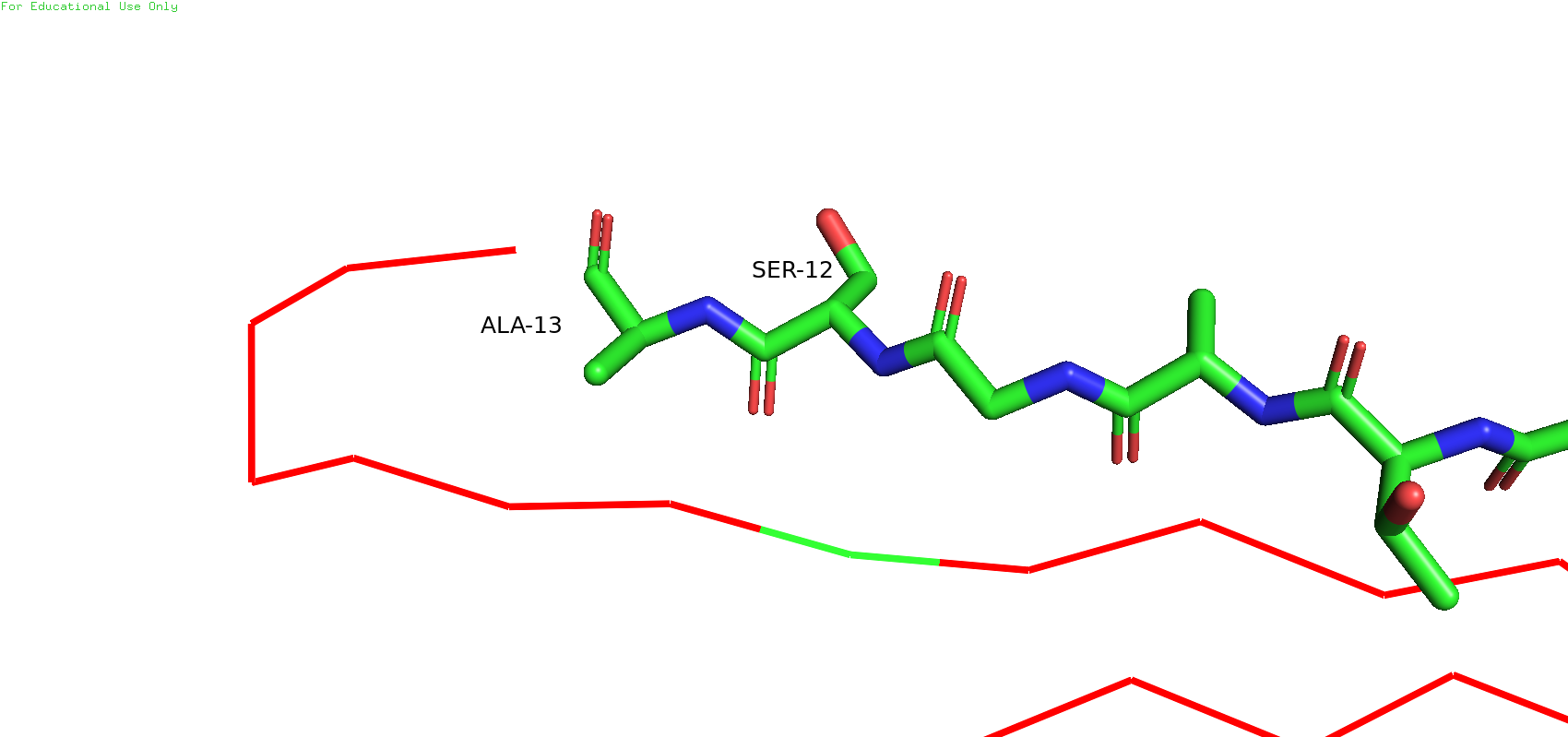
Рис.7. Остаток №13 в ЯМР-структуре (слева) и в РСА-структуре (справа)
Оказалось, что в ЯМР-структуре остаток №13 был определён как цистеин, а РСА-структуре - как аланин. Похожая история наблюдается с остатком №10. В ЯМР-структуре он был определён как аспарагиновая кислота, а в РСА-структуре - снова как аланин.
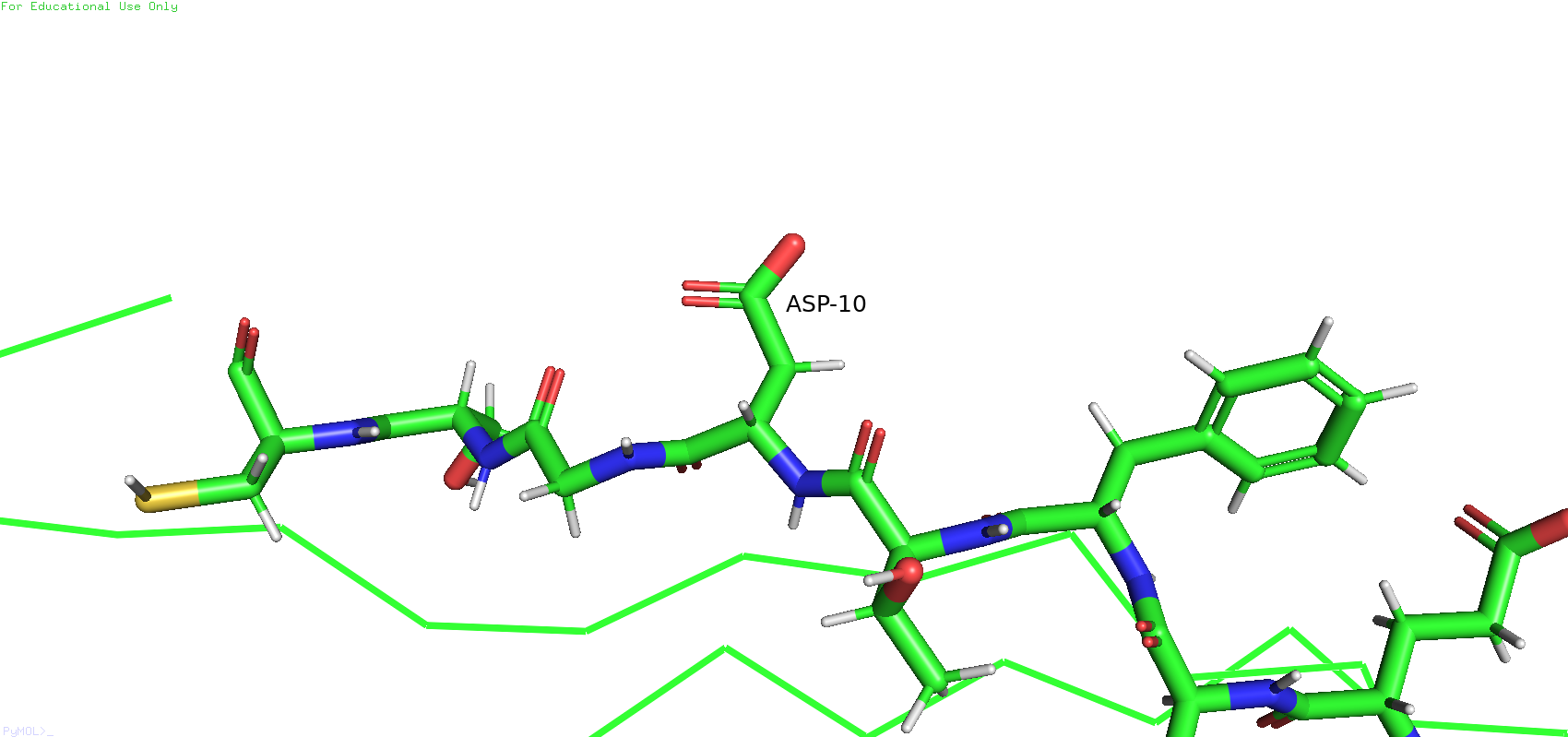
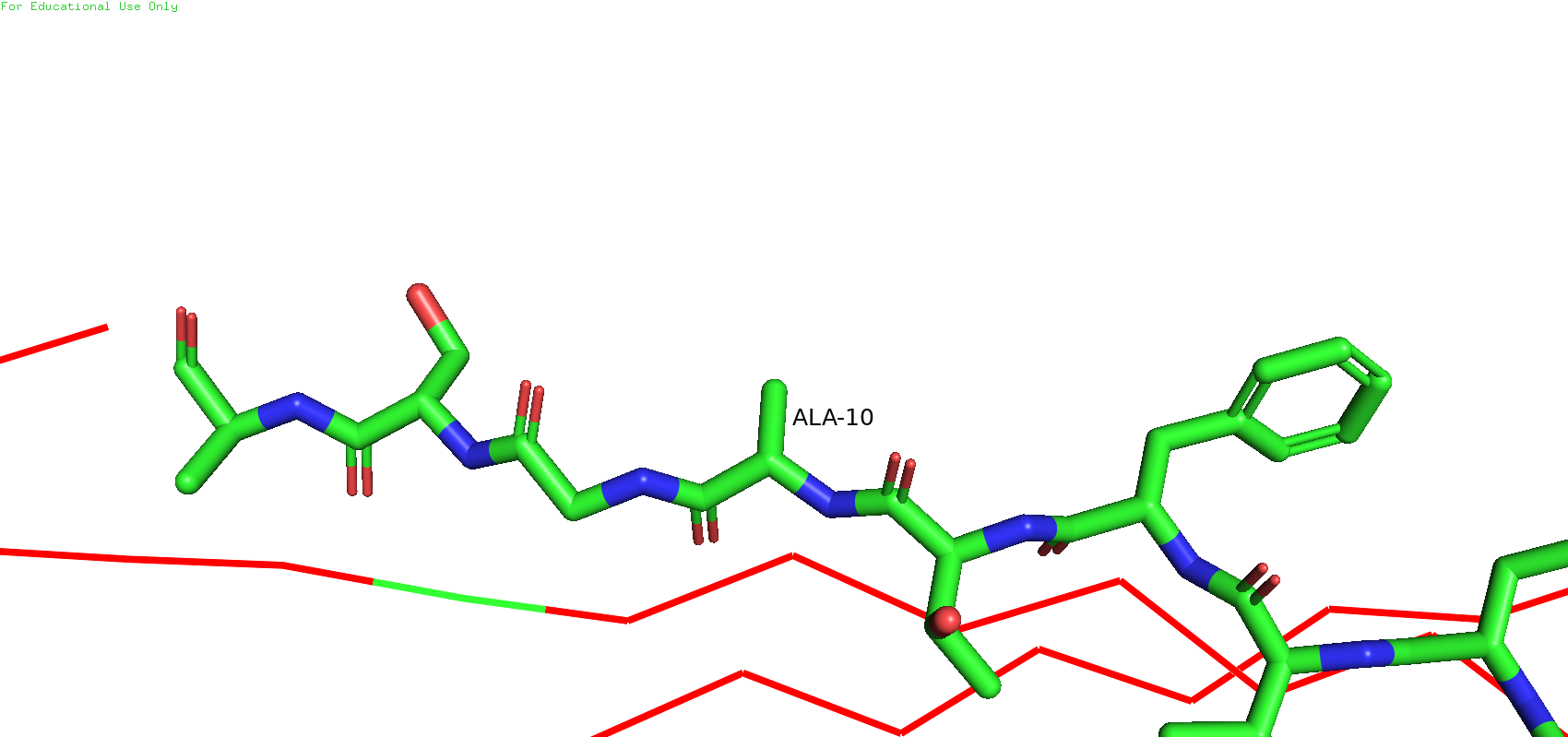
Рис.8. Остаток №10 в ЯМР-структуре (слева) и в РСА-структуре (справа)
Это можно объяснить тем, что для данных "исчезнувших" атомах в РСА-модели, возможно, не удалось установить электронную плотность, и поэтому аминокислоты, содержащие эти атомы в ЯМР-модели, в РСА-модели определились как другие.
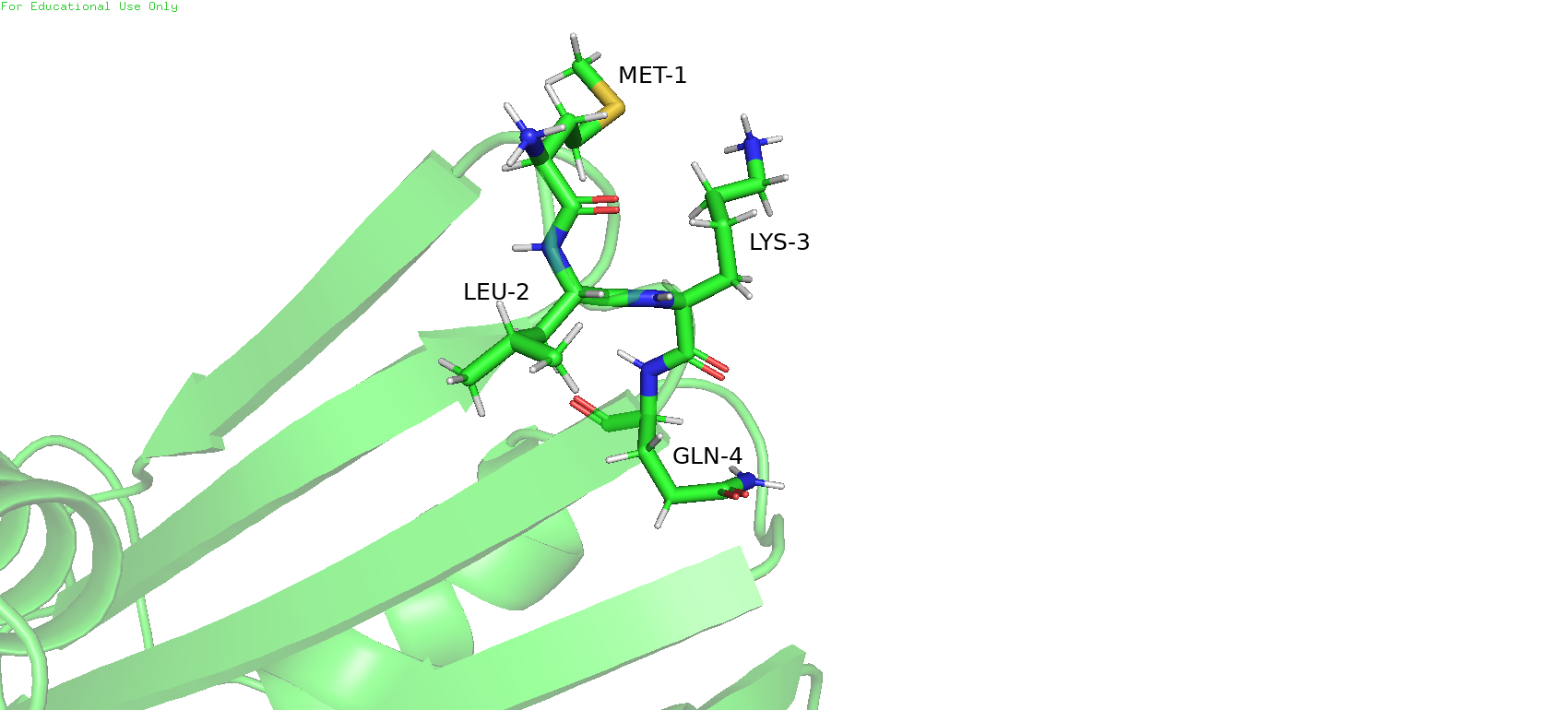
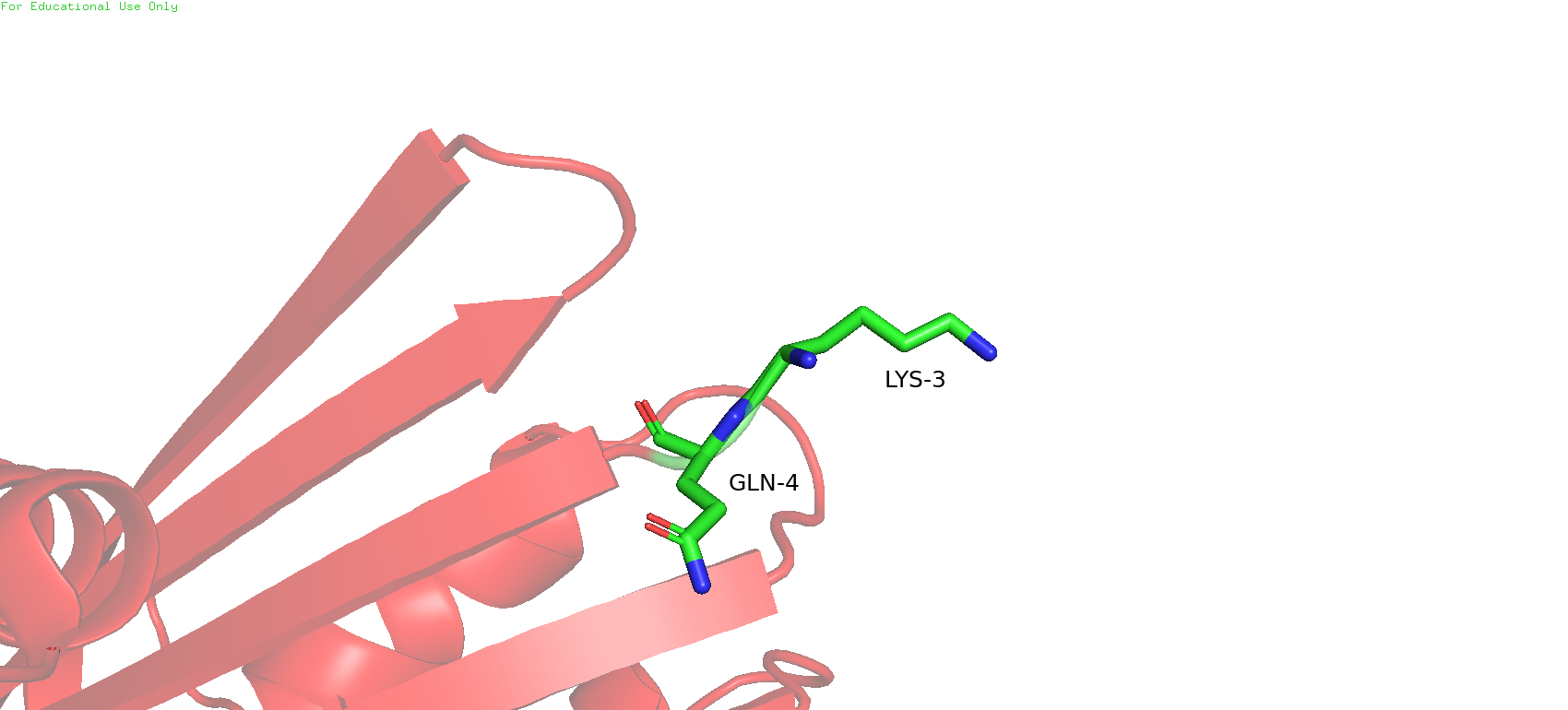
Рис.9. Подозрительная петля: в ЯМР-структуре (слева) и в РСА-структуре (справа)
На общем виде с налодением двух структур друг на друга ещё можно было заметить, что одна из краевх петель в ЯМР-модели длиннее, чем в РСА-модели. И действительно, елси рассмотреть ближе, в ЯМР-структуре эта петля состоит из MET1, Leu2, LYS3 и GLN4, при этом в РСА-модели, видимо, не удалось отобразить метионин и лейцин, и только лизин с глутамином совпадают с ЯМР-моделью. Видимо, для этих аминокислот не удалось обнаружить ЭП, или даже если она была обнаружена, то не удалось адекватно вписать в неё остатки.
Теперь снова вернёмся к бета-листу. Можно было заметить, что рядом с цистеином 13 есть серин 12, который в ЯМР-модели смотрит в одну сторону, а в РСА - в другую.
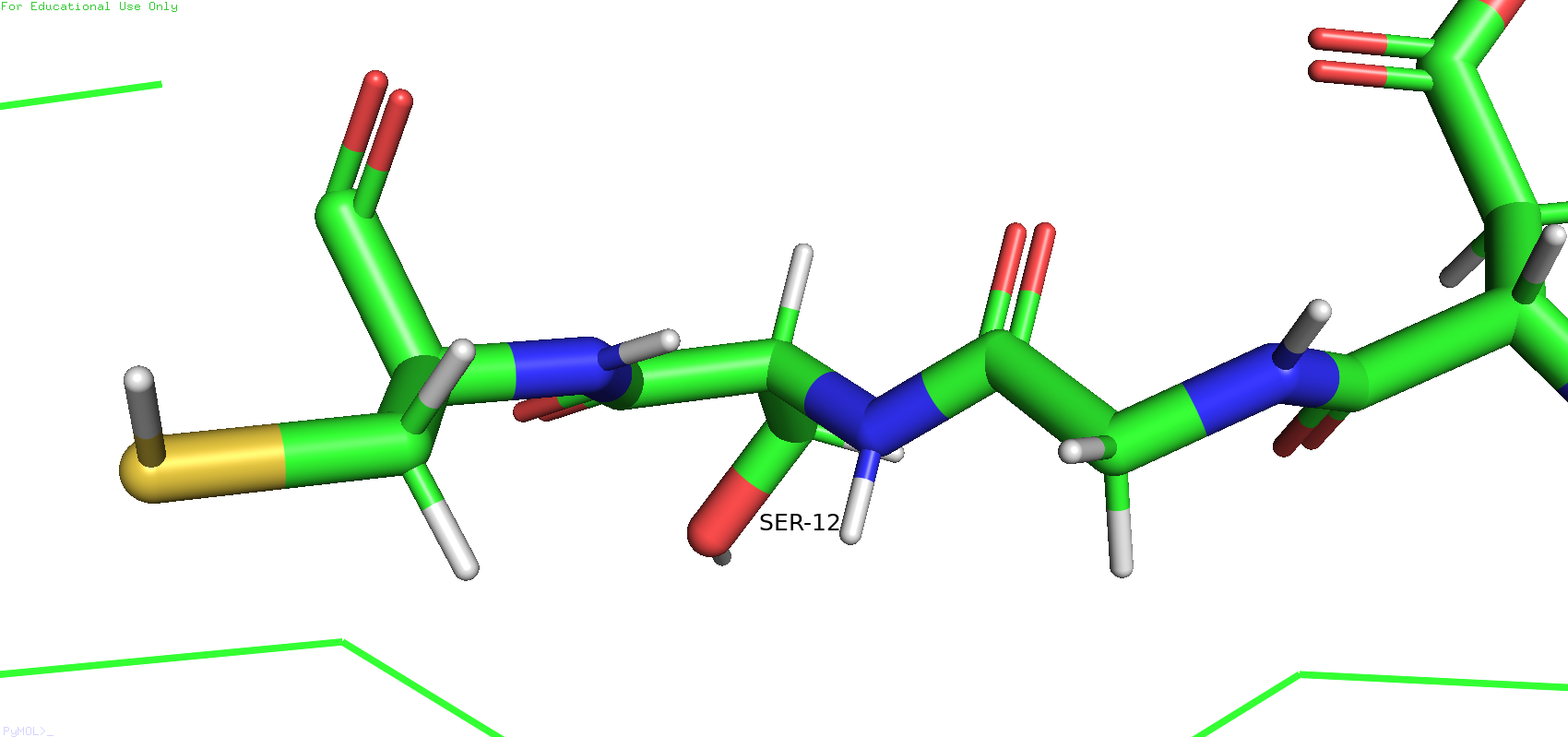
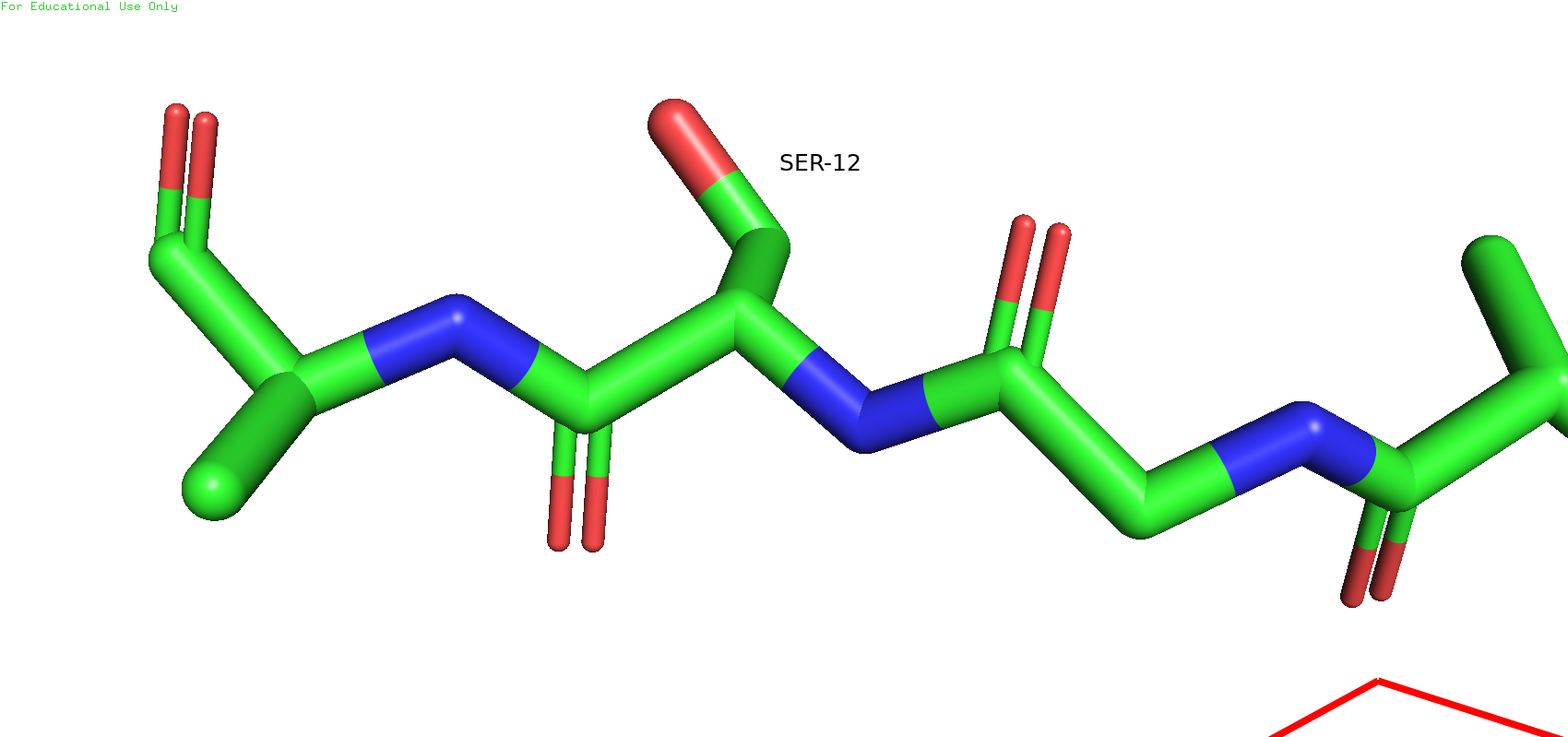
Рис.10. Разное полодение остатка серина 12 в ЯМР-модели (слева) и в РСА-модели (справа)
Такое различие в положении вполне может быть связано с неточностью в восстановлении углов в ЯМР. Сторонних взаимодействий с какими-либо остатками рабикалов лругих цепей не было оьнаружено ни в том, ни в другом случае. При этом ещё также стоит отметить, что углы связей в остове у ЯМР-модели выглядят довольно странными (Рис.11)
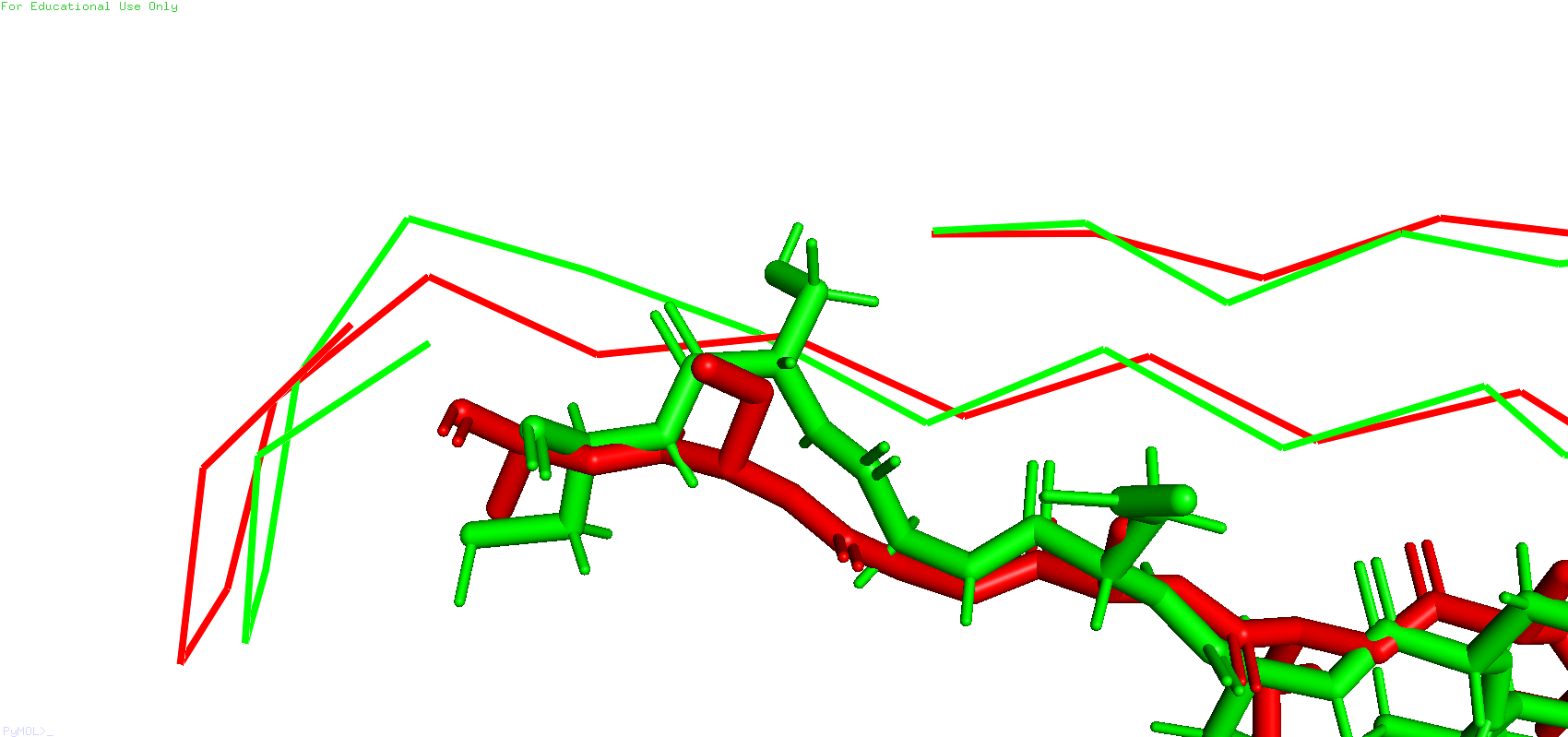
Рис.11. Углы связи в ЯМР-модели (зелёный) и РСА-модели (красный)
В данном задании нужно было оценить в-фактор остатков в зависимости от их подвижности, которая выражается в RMSF. То есть нужно посчитать В-факторы для РСА модели и построить их зависимость от RMSF, посчитанных для ЯЯМР-модели.
Для начала нужно было убрать те остатки, которые не совпадают одновременно у двух моделей, чтобы значения в двух массивах попрано соотвтествовали одному и тому же остатку. В итоге после некоторых манипуляций был получен следующий график:
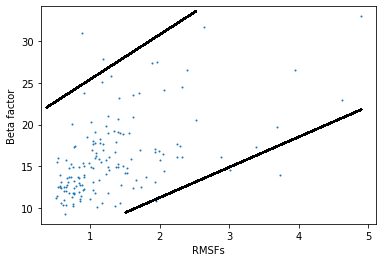
Рис.12. График зависимости В-фактора от RMSF
На графике можно наблюдать некоторый тренд; видно, что в областях с большим RMSF B-фактор также большой, однако большой В-фактор также можно встретить у остатков с низким значением RMSF. При этом также есть много остатков, у которых В-фактор средний при низком RMSF, а также остатки с низким значением В-фактора при значениях RMSF выше среднего. Поэтому в данном случае В-фактор скорее всего будет говорить о качестве электронной плотности, нежели о большой подвижности остатков.
В данном задании для анализа нужно было выбрать 3 водородные связи: одну в ядре белка между атомами остова, одну между боковыми цепями в ядре белка и одну в петлях, выходящих на поверхность глобулы.
В качестве первого экземпляра была выбрана водородная связь в альфа-спирали между остовами лейцина 49 и изолейцина 53. В данном случае (в РСА-модели) азот хорошо смотрит на кислород и длина связи вполне удовлетворительная. В ЯМР-модели можно заметить, что атом водорода на азоте остова изолейцина 53 не совсем прямо смотрит на кислород лейцина 49, немного отклонён, но как мне кажется в таком варианте всё равно возможно образование водородной связи, угол отклонения не сильно критичный. Причём такая тенденция сохраняется для всех состояний в ЯМР-модели.
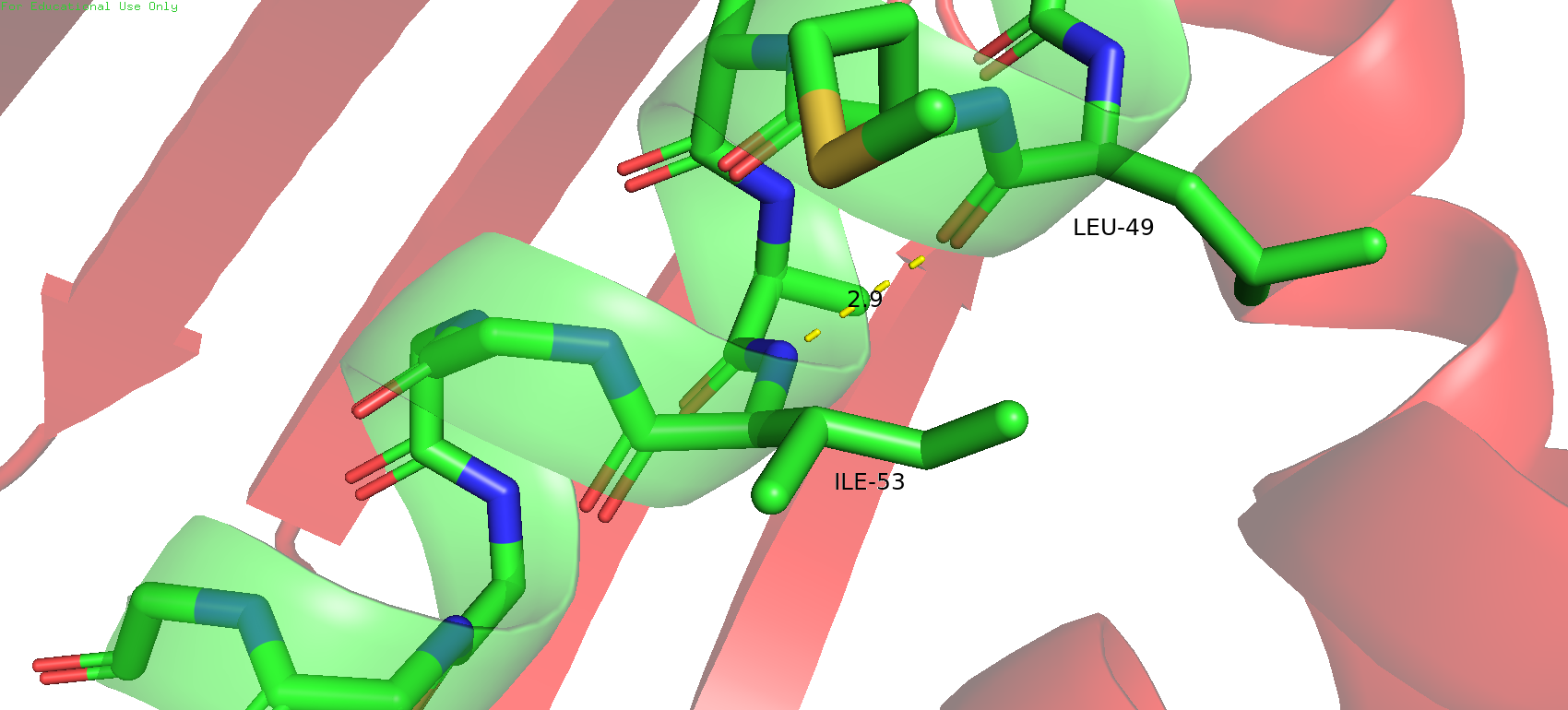
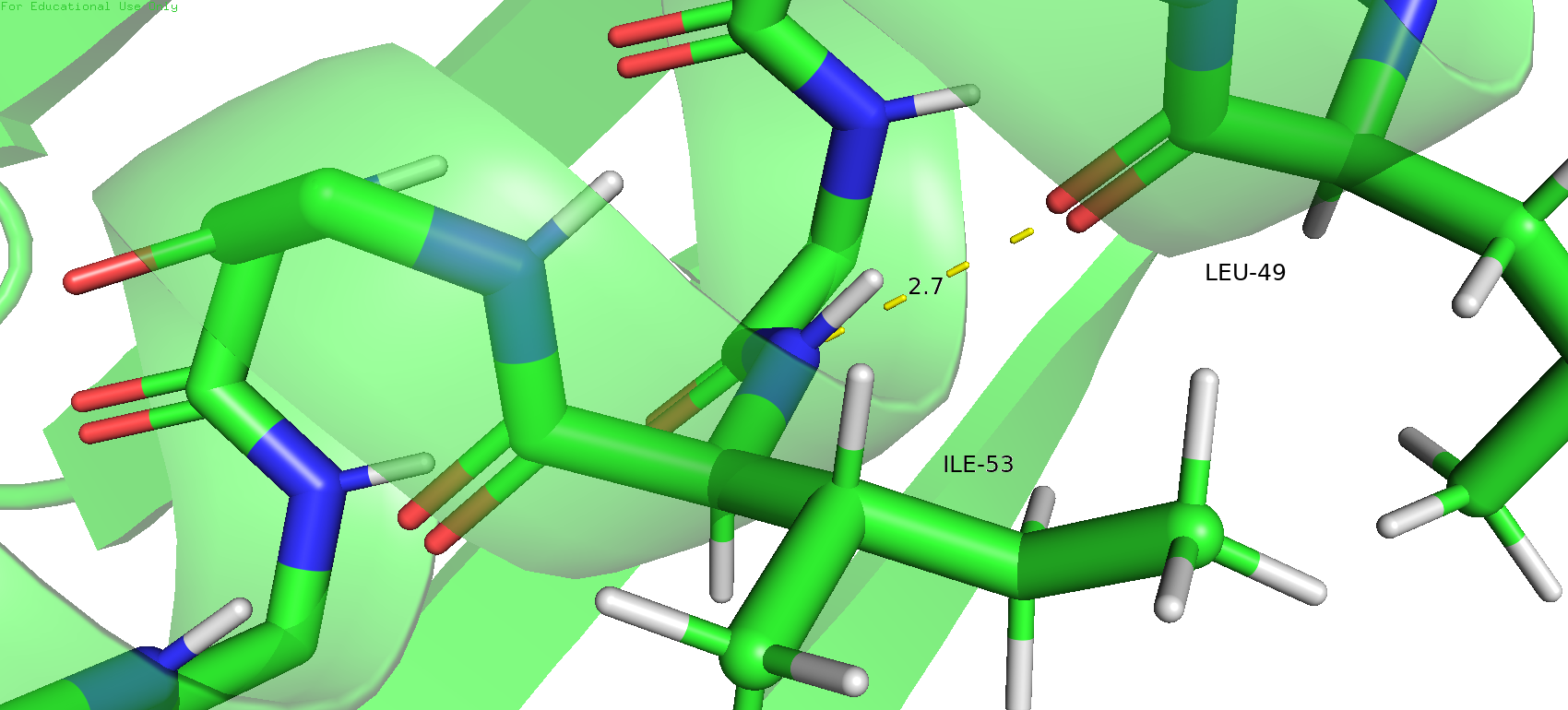
Рис.13. Водородная связь между кислородом лейцина 49 и водородом излейцина 53 в остове в РСА-модели (слева) и в ЯМР-модели (справа)
Следующая связь была выбрана не совсем в ядре белка, а немного ближе к окраине, поскольку почти всё ядро состоит из гидрофобных остатков, и там нечему образовывать водородные связи. Была выбрана водородная связь между аргинином 27 и глутаматом 129, между альфа-спиралью и бета-слоем. В данный модели эта связь вполне может существовать, длина и угол подходящие. Однако если проверить эти же остатки в ЯМР-модели, то тут не всё так гладго. Мало того что длина связи слишком большая, так ещё и ни один из водородов азота аргинина не смотрит на кислород глутамата. И такая тенденция наблюдается во всех ЯМР-состояниях этой структуры.
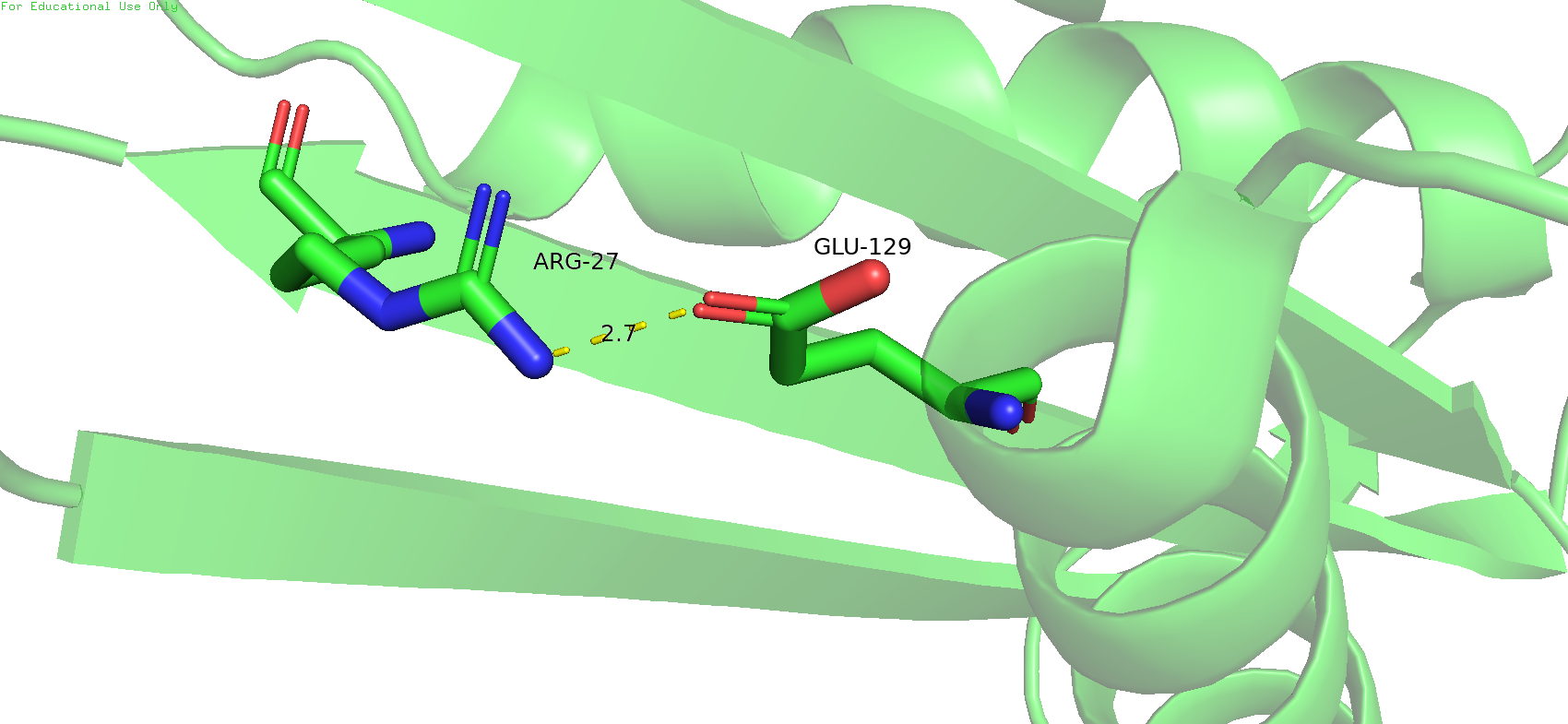
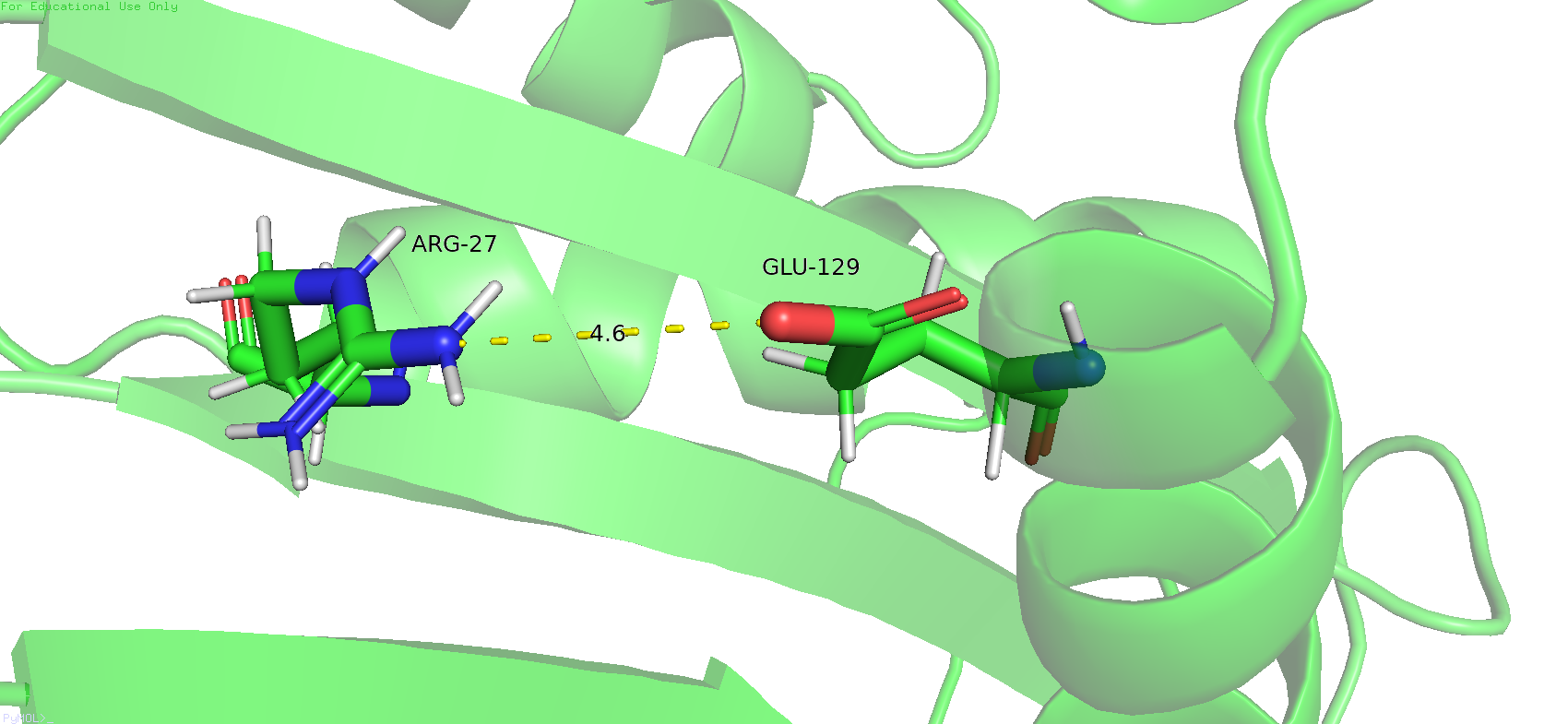
Рис.14. Водородная связь между остатками аргинина 27 и глутамата 129 в РСА-модели (слева) и её предполагаемое место в ЯМР-модели (справа), где она по всей видимости отсутствует
Следующая связь была выбрана в петле на поверхности белка. Была выбрана связь между треонином 92 и лизином 96, между атомами остова. В данном случае конформация вполне подходит для формирования водородной связи, длина удовлетвориельнаяЮ угол тоже. В случае же ЯМР-модели длина связи сохраняется примелимой, но кислород смотрит на водород не совсем прямо. В данном случае я всё же склоняюсь к тому, что в таком состоянии водородная связь может и возможна, но с некоторой натяжечкой.
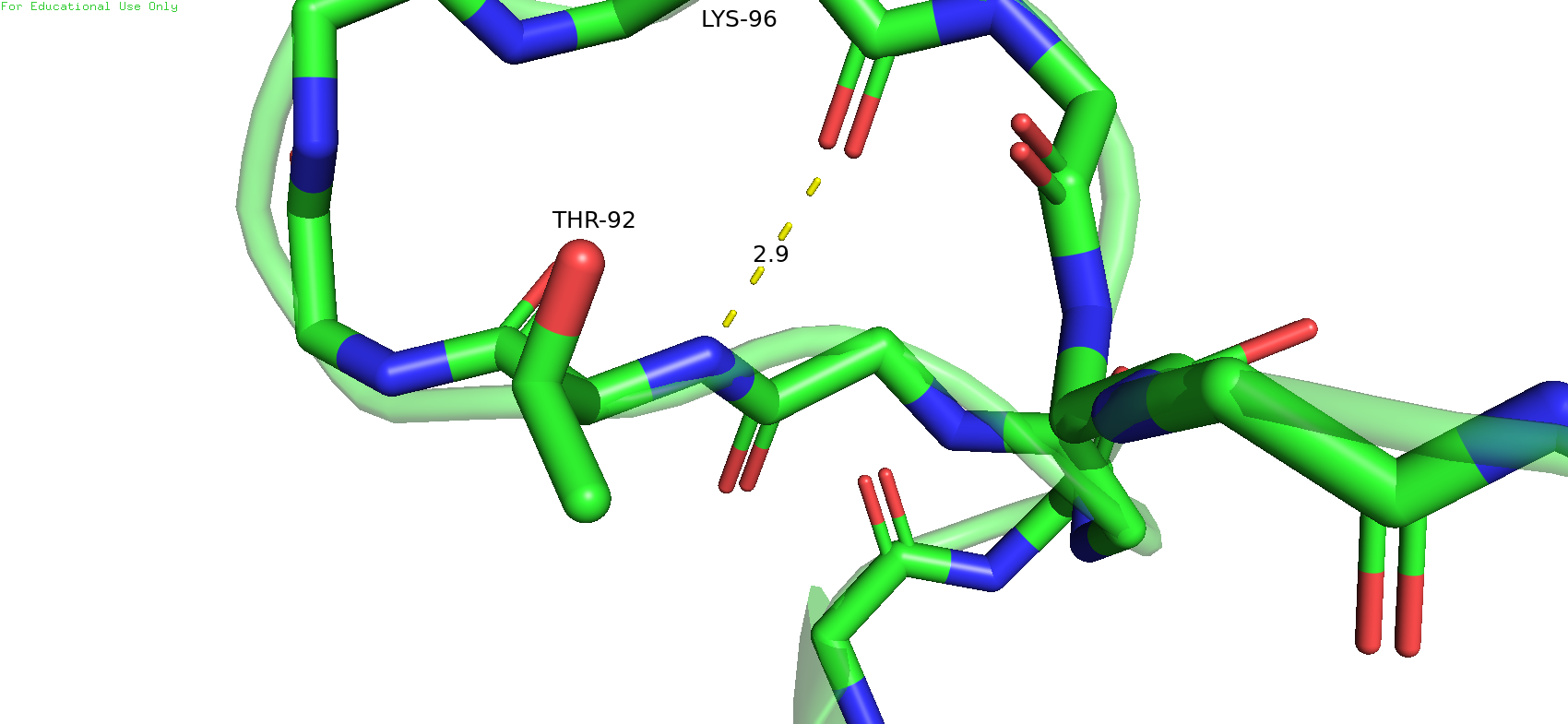
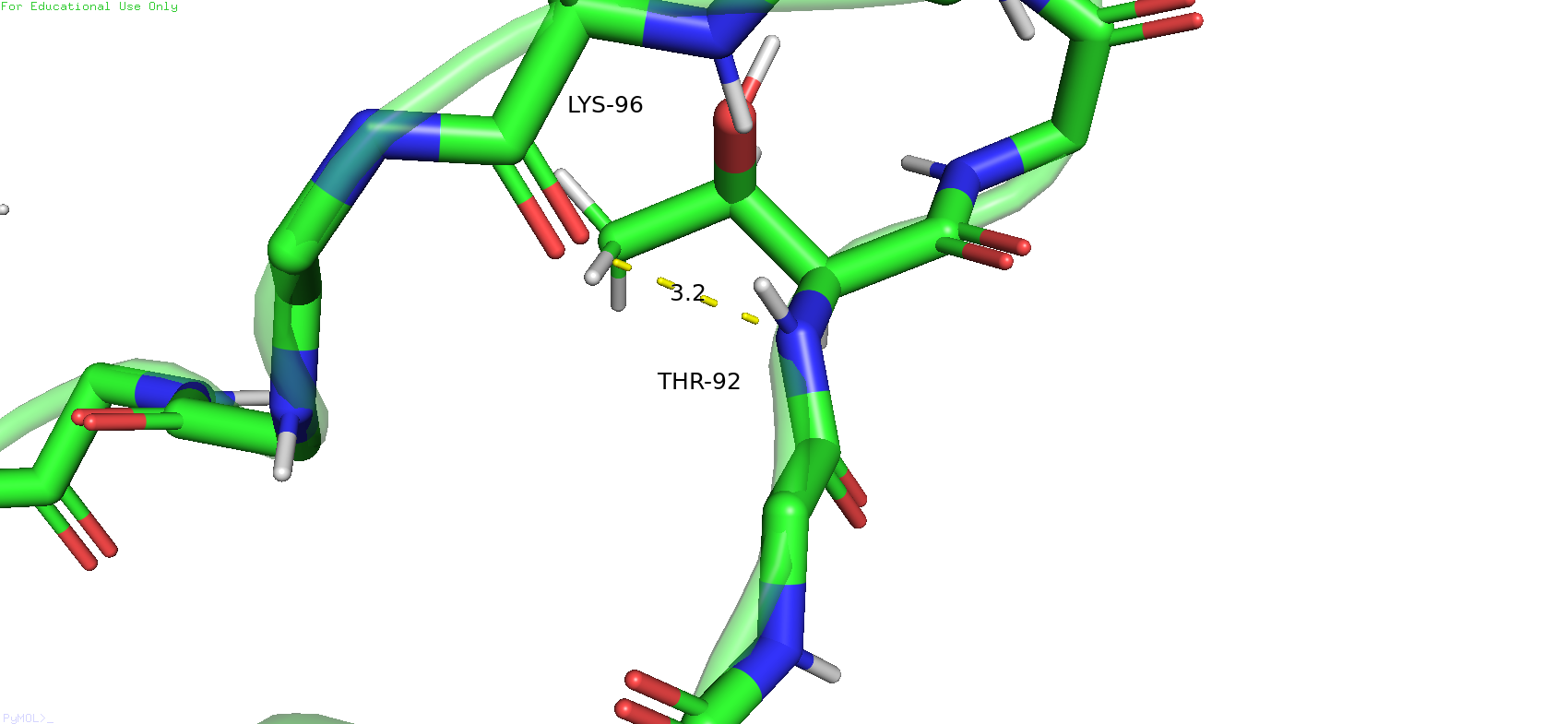
Рис.15. Водородная связь между треонином 92 и лизином 96 в петле на поверхности белка в РСА-модели (слева) и в ЯМР-модели (справа).
Практически во всех состояниях ЯМР-модели наблюдается одинаковая картина, где водородные связи ещё более-менее можно вписать. Однако имеются варианты, где водород на азоте смотрит совершенно в другую сторону, или же длина связи выходит за рамки таковой у водородной. В таком случае вариант образования такой связи исключён.
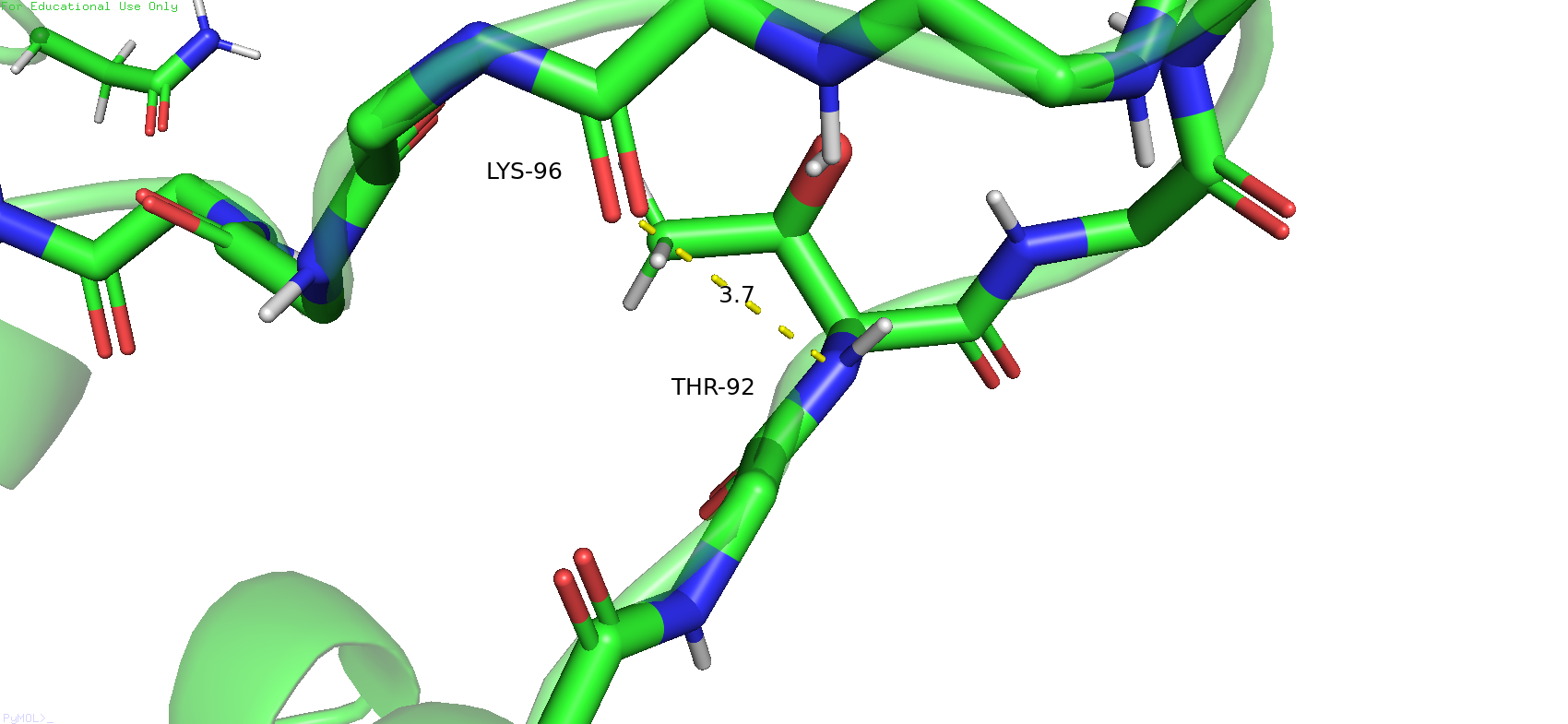
Рис.16. Вариант скорее невозможной водородной связи в одном из состояний ЯМР-структуры.
Итоговая таблица:
Номер связи |
Расстояние в РСА |
Процент присутствия в ЯМР |
Минимальное расстояние в ЯМР, А |
Медианное расстояние в ЯМР, А |
Максимальное расстояние в ЯМР, А |
| 1 | 2.9 | 100 % | 2.6 | 2.7 | 3.1 |
| 2 | 2.7 | 0 % | 4.6 | 7.5 | 10.7 |
| 3 | 2.9 | 62.5 % | 3.1 | 3.25 | 3.9 |
В первом случае картина мне кажется вполне закономерной. Альфа-спираль довольно жетская и регулярная структура, к тому же модели при сравнении совпадали с таковыми у РСА, поэтому и на ЯМР в норме должны отображаться те же закономерности, включая связи, что собственно и можно видеть в данном примере.
Во втором же случае есть сомнения доверять тому, что РСА показал наличие водородной связи в данном месте. Во всех ЯМР-структурах не было ни одного значения длины связи, которое удовлетворяло бы требованию, к тому же расположение водородов никак этому не способствует. Возможно, такое положение в РСА-структуре могло получиться в результате кристаллизации, или же по ошибке автора.
В третьем случае момент немного спорный. Это участок петли на внешней стороне белка, которые вполне может являться довольно подвижным. РСА-модель показывает вполне хорошую вероятность наличия в данном месте водородной связи. В некоторых ЯМР-струтурах также возможно наличие водородной связи, хоть и с некоторым подозрением, с некоторым натягом, но всё же мне кажется возможно. Но при этом процент вероятного присутствия данной связи среди состояний ЯМР-моделей довольно высок, отсутствие же связи в некоторых состояниях можно объяснить как раз таки выскокой подвижностью данного участка белка.
© Иззи Антон,2020