Описание структуры 5DRB
Структура в целом
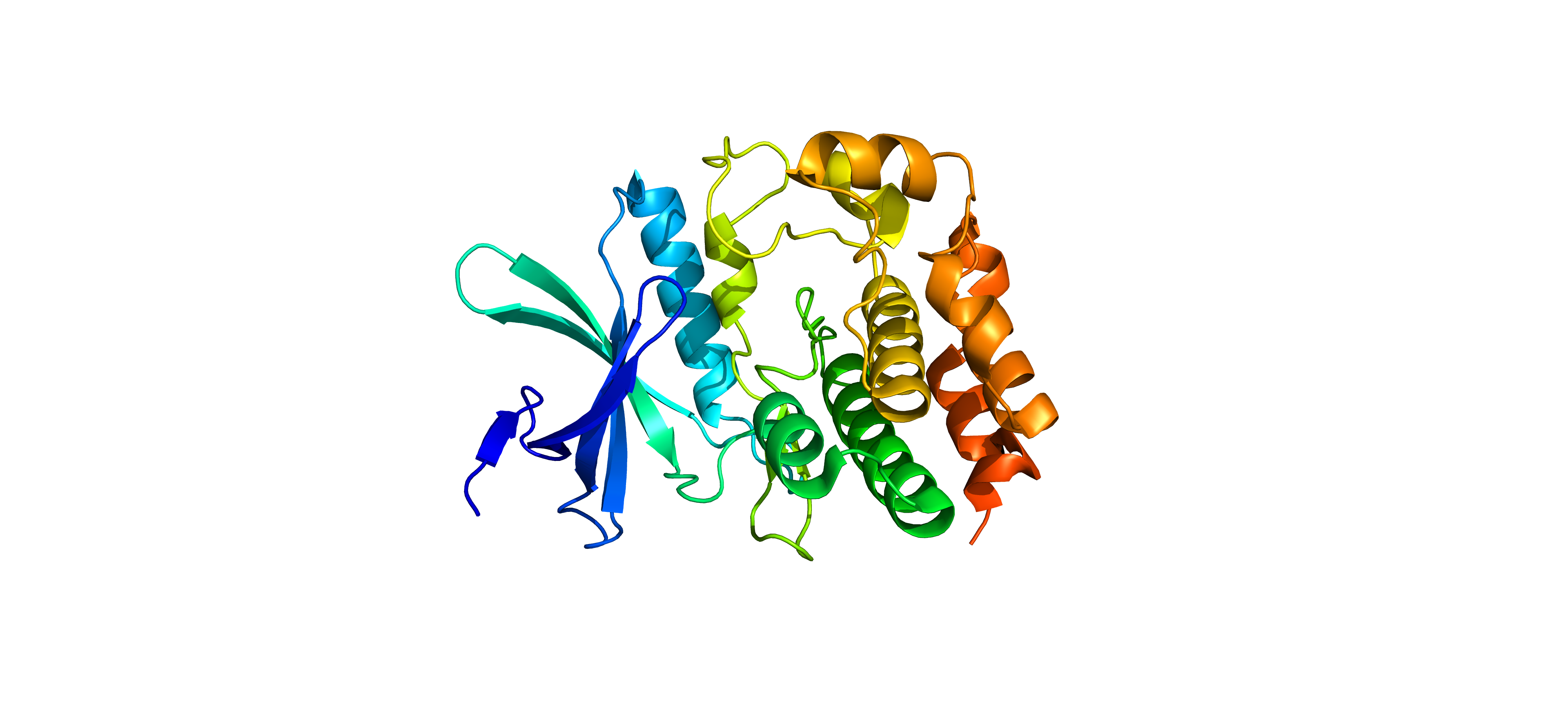
Макромолекула является белком. Это белок WNK1 – серин-треониновая протеинкиназа, относящаяся к семейству WNK (киназы без лизина), он представлен одной длинной полипептидной цепью единственного типа. Конкретно данная для анализа структура 5DRB из PDB представляет собой фрагмент этой цепи в комплексе с ингибитором этого белка. Ниже показан общий вид хода остова этого фрагмента (Рис. 1). Биологическая единица не отличается от асимметрической.
Описание цепи и фрагмента
Единственная цепь и соответственно вся макромолекула относятся к Rattus norvegicus (серая крыса). Uniprot_id и название этой цепи: Q9JIH7 и WNK1_RAT. Данный белок является основным компонентом киназного каскада WNK1-SPAK/OSR1, благодаря которому происходит регуляция кровяного давления и осмотического баланса, эта киназа активирует другие киназы, которые в свою очередь влияют на работу контранспортеров, способствуя притоку ионов в клетку и препятсвуя их оттоку. Помимо этого у белка имеется ряд и других функций, например, регуляция экспорта мРНК в ядро.
Фрагмент этой цепи (представленный в записи) является киназным доменом, который как раз и ответственен за фосфорилирование других белков (протеинкиназная активность). В данной структуре имеется одна мутация: Ser-382 (если вести нумерацию по всей цепи) заменен на Ala. В составе фрагмента есть модифицированные остатки: фосфорилированные Ser-378 и Ser-382 (однако в этой записи 382 остаток из-за мутации не модифицирован). В составе домена четко видны α-спирали и β-листы (Рис. 2).

Малые молекулы
В записи присутствуют два типа малых молекул: это вода (краткое наименование HOH) и лиганд, являющийся ингибитором (краткое наименование 5FJ, полное – N-tert-butyl-1-(1-{5-[5-(trifluoromethyl)-1,3,4-oxadiazol-2-yl]pyridin-2-yl}piperidin-4-yl)-1H-imidazole-5-carboxamide). Справа представлено белковое окружение лиганда 5FJ (Рис. 3). Видно, что преимущественно с лигандом взаимодействуют гидрофобные аминокислотные остатки (лейцины, валины, аланины и фенилаланины).
Ссылки на PDB-файлы с координатами для малых молекул:
НОН 5FJ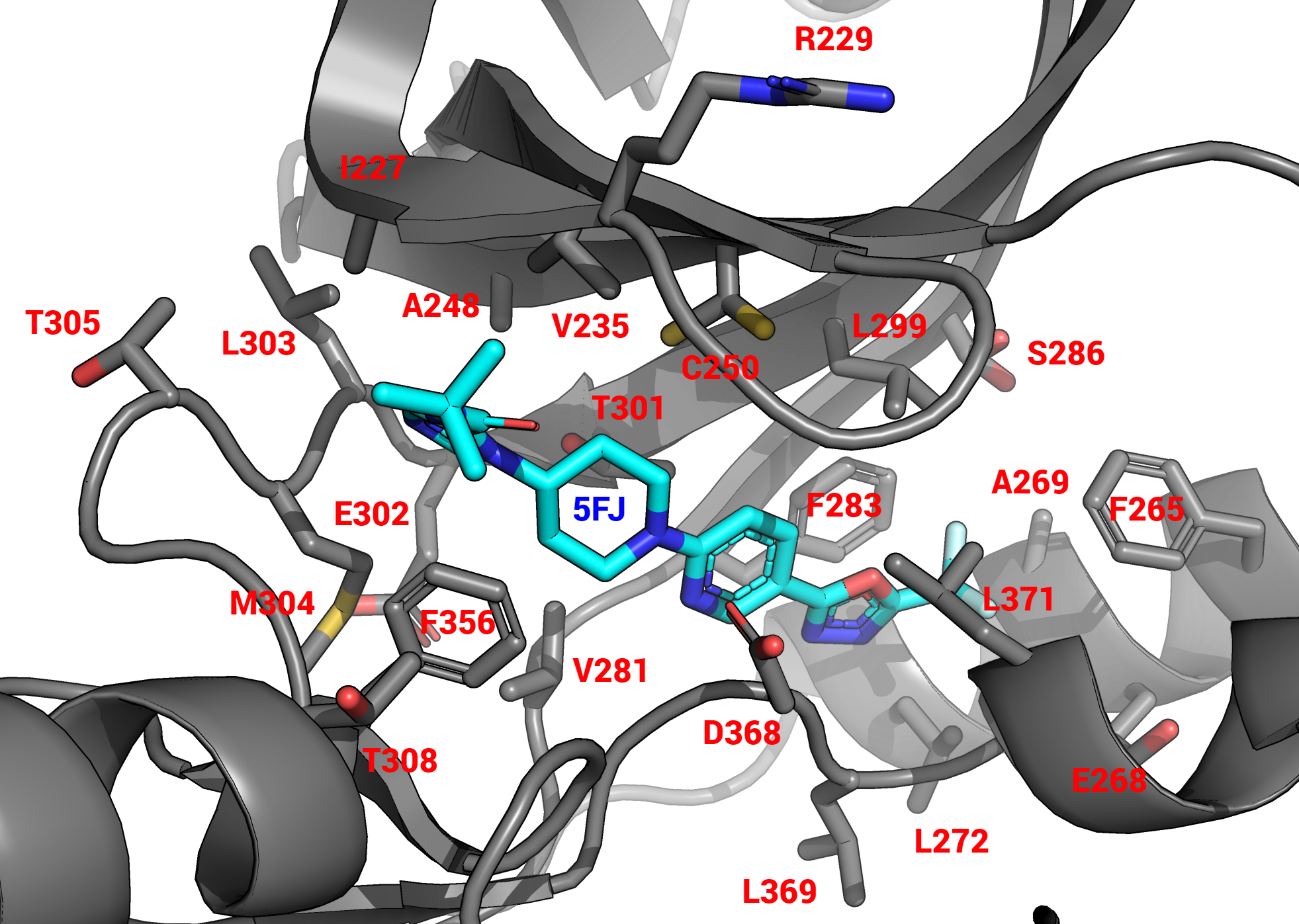
Взаимодействия между аминокислотными остатками
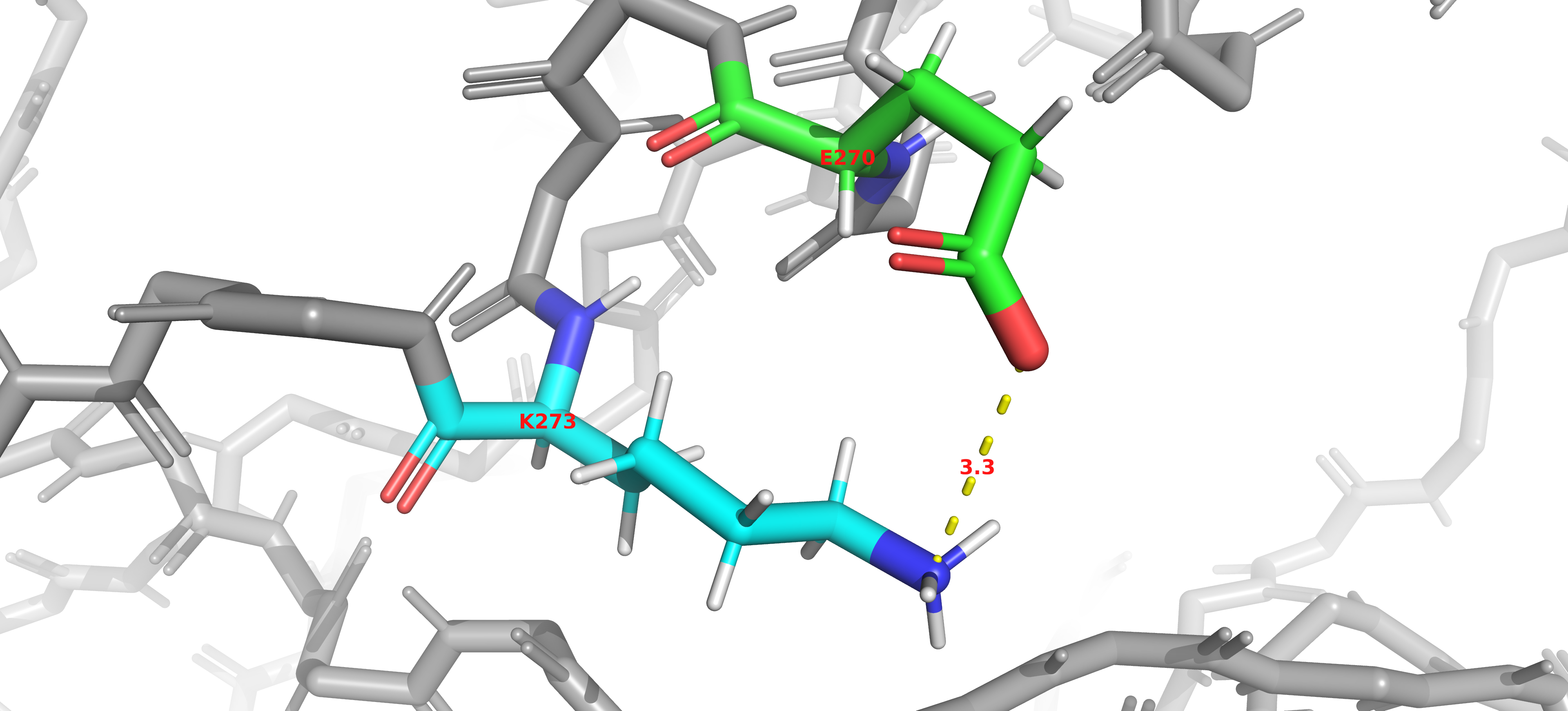
Ниже представлены примеры взаимодействий между аминокислотными остатками, найденные в анализируемой структуре. Присутствуют водородные связи между остатками остова (Рис. 4) (показано на примере β-листа) и между боковыми радикалами (Рис. 5). Были обнаружены солевые мостики (Рис. 6) и π-стэкинговые взаимодействия (Рис. 7). Дисульфидных связей в составе структуры нет (Рис. 8).



Ферментативная активность
Как уже было написано выше, данный фрагмент – домен, обладающий протеинкиназной активностью. Код фермента EC: 2.7.11.1. Благодаря этому домену белок способен фосфорилировать другие белки по Ser и Thr, ниже написаны эти реакции:
В состав каталитического центра входит только один (по этой причине нет взаимодействия с другими остатками активного центра) аминокислотный остаток – Asp-368 (Рис. 9). Остаток каталитического центра взаимодейтвует с Lys-233 по типу солевого мостика и с Asn-354 по типу водородной связи из остатков ближайшего окружения (Рис. 10).

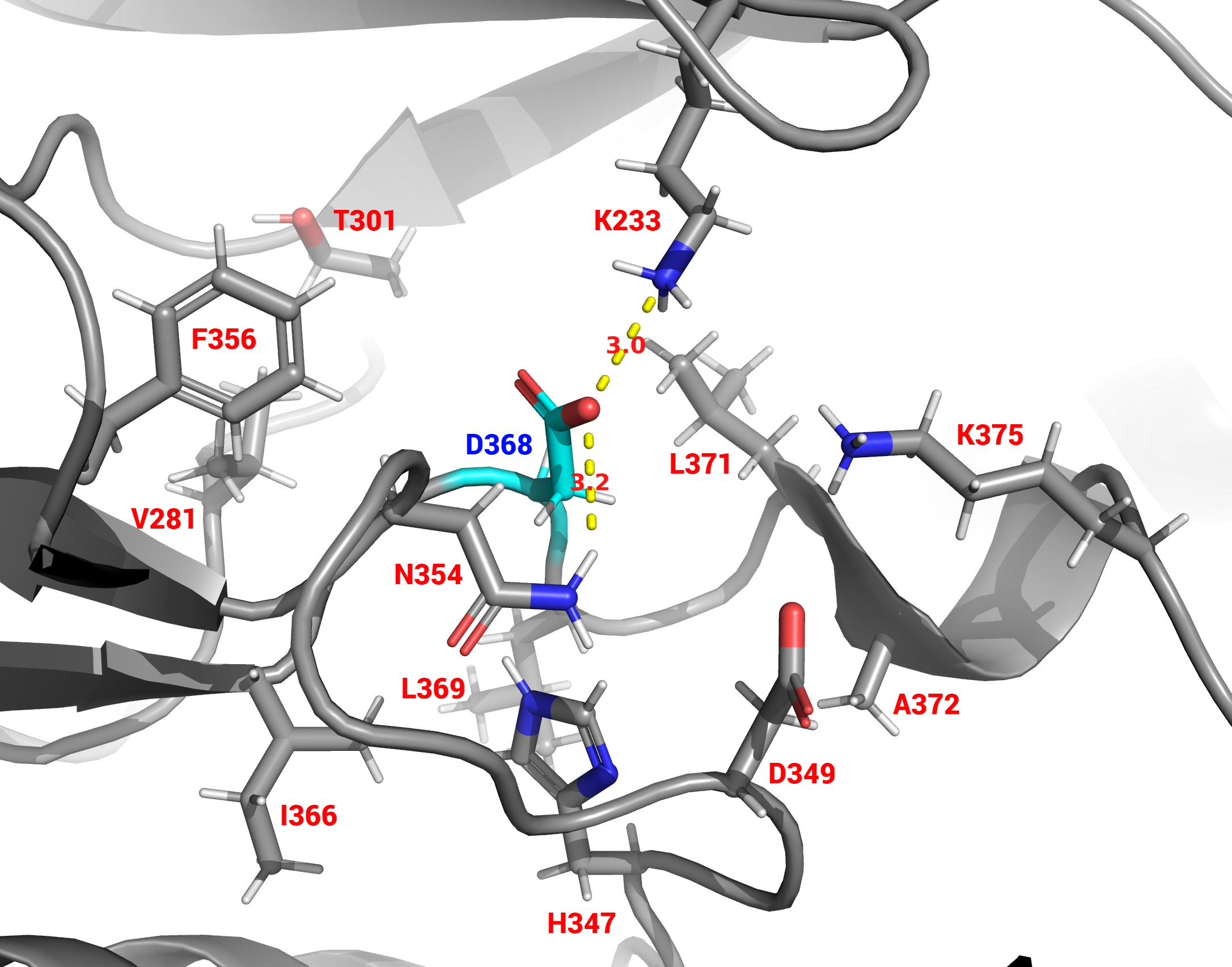
Лиганд 5FJ располагается на очень близком расстоянии от активного центра (Рис. 11), своими двумя кольцами (пиперидином и пиридином) он экранирует свободный кислород аспарата из каталитического центра (другой кислород образует связи с окружением активного центра, смотри предыдущий абзац), тем самым он действует как конкурентный ингибитор, захватывая пространство вокруг активного центра и блокируя для субстрата доступ к нему.

Источники
- 5DRB – ссылка на запись в PDB.
- Q9JIH7/WNK1_RAT – ссылка на статью о WNK1 в базе данных Uniprot.
- EC: 2.7.11.1 – ссылка на описание фермента в базе EXPAZY.