Практикум 2
Задание 1
В данном задании я анализировал разные расшифровки структуры одного и того же белка, отличающиеся по разрешению. Для этого использовались структуры (PDB ID 2vb1 и 4ddb) лизозима HEWL (Hen's egg white lysozyme) — одного из преобладающих ферментов в яичном белке с охарактеризованной антимикробной активностью [1]. Этот белок долгое время использовался как модель в кристаллографических исследованиях, и для него было получено более 170 структур с разными характеристиками [2].
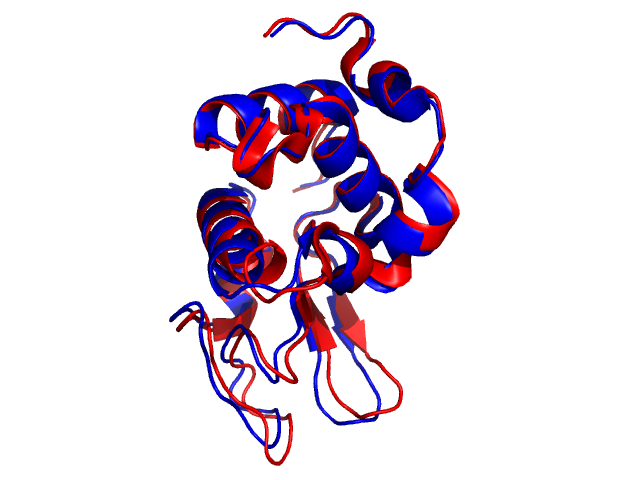
Некоторые различия между двумя структурами заметны уже при сравнении отображений типа "cartoon" (Рис. 1). Они касаются в оcновном неструктурированных петель (coils), но в меньшей степени относятся и к элементам вторичной структуры: углы наклона части α-спиралей и β-тяжей в двух моделях несколько отличаются.
Еще больше различий можно увидеть, если визуализироать отдельные атомы остава полипетидной цепи, а также соответствующую им электронную плотность (Рис. 2). В случае модели 4ddb по форме облаков электронной плотности можно с уверенностью предсказать ход цепи, тогда как более тонкие особенности различить уже сложно. Граничные поверхности почти полностью покрывают остав цепи, однако иногда плохо соответствуют положению отдельных атомов: атомы кислорода и азота в некоторых пептидных связях располагаются у поверхности или вовсе за пределами участков, ограниченных сеткой. Это говорит о неточности полученной атомной модели. Иная картина наблюдается для модели 2vb1: отдельные облака электронной плотности четко соответствуют вписанным в них атомам и часто полностью не покрывают связи между ними. Сетка, отражающая положение граничной поверхности, в этой модели гораздо более гладкая, так как ее грани имеют меньший размер. в некоторых участках видно, что области электронной плотности "раздваиваются", отражая разные положения подвижных сегментов полипептидной цепи.
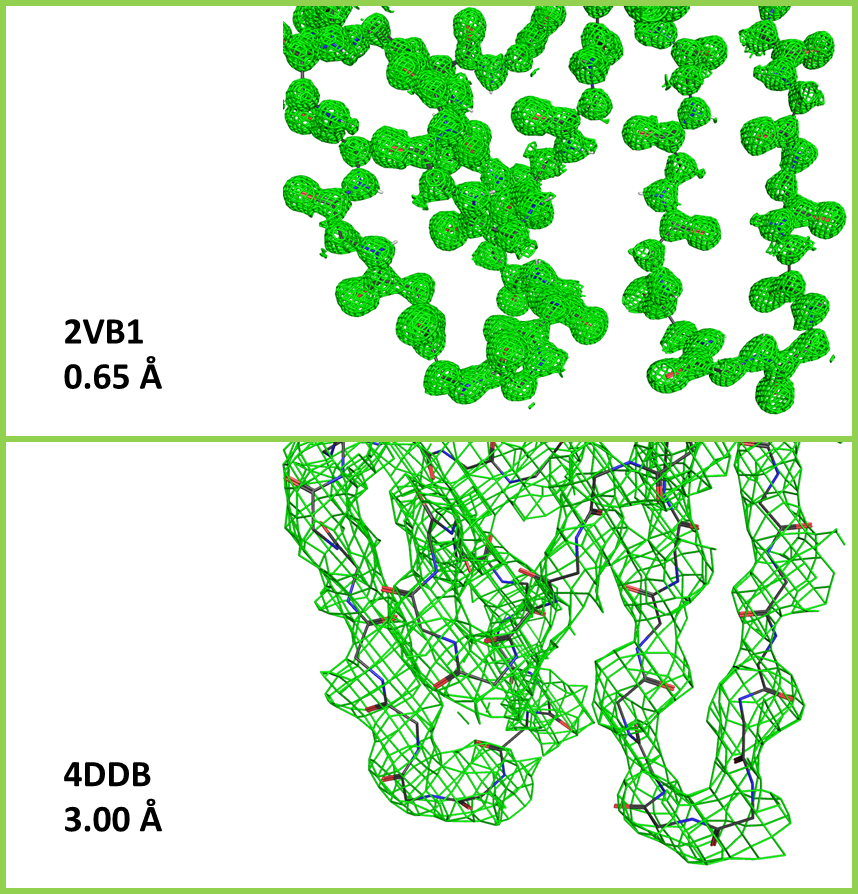
При реконструкции электронной плотности гармоники с лучшим разрешением позволяют различить более мелкие детали структуры. Поэтому можно заключить, что модель 2vb1 имеет более высокое разрешение в сравнении с 4ddb. Это подтверждается данными из PDB: структура 2vb1 имеет разрешение 0.65 Å, а 4ddb — 3.00 Å.
Сессия pymol для Рис. 2 (2vb1)
Сессия pymol для Рис. 2 (4ddb)
Задание 2
В этом и в следующем заданиях я работал со структурой лиганд-связывающего домена глутаматного рецептора GluR4 в комплексе с его агонистом — каинатом (PDB ID 3en3).
Для иследования распределения электронной плотности вокруг различных участков молекулы белка была получена серия отображений типа "mesh" с уровнями подрезки 1, 2 и 3 (Рис. 3).
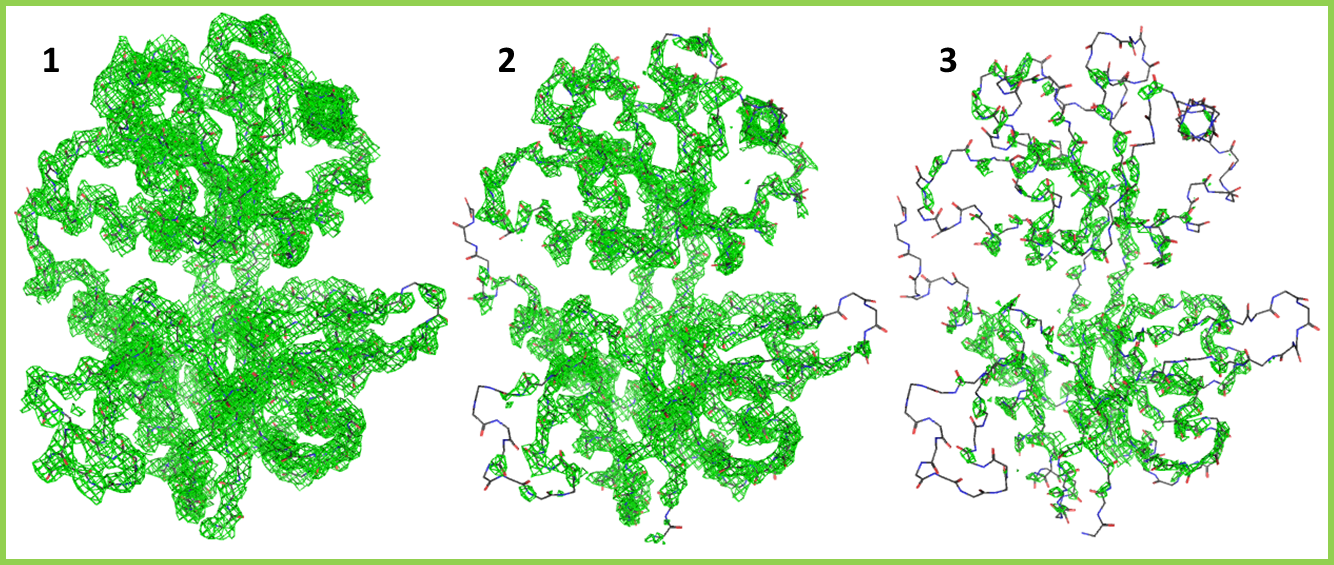
Ожидаемо, при увеличении уровня подрезки происходит отсечение все большей части рарспределения, и размер областей внутри граничных поверхностей последовательно уменьшается. Однако в разных частях молекулы эти изменения выражены в разной степени. Неструктурированные петли на поверхности белка и свободные концы полипептидной цепи при повышении уровня быстро теряют электронную плотность, тогда как ядро белковой глобулы в значительной степени сохраняет ее. Это говорит о том, что положение петель было реконструировано с меньшей степенью уверенности, что в свою очередь объясняется большей подвижностью этих участков в структуре белка.
Задание 3
При увеличении уровня подрезки изменялись также области электронной плотности вокруг лиганда (Рис. 4).
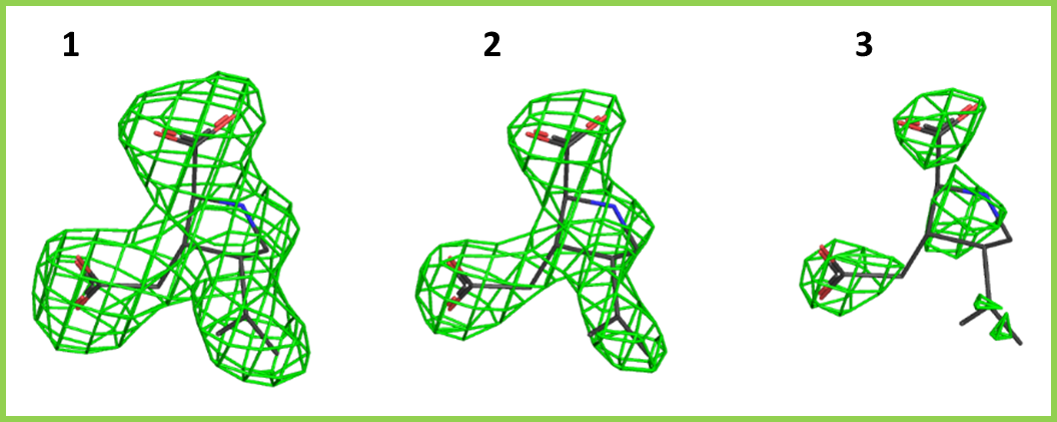
Реконструкция электронной плотности методом рентгеноструктурного анализа возможна благодаря способности электронов в составе молекул изучаемых веществ осуществлять рассеяние рентгеновского излучения. Вероятность появления рефлекса для участка структуры пропорциональна плотности распределения электронов в этом участке. Соответственно, атомы, обладающие большим количеством электронов, способных осуществлять дифракцию рентгеновских лучей, будут давать более сильный сигнал. Например, в данном случае при увеличении уровня подрезки электронная плотность лучше всего сохраняется вокруг атомов кислорода и (частично) азота лиганда, которые имеют больший атомный номер по сравнению с углеродом. Стоит также отметить, что карбоксильные группы в лиганде могут нести отрицательный заряд.
Источники
- Carrillo, W., & Ramos, M. (2018). Identification of Antimicrobial Peptides of Native and Heated Hydrolysates from Hen Egg White Lysozyme. Journal of medicinal food, 21(9), 915–926.
- Wang, J., Dauter, M., Alkire, R., Joachimiak, A., & Dauter, Z. (2007). Triclinic lysozyme at 0.65 Å resolution. Acta crystallographica. Section D, Biological crystallography, 63(Pt 12), 1254–1268.