Практикум 5
Задание 1
В данном задании нужно было предсказать протонирование остатков атомной модели заданного белка при pH кристаллизации с использованием алгоритма PROPKA.
Я работал с PDB ID 6MDV. Эта запись соответствует структуре эндо-бета-N-ацетилглюкозаимнидазы бактерии Streptococcus pyogenes — фермента, защищающего микроорганизм от иммунной системы хозяина путем расщепления консервативных гликанов, связанных с иммуноглобулином G. Судя по описанию в базе данных PDB, кристалл белка, использованный в рентгеновском эксперименте, был получен в условиях кислой среды при pH = 4.
Это значение pH и было указано при запуске алгоритма PROPKA. Асимметрическая ячейка кристаллла состоит из двух молекул белка, поэтому также была отмечена опция "Add/keep chain IDs in the PQR file". Для всех остальных параметров были оставлены значения по умолчанию.
Распределения полученных из выдачи программы значений pKa остатков аспартата, глутамата и гистидина представлены на рисунке ниже (Рис. 1). Для двух цепей они очень похожи, поэтому далее речь будет идти только о цепи A. Средние значения показателя для трёх остатков примерно соответствуют pKa, указанным в литературе: 6 для His, 4.25 для Glu и 3.65 для Asp. При этом для всех типов остатков в распределении присутствуют явные выбросы.
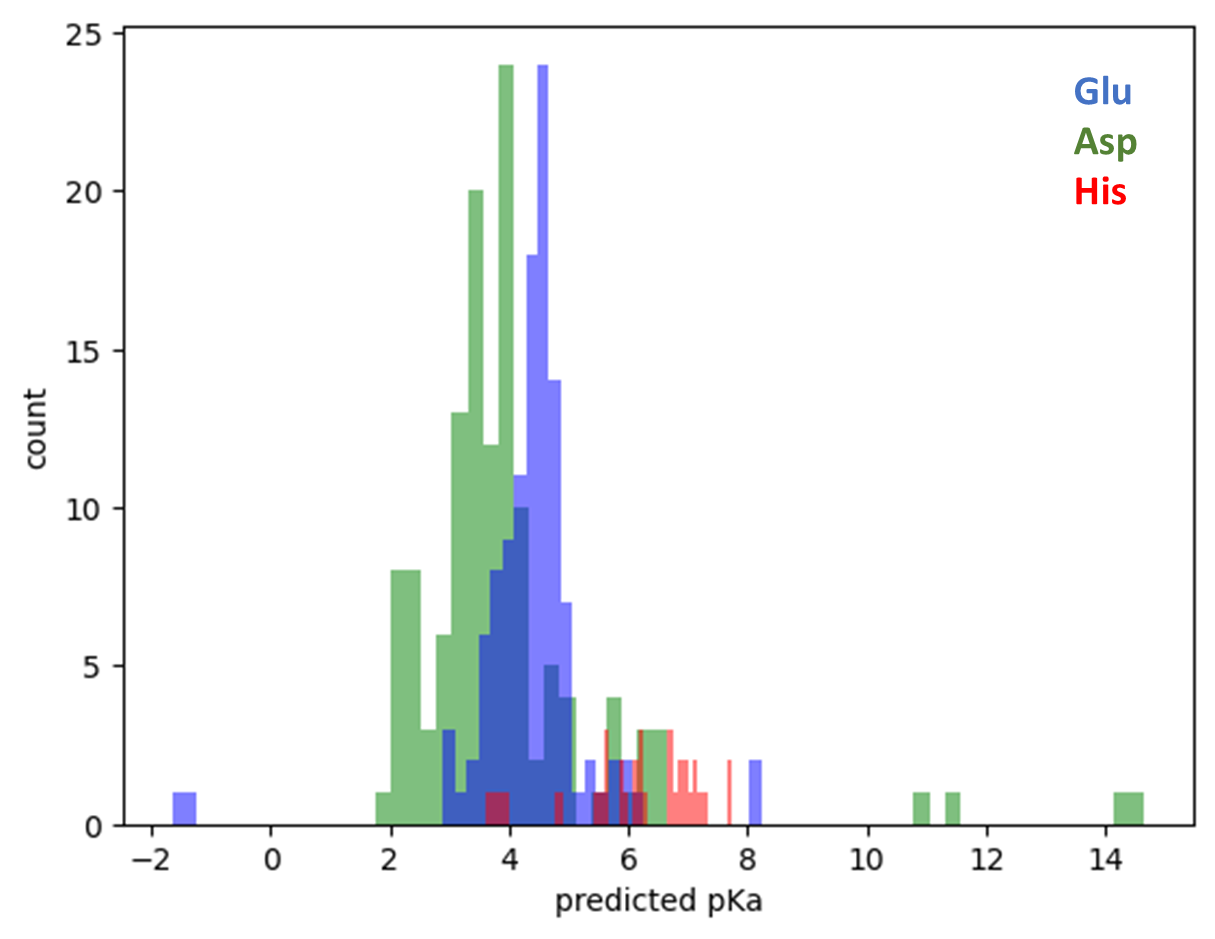
В случае аспартата самые большие значения pKa имеют остатки D226 (pKa = 14.66) и D184 (10,9). У следующего по величине параметра остатка D417 pKa равен 6.64, что уже сильно ниже. Наименее кислый остаток глутамата (E825) не так сильно выбивается из распределения и имеет pKa = 8.23. Остатков гистидина в белке сильно меньше, и их pKa не превосходит 7.72.
Исходя из этого, для дальнейшей работы были выбраны остатки D226 и D184. Анализ структуры белка показал, что они являются частью бета-бочонка рядом с сайтом связывания субстрата (Рис. 2). Можно заметить, что в этом участке структуры присутствуют сразу 4 кислых остатка: D182, D184, E186 и D226. Они связаны между собой и с другими остатками сетью водородных связей.
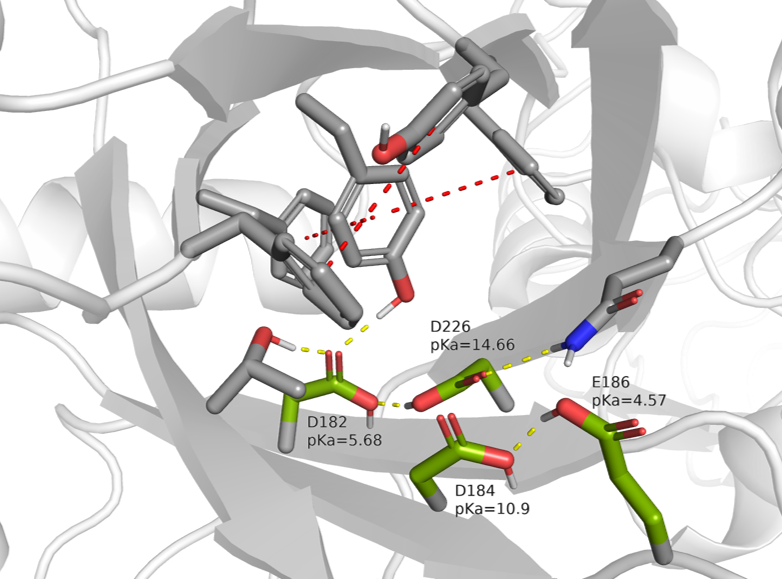
Остатки 182 и 186 при физическом значении pH, по-видимому, заряжены отрицательно. Из них самое низкое значение pKa имеет E186 (4.57, что близко к среднему). Он расположен в области входа в карман связывания у поверхности белка, поэтому его заряд более стабилен из-за влияния растворителя. Также стоит отметить, что наличие на этом остатке протона позволяет ему образовать водородную связь с D184, но при этом ограничивает возможность его взаимодействия с расположенным поблизости остатком глутамина. В случае D182 заряд, вероятно, стабилизируется сразу тремя водородными связями от окружающих остатков.
Выбранные для анализа остатки D226 и D184 занимают промежуточное положение: каждый из них в структуре находится между двумя другими кислыми остатками. По этой причине для них логично предположить высокие значения pKa. В дополнение к этому протон на карбоксильной группе D226 позволяет ему образовать водородную связь с D182.
Депротонирование даже одного из этих двух остатков (при наличии заряда на D182 и E186) вызвало бы сильное электростатическое отталкивание. Скорее всего, это повлекло бы за собой отклонение боковых цепей и потерю образуемых ими водородных связей. Описываемые остатки являются частью достаточно жёсткой бета-листовой структуры, стабилизируемой многочисленными водородными связями. Поэтому, вероятно, подобные изменения не привели бы к сильному нарушению структуры белка. Однако данный участок расположен вблизи активного центра, поэтому изменения сети водородных связей могли бы повлиять на активность фермента.
В целом, предсказанные значения pKa достаточно хорошо объясняются особенностями микроокружения описываемых остатков. При этом также отсутствуют основания считать неверными предполагаемые положения протонов. Их изменения в большинстве случаев приводили бы к потере водородных связей. Таким образом, в данном случае программа PROPKA дала правдоподобное предсказание протонирования остатков в белке.