Атлас контактов пепсина в комплексе с пепстатином
Общая характеристика
Название: Pepsin A-4
Организм: Homo sapiens (Human)
Длина: 326 аминокислотных остатков
Молекулярная масса: 41,977 Da
PDB ID: 1PSO
UniProt ID: P0DJD7
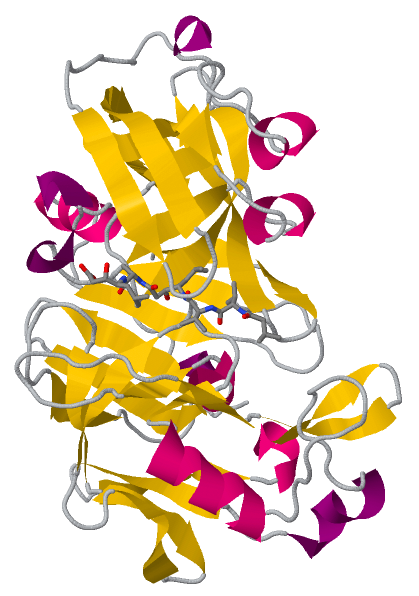
Пепсин — аспартатная протеаза, образующаяся из предшественника пепсиногена , который продуцируется слизистой желудка. Основной функцией пепсина является переваривание белков в желудке. Фермент наиболее активен при pH = 1,5-2. Низкий показатель pH позволяет пепсиногену расщепляться и образовывать активный пепсин. При достижении двенадцатиперстной кишки он принимает неактивную форму, так как pH повышается до 6.[1-3]
Пепсин также играет важную роль в патофизиологии ларингофарингеального рефлюкса, заболевание пищеварительного тракта, которое значительно влияет на структуры верхних дыхательных путей. В связи с слабой работой нижнего сфинктера пищевода желудочный сок может достигнуть гортани. В гортани соляная кислота и пепсин могут повредить важные структуры, например, связки и даже лёгкие.[4]
Механизм катализа пепсина
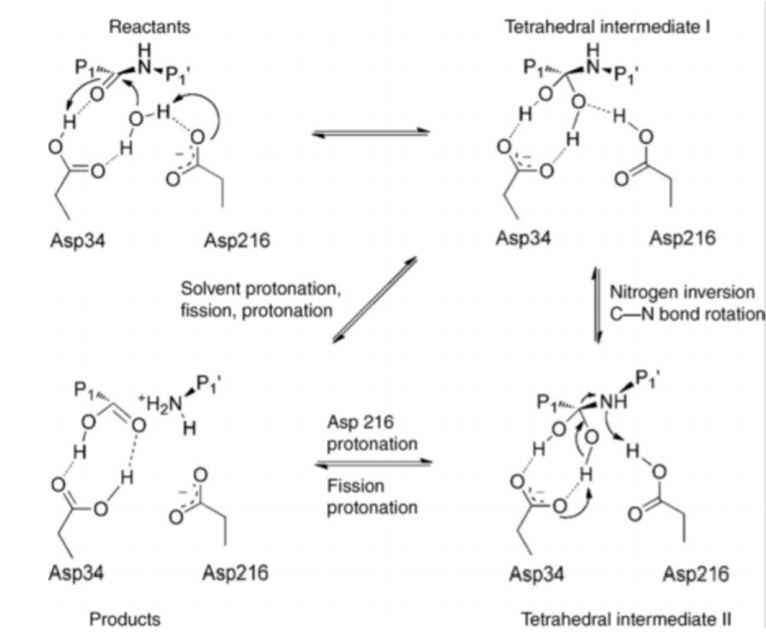
Механизм катализа пепсина не до конца понятен, однако ясно, что ключевыми для катализа являются остатки Asp 32 и Asp 215. В основном вопросы связаны с тем, какой именно остаток участвует в реакции. Поэтому Тереза Юниак-Лоу, Патрик Ф. Фокс при описании механизма реакции пользуются термином пара аспартатов. Первый шаг катализа состоит в том, что пара аспартатов отнимает протон у молекулы воды, а затем переносит его на кислород карбонильной группы в пептидной связи. Получившийся интермедиат обладает высокой энергией, что позволяет кислороду воды осуществить нуклеофильную атаку по карбоксильному углероду пептидной связи. В результате образуется оксоанион с тетраэдрической конфигурацией. Впоследствии этот интермедиат претерпевает гидролиз путем кислотного и основного катализа, включающего в себя транспорт протона от оксоаниона на пару аспартатов и от пары аспартатов на атом азота.[2]
Пепстатин
Название по IUPAC: (3S,4S)-3-hydroxy-4-[[(2S)-2-[[(3S,4S)-3-hydroxy-6-methyl-4-[[(2S)-3-methyl-2-[[(2S)-3-methyl-2-(3-methylbutanoylamino)butanoyl]amino]butanoyl]amino]heptanoyl]amino]propanoyl]amino]-6-methylheptanoic acid
Брутто-формула: C34H63N5O9
Молярная масса: 685.9 Da
PubChem CID: 5478883
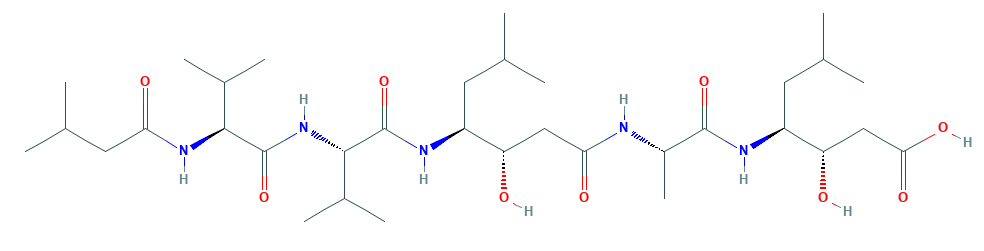
Пепстатин — ингибитор гидролаз, выделенный из Streptomyces argenteolus subsp. toyonakensis. Пепстатин - гексапептид с последовательностью Iva-Val-Val-Sta-Ala-Sta, где Iva - остаток изовалериановой кислоты, а Sta - остаток статина. Статин - гамма-аминокислота, считается, что он отвечает за ингибиторную способность пепстатина, так как он имитирует переходное тетраэдрическое состояние интермедиата в реакции гидролиза пептидной связи.[1,7]
Визуализация молекулярных взаимодейсвий
Взаимодействие с пепстатином
Как и в других ингибиторных комплексах аспартатных протеаз с пепстатином первый гидроксильный кислород статина находится в активном центре между карбоксильными группами Asp 32 и Asp 215. Во всех нативных структурах других аспартатыных протеаз это положение занимает молекула воды. Паттерн водородных связей между пепстатином и различными аспартатными протеазами схож. Значительную роль во взаимодействии между пепстатином и белком играют Ван-дер-Ваальсовы взаимодействия (Табл. 1). Важно отметить, что большинство взаимодействий происходит с остатками Sta 4, Val 3, Val 2. [1]
При связывании пепстатина происходит незначительное изменение конформации пепсина, при котором атомы альфа-атомы остова сдвигаются на расстояние порядка 0.33 Å. Также необходимо отметить, что С-конец совершает большее движение по отношению к остальной части молекулы, тогда как N-конец и центральная часть перемещаются в меньшей степени относительно друг друга.[1]
| Остаток цепи ингибитора | Остаток фермента | Общее количество взаимодейсвий |
|---|---|---|
| Iva 11 | Met 12 Ser 219 Gln 287 |
3 |
| Val 12 | Met 12 Thr 77 Phe 111 Gly 217 Ser 219 |
8 |
| Val 13 | Gly 76 Thr 218 Gln 287 Met 289 |
4 |
| Sta 14 | Val 30 Asp 32 Tyr 75 Thr 77 Ile 120 Gly 217 |
12 |
| Ala 15 | Ser 25 Gly 217 |
2 |
| Sta 16 | Thr 74 Tyr 75 Gly 76 Leu 291 |
6 |
Водородные связи
Водородная связь — взаимодействие между водородом, ковалентно связанным с электроотрицательным атомом (например, водороды ОН или NH групп), и другим электроотрицательным атомом (например, азотом или кислородом). Возможность образования водородной связи обеспечивается маленьким размером протона, а также наличием у него незаполненной орбитали. Водородные связи обеспечивают формирование и поддержание таких вторичных структур, как альфа-спирали и бета-слои, а также являются одним из взаимодействий, способствующих образованию третичной структуры белка.[8]
Поиск водородных связей осуществлялся в альфа-спирали c помощью команды calculate hbonds, затем было произведено измерение длин водородных связей.
Солевые мостики
Солевые мостики — тип взаимодействий между положительно и отрицательно заряженными радикалами аминокислот. Этот тип связи способствует образованию третичной белковой структуры связи и служит для стабилизации конформации и поддержания третичной и четвертичной структуры.[9]
Поиск солевых мостиков осуществлялся выделением всех заряженных аминокислот в белке с последующим измерением расстояний между отрицательно и положительно заряженными боковыми цепями аминокислот для определения возможности появления между этими двумя аминокислотами солевого мостика. Измеренные значения (Табл. 2.) соответствуют литературным данным, согласно которым длинна солевого мостика не должна быть порядка 2-6 Å.[9]
| Остатки, формирующие мостик | Расстояние, Å | |
|---|---|---|
| 1 | Arg 315 - Asp 138 | 4.0 |
| 2 | Arg 307 - Asp 11 | 4.2 |
| 3 | Glu 1128 - Arg 1125 | 3.5 и 2,8 |
| 4 | His 53 - Asp 118 | 4.4 |
Дисульфидные мостики
Дисульфидные мостики — ковалентная связь между двумя атомами серы, входящими в состав двух остатков серосодержащей аминокислоты цистеина.
Нахождение дисульфидных мостиков осуществлялось с помощью выделения всех цистеинов в белке, всего их оказалось 6. Выяснилось, что все выделенные цистеины образуют дисульфидные мостики, то есть всего было найдено 3 пары. Дисульфидные мостики способствуют образованию третичной четвертичной структур белка.
Гидрофобные взаимодействия
Гидрофобные взаимодействия в молекулах белков обусловлены тем, что взаимодействие полярных молекул воды с неполярными радикалами аминокислот приводит к уменьшению энтропии, поэтому наиболее энергетически выгодно уменьшить площадь соприкосновения неполярных участков белка с полярными молекулами растворителя. Это приводит к тому, что гидрофобные радикалы аминокислот сближаются и погружаются внутрь белка.
| Атом Trp190 | Ближайший атом другой аминокислоты | Расстояние (Å) |
|---|---|---|
| [TRP]190:E.NE1 | [LEU]123:E.O | 2.94 |
| [TRP]190:E.CD1 | [PHE]313:E.CD2 | 3.87 |
| [TRP]190:E.CG | [TYR]189:E.C | 3.91 |
| [TRP]190:E.CE2 | [PHE]313:E.CD2 | 3.74 |
| [TRP]190:E.CD2 | [PHE]313:E.CD2 | 3.49 |
| [TRP]190:E.CE3 | [VAL]184:E.CG2 | 3.7 |
| [TRP]190:E.CZ3 | [ASP]314:E.O | 4.01 |
| [TRP]190:E.CH2 | [PHE]313:E.C | 3.73 |
| [TRP]190:E.CZ2 | [ARG]315:E.CD | 3.6 |
| [TRP]190:E.CB | [TYR]189:E.C | 3.64 |
| Среднее значение расстояния | 3.66 | |
Для выделения гидрофобного ядра была использована команда select hydrophobic, с помощью которой были визуализированы гидрофобные аминокислоты. Затем был выбран участок с наиболее плотной упаковкой гидрофобных радикалов. Для анализа плотности упаковки атомов в гидрофобном ядре был выбран остаток Trp 190.
Чтобы оценить возможность размещения молекулы воды в гидрофобном ядре, были измерены расстояния между атомами Trp 190 и ближайшими атомами других аминокислот (Табл. 3.). Среднее измеренное расстояние - 3.66 Å. Чтобы молекула воды могла разместиться между двумя атомами углерода, необходимо расстояние, составляющее более, чем сумма удвоенного радиуса Ван-дер-Ваальса кислорода и удвоенного радиуса Ван-дер-Ваальса углерода, что составляет 6.5 Å. Таким образом, в выбранное гидрофобное ядро не может поместиться молекула воды.
Водные мостики
Довольно часто водородная связь между двумя аминокислотными остатками может осуществляться посредством молекулы воды. Такая структура нередко реализуется в каталитических центрах аспартатных протеаз и осуществляет важные функции. В нативной структуре пепсина (без ингибитора) молекула воды локализована в реакционном центре, а также играет большую роль в катализе. [1]
Стэкинг
В ходе исследования структуры пепсина были найдены стэкинг-взаимодействия, а именно:
- Т-стэкинг: плоскости π-систем взаимно перпендикулярны;
- π-стэкинг в параллельно-сдвинутой конфигурации: π-системы смещены относительно друг друга;
- π-катионный стэкинг: взаимодействие π-системы и катиона. [10]
Сперва были выделены все ароматические аминокислоты. При поиске T-стэкинг взаимодействий и π-стэкинг взаимодействий в параллельно-сдвинутой конфигурации учитывалось взаиморасположение всех ароматических остатков.[11]
При поиске π-катионных взаимодействий учитывались также расположения положительно заряженных аминокислот. Выяснилось, что остатки гистидина и лизина в искомом взаимодействии не участвовали. Однако между остатками Arg 315 и Tyr 125 с большой вероятностью реализуется взаимодействие по типу π-катионного стэкинга.
Вклад авторов
Валерий Вяльцев: написание скрипта, оформление сайта, анализ данных
Арсен Тедеев: написание скрипта, поиск информации, анализ данных, оформление сайта
Максим Смирнов: написание скрипта, оформление сайта, написание текста отчета
Мария Корлякова: оформление сайта, поиск информации, написание скрипта, написание текста отчета
София Наварнова: написание текста отчета, редактирование скрипта, поиск информации и анализ данных
Список литературы
- Fujinaga, M., Chernaia, M. M., Mosimann, S. C., James, M. N. G., & Tarasova, N. I. (2008). Crystal structure of human pepsin and its complex with pepstatin. Protein Science, 4(5), 960–972.doi:10.1002/pro.5560040516
- Uniacke-Lowe, T., & Fox, P. F. (2017). Chymosin, Pepsins and Other Aspartyl Proteinases: Structures, Functions, Catalytic Mechanism and Milk-Clotting Properties. Cheese, 69–113.doi:10.1016/b978-0-12-417012-4.00004-1
- D.F. Magee(1974), Pepsin,Medical Clinics of North America,58(6), 1277-1287. doi:10.1016/S0025-7125(16)32070-3.
- Kowalik K, Krzeski A. (2017). The role of pepsin in the laryngopharyngeal reflux. Otolaryngol Pol. 2017 Dec 30;71(6):7-13. doi: 10.5604/01.3001.0010.7194
- Veerapandian, B., Cooper, J. B., Šali, A., Blundell, T. L., Rosati, R. L., Dominy, B. W., … Hoover, D. J. (2008). Direct observation by X-ray analysis of the tetrahedral “intermediate” of aspartic proteinases. Protein Science, 1(3), 322–328.doi:10.1002/pro.5560010303
- National Center for Biotechnology Information (2021). PubChem Compound Summary for CID 5478883, Pepstatin. Retrieved March 30, 2021 from https://pubchem.ncbi.nlm.nih.gov/compound/Pepstatin.
- J Marciniszyn Jr; J A Hartsuck; J Tang. (1976). Mode of inhibition of acid proteases by pepstatin. Journal of Biological Chemistry, ISSN: 0021-9258, Vol: 251, Issue: 22, Page: 7088-7094
- Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J. (2011-07-08). "Definition of the hydrogen bond (IUPAC Recommendations 2011)". Pure and Applied Chemistry. 83 (8): 1637–1641. doi:10.1351/PAC-REC-10-01-02. ISSN 1365-3075
- Barlow DJ, Thornton JM. 1983. Ion pairs in proteins. J. Mol. Biol. 168: 867–885.
- Gallivan, J. P., & Dougherty, D. A. (1999). Cation-pi interactions in structural biology. Proceedings of the National Academy of Sciences, 96(17), 9459–9464.doi:10.1073/pnas.96.17.9459
- McGaughey, G. B., Gagné, M., & Rappé, A. K. (1998). π-Stacking Interactions. Journal of Biological Chemistry, 273(25), 15458–15463. doi:10.1074/jbc.273.25.15458