


В археях и бактериях, алкогольдегидрогеназа играет важную роль в ферментации: пируват в одной из терминальных стадий гликолиза превращается в ацетальдегид и углекислый газ, затем ацетальдегид восстанавливается до этанола с помощью данного фермента. Целью этого последнего шага является регенерация NAD +, чтобы гликолиз мог продолжаться.
На последующих рисунках изображено взаимодействие белка алкогольдегидрогеназы с его кофактором NADP-H (Восстановленной формой NADP).
Никотинамидадениндинуклеотидфосфат (НАДФ, NADP) — широко распространённый в природе кофермент некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях. NADP, — кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток. [1]
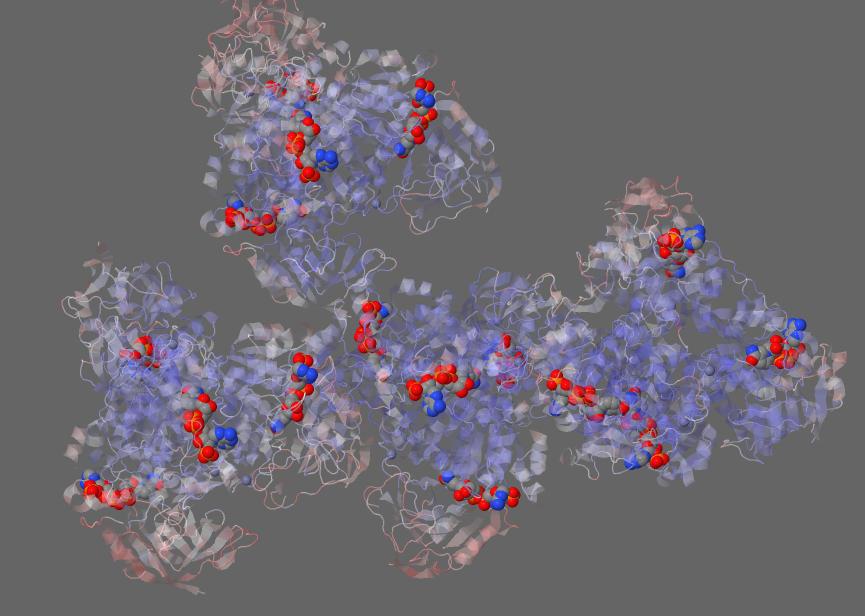
Рис.1. Изображение всех лигандов белка алкогольдегидрогеназа с идентификатором PDB 4JBI.
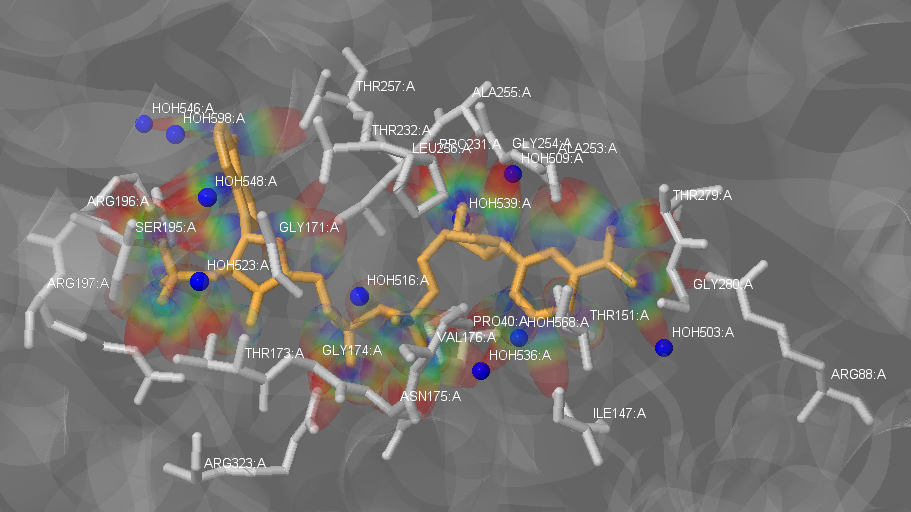
Рис.2. Изображение лиганда NADPH в активном центре белка. Оранжевым отображен сам лиганд, прозрачным серым цветом изображен белок, проволочной моделью и покрашенные светло-серым изображены аминокислоты, молекулы воды изображены шариковой моделью синим цветом, радужными облаками в форме сигареты изображены все виды взаимодействий лиганда с молекулами воды и аминокислотными остатками.
Последнее изображение получено с помощью следующего скрипта jMol.
Более подробное рассмотрение части активного сайта алкогольдегидрогеназы с идентификатором PDB 4JBI приведены на рисунках ниже (рис.3-4). Рис. 3 - изображение, наглядно показывающее месторасположение остатков аминокислот и лиганда, на рис. 3 молекулы покрашены цветом в соответствии с атомами (окраска CPK). На рисунках видно, что с лигандом взаимодействуют аминокислотные остатки [ILE]147:A, [ALA]253:A, [THR]279:A, [ARG]88:A и две молекулы воды: [HOH]568:A и [HOH]503:A ван-дер-ваальсовыми взаимодействиями, т.к. водородные связи командами Jmol не выявлены. Последовательности команд Jmol, использованные для получения рис.3 вы можете найти здесь
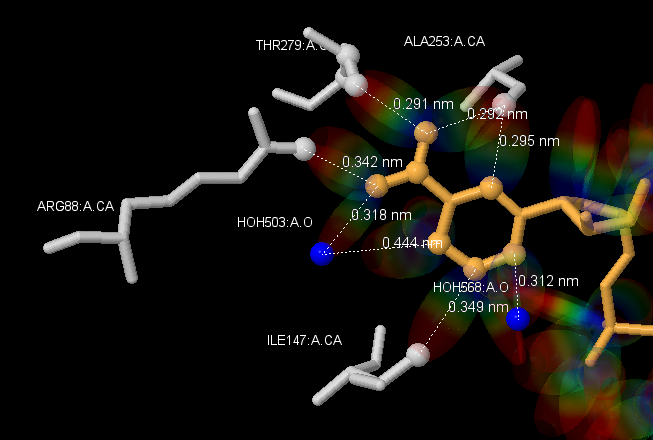
Рис. 3 Изображение части лиганда алкогольдегидрогеназы 4JBI с частью активного сайта. Оранжевым отображен сам лиганд, прозрачным серым цветом изображен белок, проволочной моделью и покрашенные светло-серым изображены аминокислотные остатки, являющиеся частью активного сайта белка. Шариковой моделью изображены атомы, принимающие участие в образовании связей активного центра. Водородные связи отстутсвуют, но должны были быть обозначены зеленым.
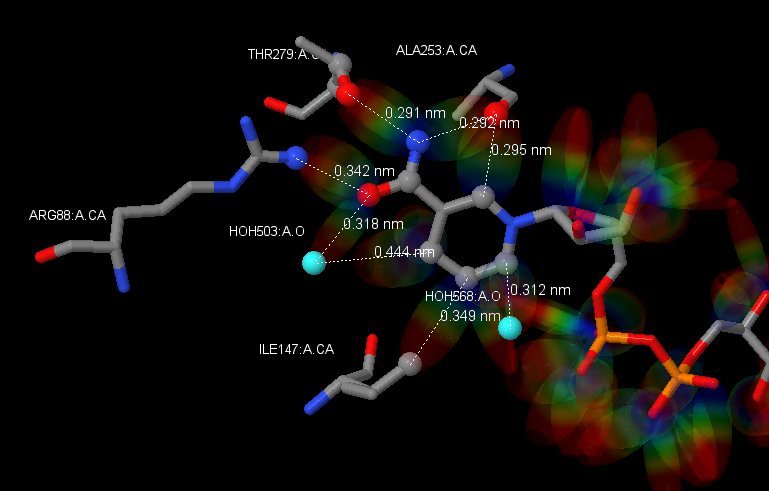
Рис. 4 Изображение части лиганда алкогольдегидрогеназы 4JBI с частью активного сайта. Показаны взаимодействующие с этой частью лиганда молекулы, находящиеся на расстоянии <4.5 ангстрем, что необходимо для образования водородных связей и гидрофобных взаимодействий. Пунктиром соединены взаимодействующие атомы и обозначены расстояния между ними. Молекулы покрашены методом CPK. Молекулы воды изображены цветом циан.
Список источников:
[1]Wikipedia