


В рамках данного задания нужно было проверить корректность предсказания трансмембранных участков сервисом TMHMM и проверить консервативность различных частей трансмембранных белков.
Для этого была составлена репрезентативная выборка гомологов белка Intramembrane aspartate protease(идентификатор PDB - 4Y6K) археи Methanoculleus marisnigri. Поиск гомологов осуществлялся с помощью protein-balst -> PSI-BLAST в базе данных nr. Поиск производился отдельно по трём суперсемействам, при поиске по бактериям были исключены филумы Proteobacteria, Firmicutes, Actinobacteria, чтобы получить больше редких последовательностей, при поиске по археям был исключен класс Methanomicrobia, к которому принадлежит исследуемая архея. Стоит отметить, что при первой итерации среди было найдено всего 4 эукариотических белка и 11 прокариотических, среди которых было много белков, принадлежащих одному организма. Возможно это может повлиять на поседующие результаты. Но все выбранные белки имеют очень маленькое -> очень хорошее значение e-value и Identity не менее 30%.
Последовательности всех найденных гомологов были объединены в общий файл и выравнены с помощью сервера Muscle. Полученное выравнивание было открыто в программе Jalview, покрашено ClustalX by conservation 40% (синим гидрофобные, красным - гидрофильные). Изображение выравнивания можно увидеть на рис. 1
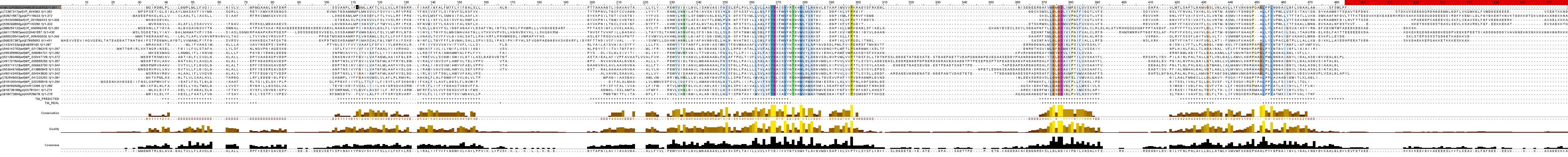
Рис.1. Выравнивание белков.
С последовательностью белка была ассоциирована его трёхмерная структура. В строке аннотации TM_REAL отмечены участки трансмембранных спиралей белка на основании информации о белке 4Y6K в базе данных ОРМ.
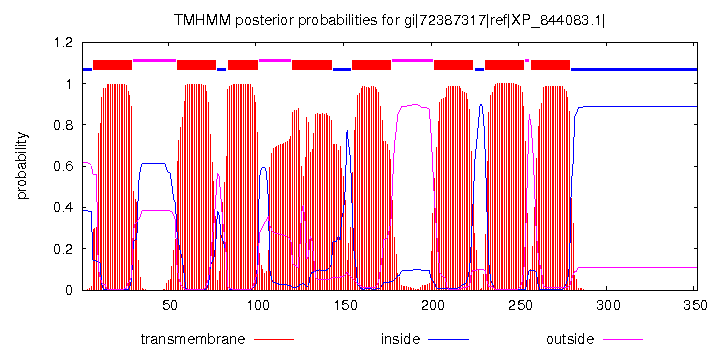
Далее с помощью программы TMHMM для белка signal peptide peptidase из организма Trypanosoma brucei bruсei - гомолога исследуемого белка было получено предсказание трансмембранных спиралей. Эти предсказанные участки были отмечены в строке аннотации TM_PREDICTED. Проект JalView. Изображение графика из выдачи TMHMM можно увидеть на рис. 2.
Изображение трехмерной структуры белка с такой же покраской ClustalX приведено на рис. 3
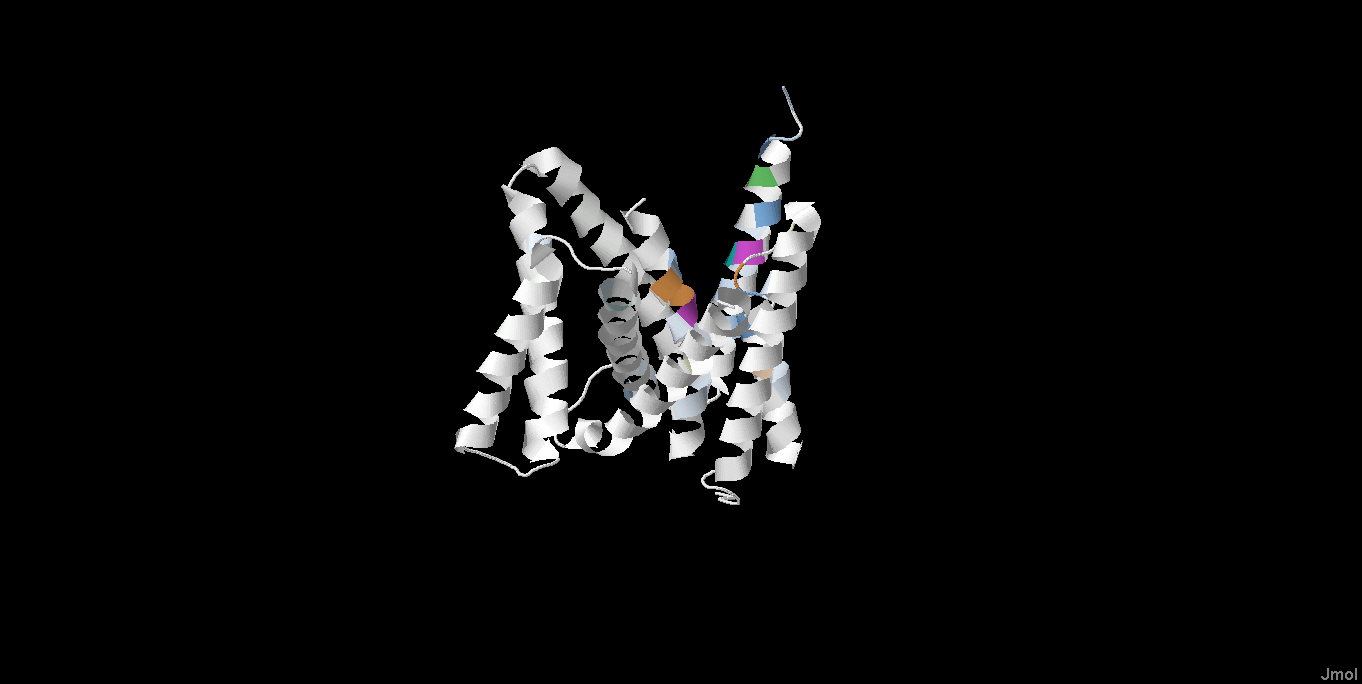
Рис.3. Трехмерная структура одной из 4 цепей трансмембранного белка (цепь B).
На основании полученных результатов можно заключить, что в целом более консервативны гидрофобные участки, которые являютс частью трансмембранных доменов, хотя говорить о значительной консервативности последовательностей исследуемых белков нельзя. Интересно, что в трансмембранной спирали, изображенной на рис. 4 есть несколько гидрофильных аминоксилот среди гидрофобных - аспарагиновая кислота и тирозин. Это может объясняться тем, что данные аминокислоты участвуют во взаимодействии с другими белками (т.к. сигнальный пептид), а так же могут участвовать в формировании самой трансмембранной спирали, т.к. гидрофильные участки заставляют гидрофобные свернуться вокруг них в гидрофобной мембране.

Рис.4. Гидрофильные аминокислоты в трансмембранной спирали.