


Модели
Для работы был выбран эпидермальный белок, связывающий жирные кислоты. Белок состоит из одной цепи, длина которой составляет 135 аминокислотных остатка. Он был взят из таблицы, и отвечает всем указанным на странице практикума критериям. РСА модель - 1B56 (разрешение 2.05 A), ЯМР модель - 1JJJ (имеется 20 моделей).
На рис. 1 показаны ЯМР и РСА структуры белка. Видно, что структуры ЯМР очень хорошо согласуются между собой. Также видно, что структуры РСА и ЯМР и в принципе похожи между собой. На глаз не видно особенных различий, кроме небольших отклонений в положениях отдельных нитей.
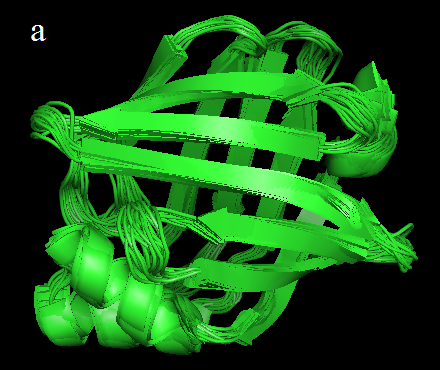

Рис.1 Структуры белка. На рис. а представлена структура, полученная с помощью ЯМР (все 20 моделей отображены с помощью команды set all_states, on), на рис. б - РСА.
Водородные связи в РСА структуре 1UOH
Я выбрала 3 водородные связи для анализа (их можно найти на рисунках 3-5):
1.Остовную в бета-листе- между Cys 120 и 127, которые при этом еще и образуют дисульфидную связь
select resi 120 or resi 127
distance arggln, resi 96 and name oe1, resi 109 and name hh22
2.Водородную связь боковых цепей в ядре белка - между Gln 96 и Arg 109 select resi 96 or resi 109
3.Водородную связь в петлях, выходящих на поверхность глобулы - Glu 25 и Asn 123:
select resi 25 or resi 123
distance gluasn, (resi 25 and name OE1), (resi 123 and name H)
Будем считать, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3.5 A. Условие на углы проверяем визуально: воображаемый водород должен быть на линии донор-акцептор или отклоняться от этой линии не более чем на 70°. А вообще можно попросить PyMol показать все водородные связи
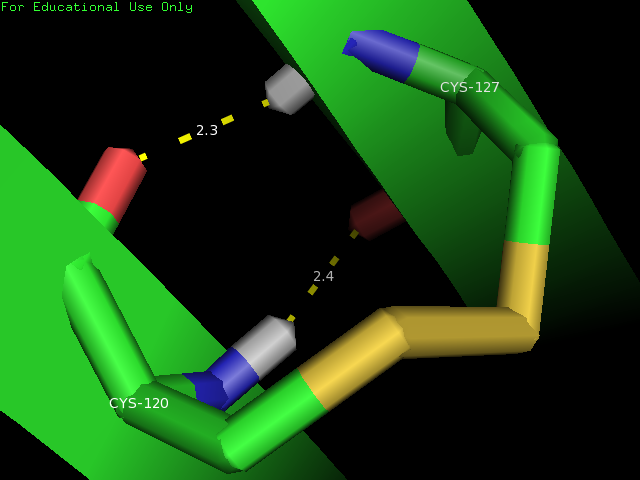
Рис.2 Остовная водородная связь в альфа-спирали
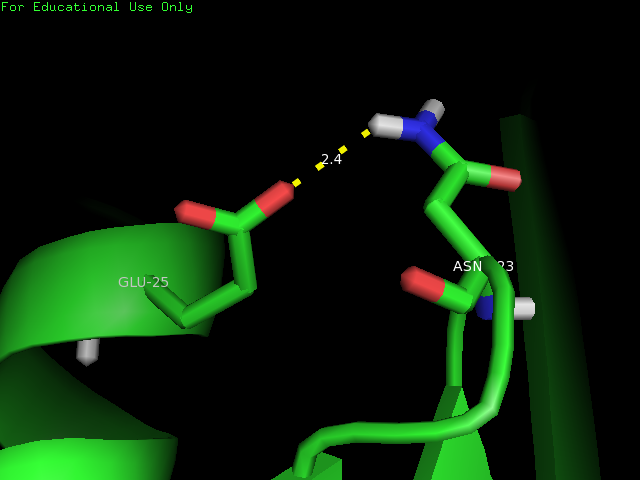
Рис.3 Водородная связь в петлях, выходящих на поверхность глобулы
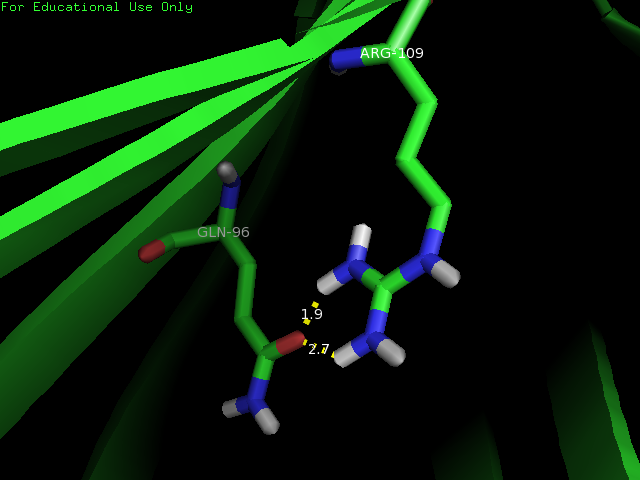
Рис.4 Водородную связь боковых цепей в ядре белка
Выбранные водородные связи были проанализированы в ЯМР структуре. Из двух связей между остовом цистеинов выбрана одна, как и между аргинином и гуанином
| Связь | Расположение | РСА | Процент ЯМР структур | Max r | Min r | Median r |
|---|---|---|---|---|---|---|
| Cys 120 и Cys 127 | остов бета-листа, центр глобулы | 2,3 | 100 | 2,3 | 1,7 | 1,9 |
| Gln 96 и Arg 109 | боковые радикалы бета-листа | 2,4 | 40 | 8,5 | 1,8 | 3,6 |
| Glu 25 и Asn 123 | боковые радикалы на поверхности белка | 1,9 | 35 | 9,9 | 1,7 | 5,9 |
Выводы
Как и ожидалось, в ЯМР наибольшее количество моделей образуют водородную связь в остове бета-листа, находящегося в центре глобулы. Данные РСА и ЯМР не согласуются друг с другом радикально в подвижных участках белка (между радикалами на поверхности и между аминокислотами в петле). Это можно объяснить и тем, что участки на поверхности белка более подвижны, чем в центре, а так ж тем, что выбранные аминокислоты могут образовывать несколько вариантов водородных связей (выступая донором или акцептором).