PDBID: 3CVB
Целью задания 1 было показать, какие взаимодействия стабилизируют различные альтлоки заданного
остатка в заданной цепи данной структуры (в моем случае - это HIS92 в цепи А, структура
3CVB). Для начала, рассмотрим
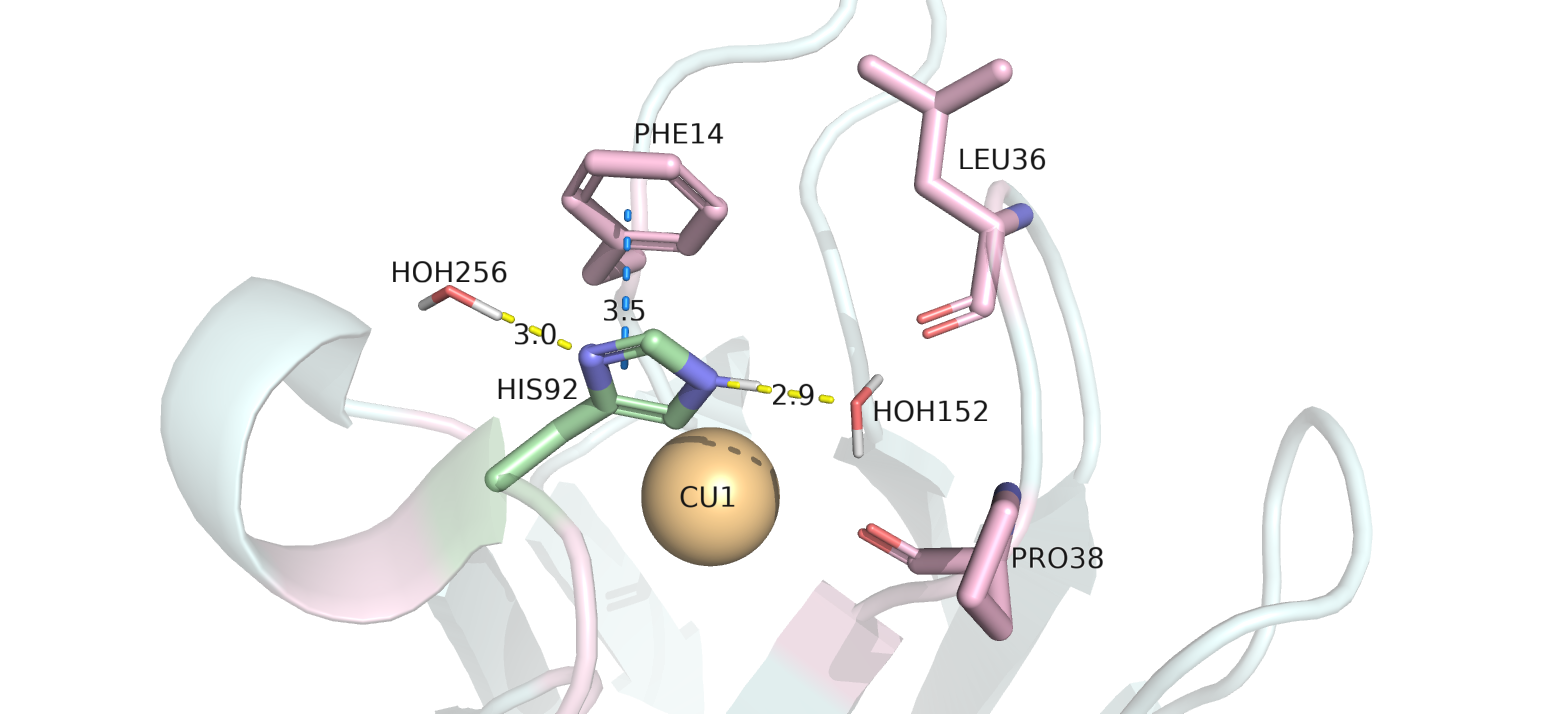
альтлок А - предполагаемые взаимодействия перечисленны ниже и изображены на рисунке 1.1.
1) Водородная связь с HOH152 (dist = 2.9). В данной структуре протоны при загрузке отсутствовали
и можно было только добавить их с помощью PyMOL, а затем регулировать на свое усмотрение.
Как мне показалось, наиболее правдоподобно выглядит ситуация, когда молекула HOH152 стабилизируется тремя водородными
связями - по одной с кислородами остовов остатков PRO38 и LEU36 (не изображены на рисунке, здесь кислород воды выступает донором протонов) и
одной с ε-азотом HIS92 (здесь кислород донирует свои неподеленные электронные пары и он акцептор протона азота). При этом, HIS92, вероятно, не может быть протонирован, так как
если он протонирован, то остаток
гистидина заряжен положительно, в то время, как
рядом с ним находится положительно заряженный ион меди (CU1) - они просто будут отталкиваться друг от
друга. Cледовательно, наиболее вероятно, что протон будет только на δ-азоте. Тогда, вероятно, если в сторону HOH152 от ε-азота будет смотреть протон, то ε-азот может стать
акцептором электронной пары кислорода HOH152 и они могут образовать водородную связь.
2) Водородная связь δ-азота гистидина с HOH256 (dist = 3.0).
3) Пи-стэкинг с кольцом PHE14 (dist = 3.5). В данной ситуации происходит стабилизация кольцом
с сопряженной системой пи-электронов фенилаланина.

Рисунок 1.1. Взаимодействия остатка HIS92 (A) (покрашен зеленым). Желтым цветом показаны водородные связи, синим цветом показан пи-стэкинг.
Далее рассматриваются взаимодействия альтлока Б проиллюстрированные на рисунке 1.2.
1) Пи-стэкинг с кольцом PHE14 (dist = 3.8). Взаимодействие аналогично третьему взаимодействию
альтлока А.
2) Тетраэдрическая координация атома меди CU1 (dist = 2.3). Взаимодействие объясняется, с одной стороны, силами электростатического
притяжения, а с другой, донированием неподеленных электронных пар атомов аминокислотных остатков на свободные орбитали меди.
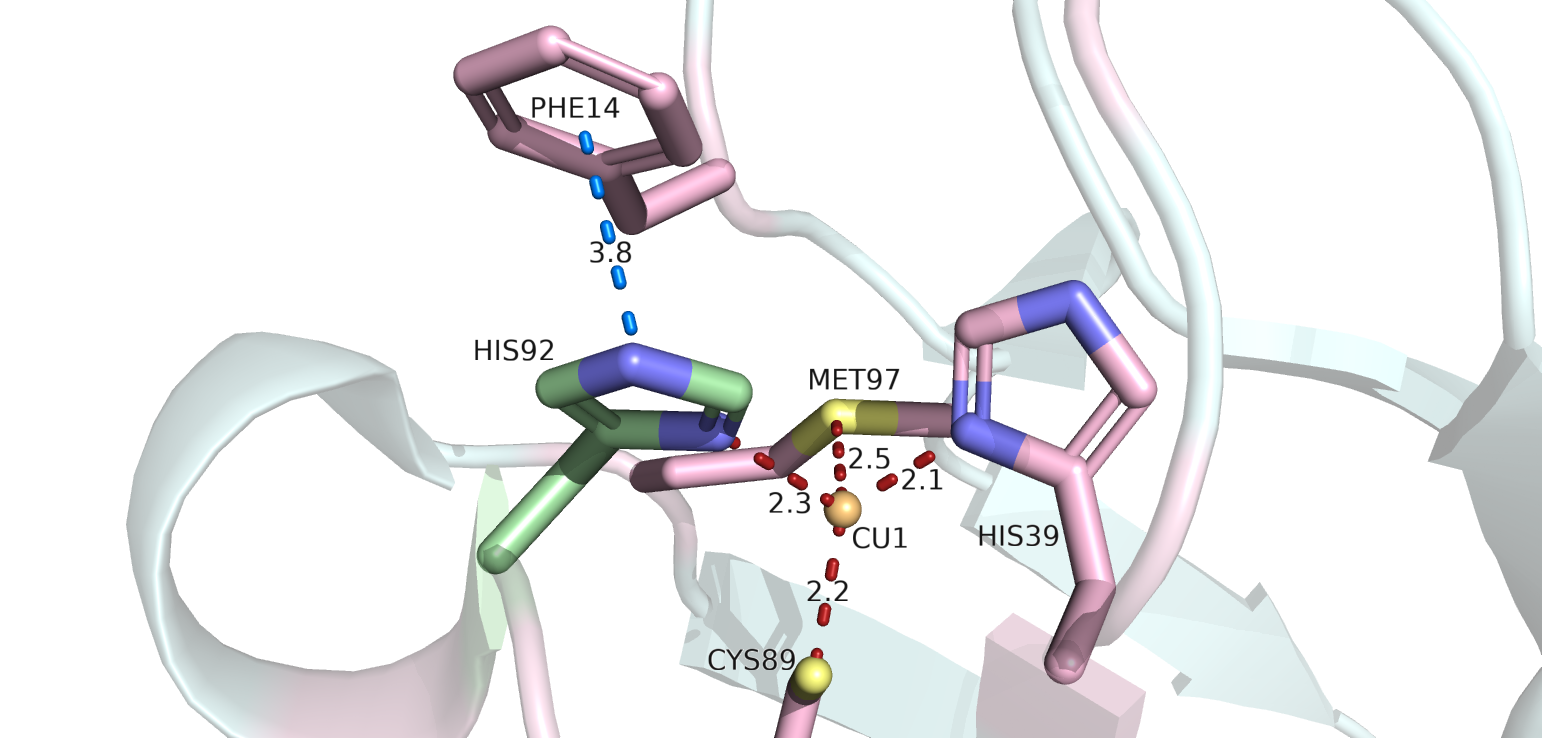
Рисунок 1.2. Взаимодействия остатка HIS92 (B) (покрашен зеленым). Красным цветом покрашены координационные связи, синим цветом показан пи-стэкинг.
Таким образом, подводя итоги, альтлок А стабилизируется тремя взаимодействиями, а альтлок Б - двумя.
Если мы заглянем в файл PDB, то увидим населенность по 0,5 для обоих альтлоков. В целом, полученные данные
согласуются с теоретическими, так как водородная связь с HOH256 альтлока А кажется совсем незначимой в плане стабилизации
по сравнению с взаимодействием с ионом меди CU1 альтлока Б. Так как на уровне кристалла населенность может быть соотнесена с
долей ячеек кристалла с данным положением атома, мы можем сделать вывод, что атомы альтлока А
встречаются в такой же доле ячеек, что и атомы альтлока В.
PDBID: 3CVB
В этом задании нужно было посмотреть, как в глобуле белка распределены B-факторы атомов остова. Также нужно было найти боковой радикал с большими значениями B-факторов и посмотреть как B-фактор связан с покрытием атома электронной плотностью.
Если говорить простым языком, то B-фактор - это некая характеристика атома или групп атомов,
которая описывает степень 'размазывания' электронной плотности, появляющуюся из-за каких-то
тепловых и других эффектов, увеличивающих подвижность атомов. Соответственно, чем больше
В-фактор, тем более часть белка красная.
Структура цепи А 3CVB на рисунке 2.1 была
покрашена палитрой синий-белый-красный. Нетрудно заметить, что белые и красные участки расположены
ближе к поверхности белковой глобулы. Так как мы рассматриваем только остов, подвижных радикалов аминокислотных остатков не видно, но
можно заметить, что на поверхности белковой глобулы много красных 'подвижных' пятен именно от них.
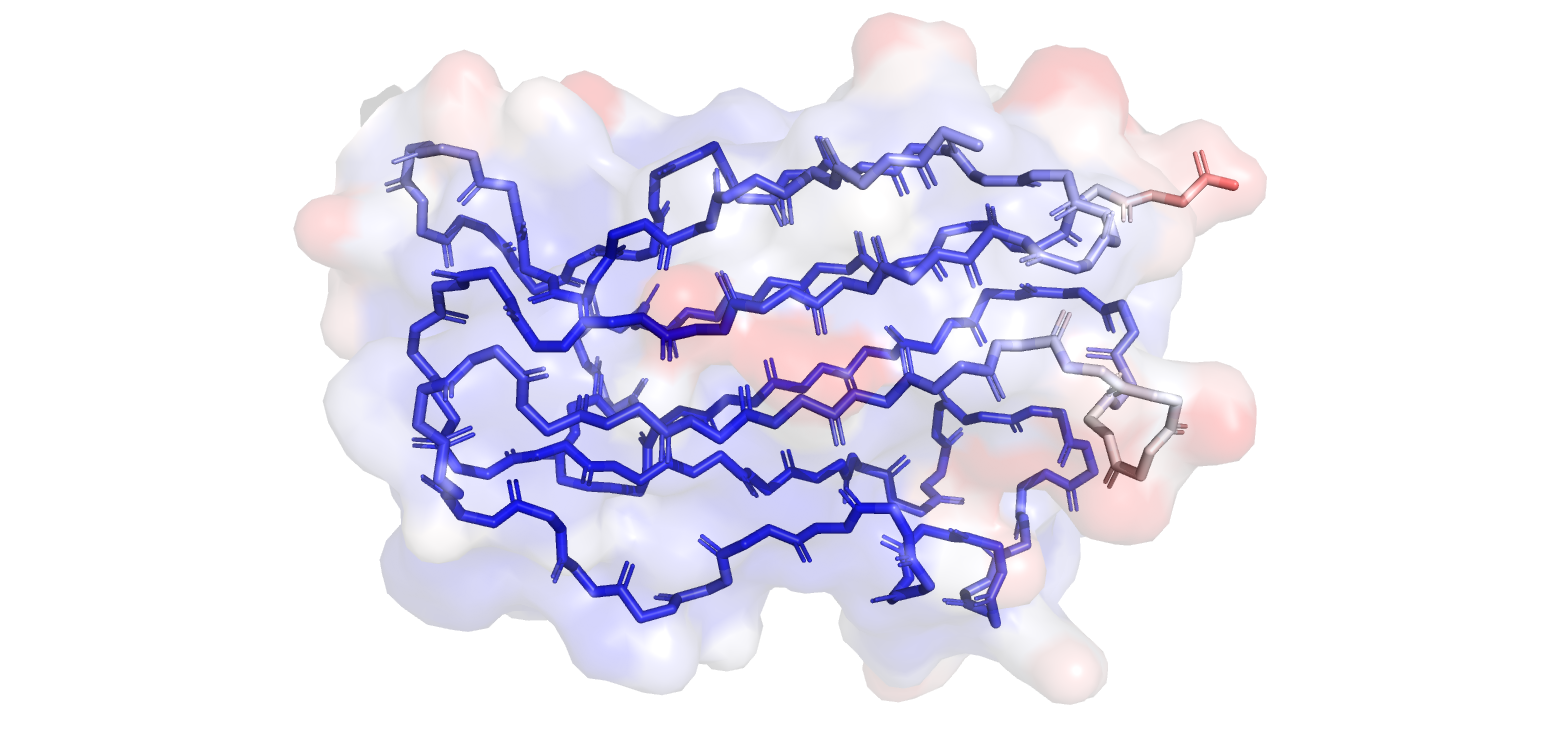
Рисунок 2.1. Покраска остова цепи А структуры 3CVB по B-фактору.
На гифке 2.2 изображен красный остаток GLU104 на различных уровнях подрезки. Можно заметить, что как мы и предполагали, красный остаток расположен на поверхности белковой глобулы, и, вероятно, очень подвижен. Также, мы наблюдаем, что чем ближе к остову, тем более синей становится окраска, что говорит о том, что остов сильно менее подвижен. Предположительно, при рассмотрении электронной плотности на разных уровнях подрезки, мы ожидаем увидеть плохое покрытие (так как остаток подвижен и его электронная плотность 'размазывается' по пространству). На гифке 2.2 мы видим, что чем выше уровень подрезки (особенно в красных 'подвижных' обастях), тем тем хуже они покрыты электронной плотностью. Мы также можем заметить, что при увеличении уровня подрезки, оставшиеся 'сгустки' электронной плотности становятся ближе к остову, как и B-фактор становится синее (меньше) к остову. Это говорит о том, что чем подвижнее остаток, тем больше электронная плотность размазана по пространству, и тем меньший уровень подрезки нам нужен, чтобы увидеть более эффективное покрытие молекулы электронной плотностью.
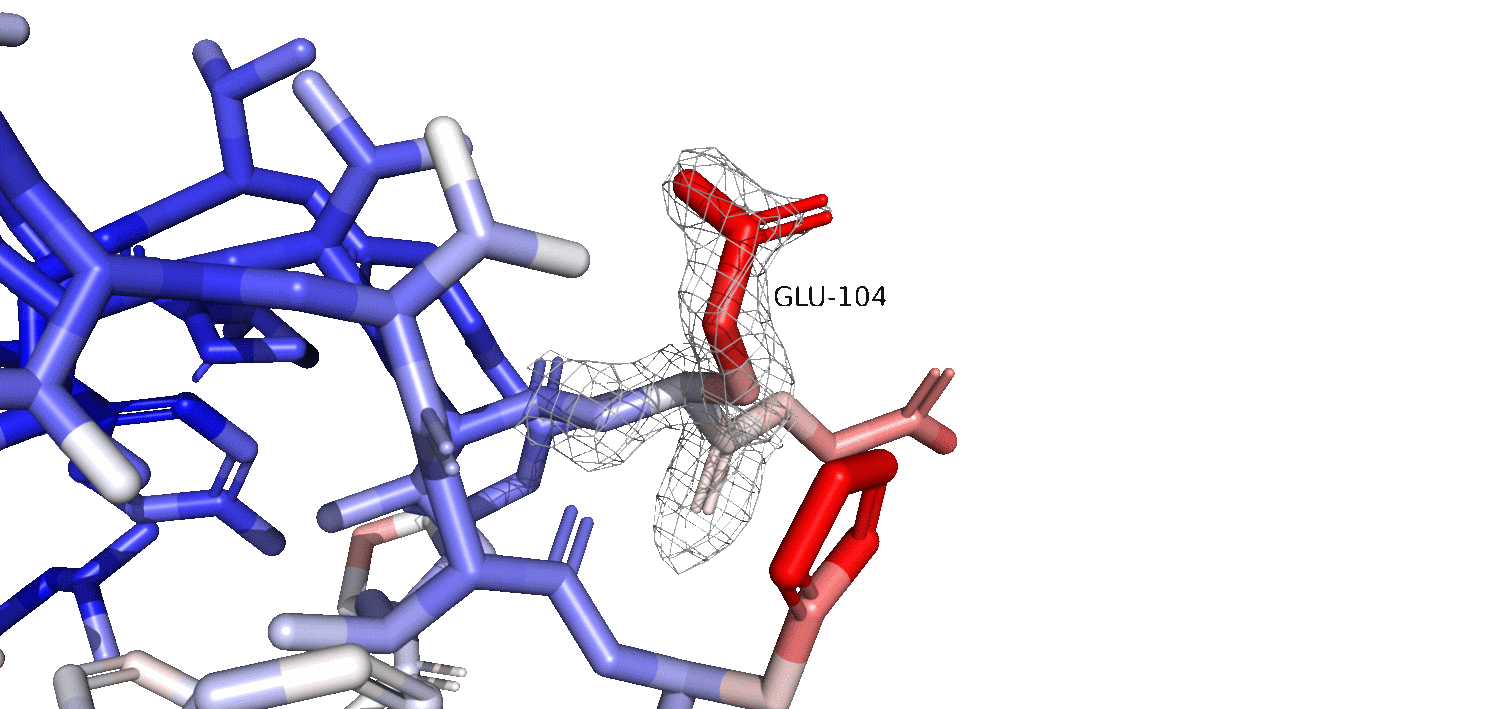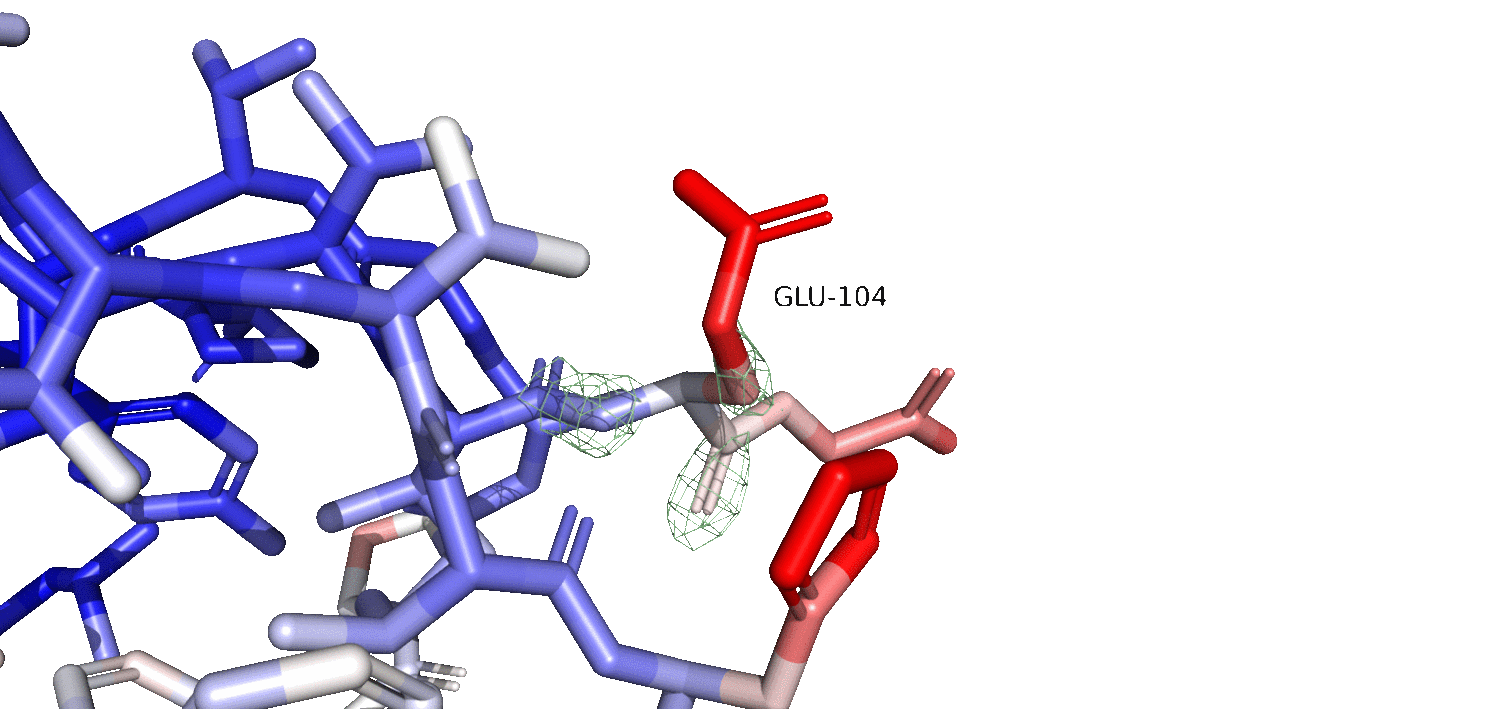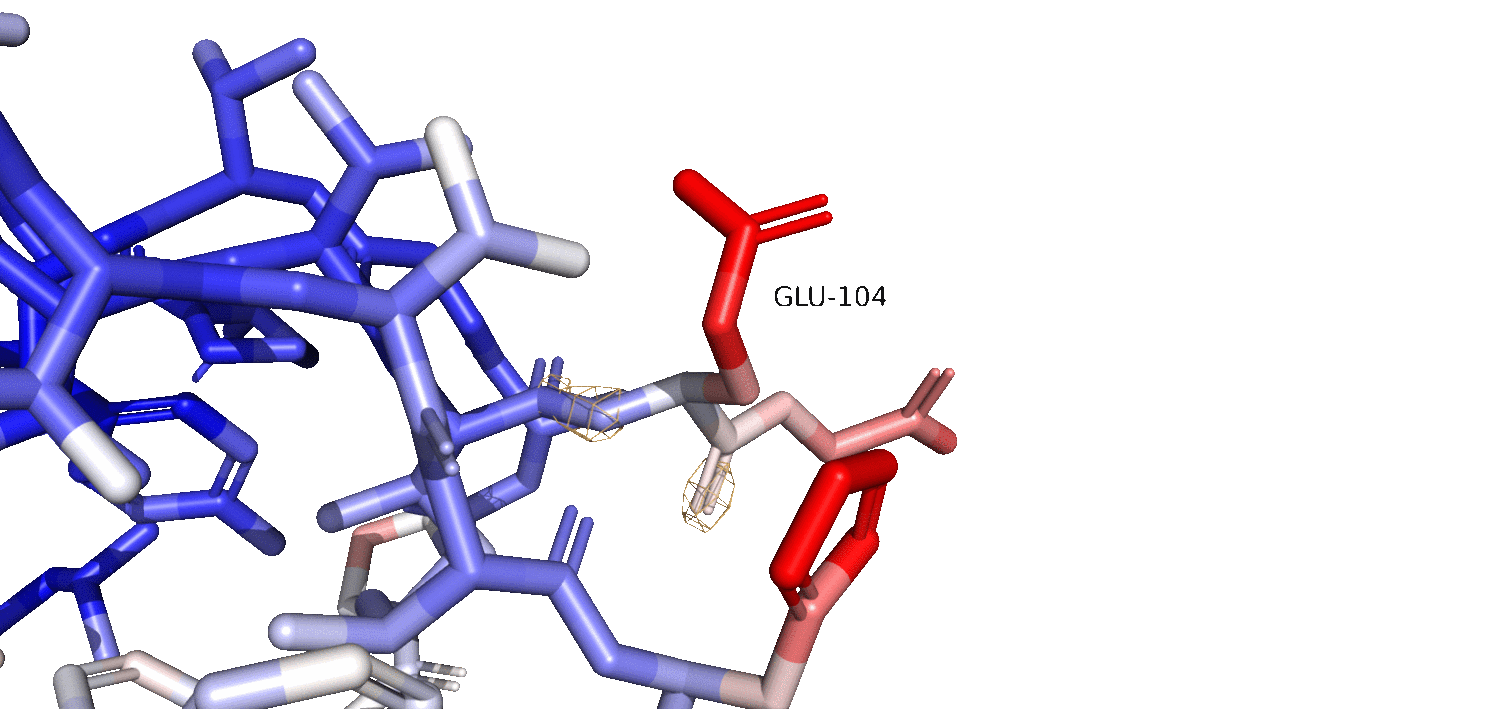
Гифка 2.2. Электронная плотность GLU-104 на 1 (серый), 2 (зеленый) и 3 (желтый) уровнях подрезки. Carve = 1.5.
PDBID: 3CVB
Целью задания являлось посмотреть сколько соседей у каждой молекулы белка в кристалле, а также, как соседи
контактируют друг с другом.
На рисунке 3.1 можно заметить, что кристалл белка имеет упорядоченную регулярную структуру, похожую на галочки (цепь А + цепь В), смотрящие поочередно вверх и вниз, вложенные друг в друга.
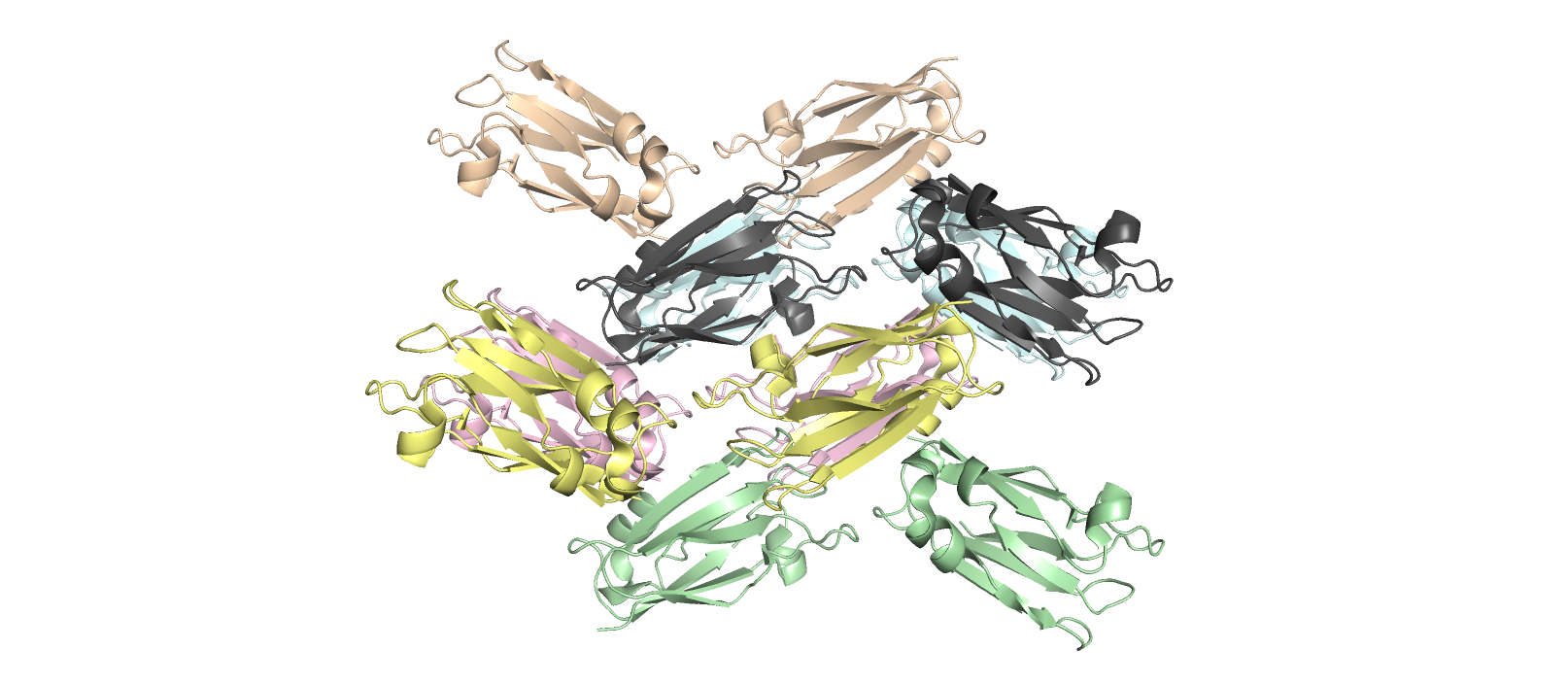
Рисунок 3.1. Регулярная структура кристалла 3CVB.
Так как в данном случае единица белка состоит из двух цепей А и В (покрашены черным), соседями будем также называть единицы белка, состоящие их двух цепей, а не отдельные цепи А и В. Ниже показаны цветные соседи черного исходного белка на рисунках 3.2 и 3.3 (поверхнут на 180 градусов по горизонтали). Таким образом, получается 10 соседей. Однако нужно понимать, что необязательно обе цепи каждой цветной молекулы касаются черной молекулы.
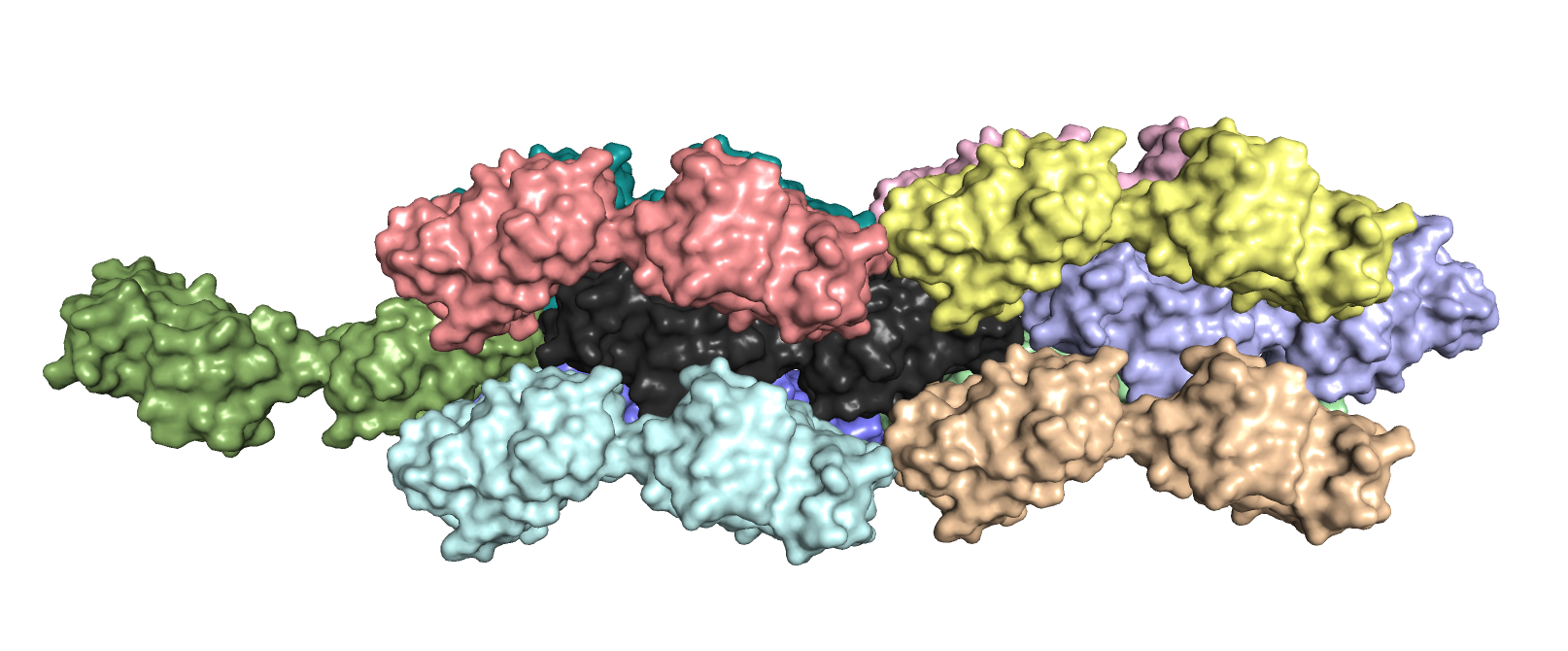
Рисунок 3.2. Соседи белка 3CVB.
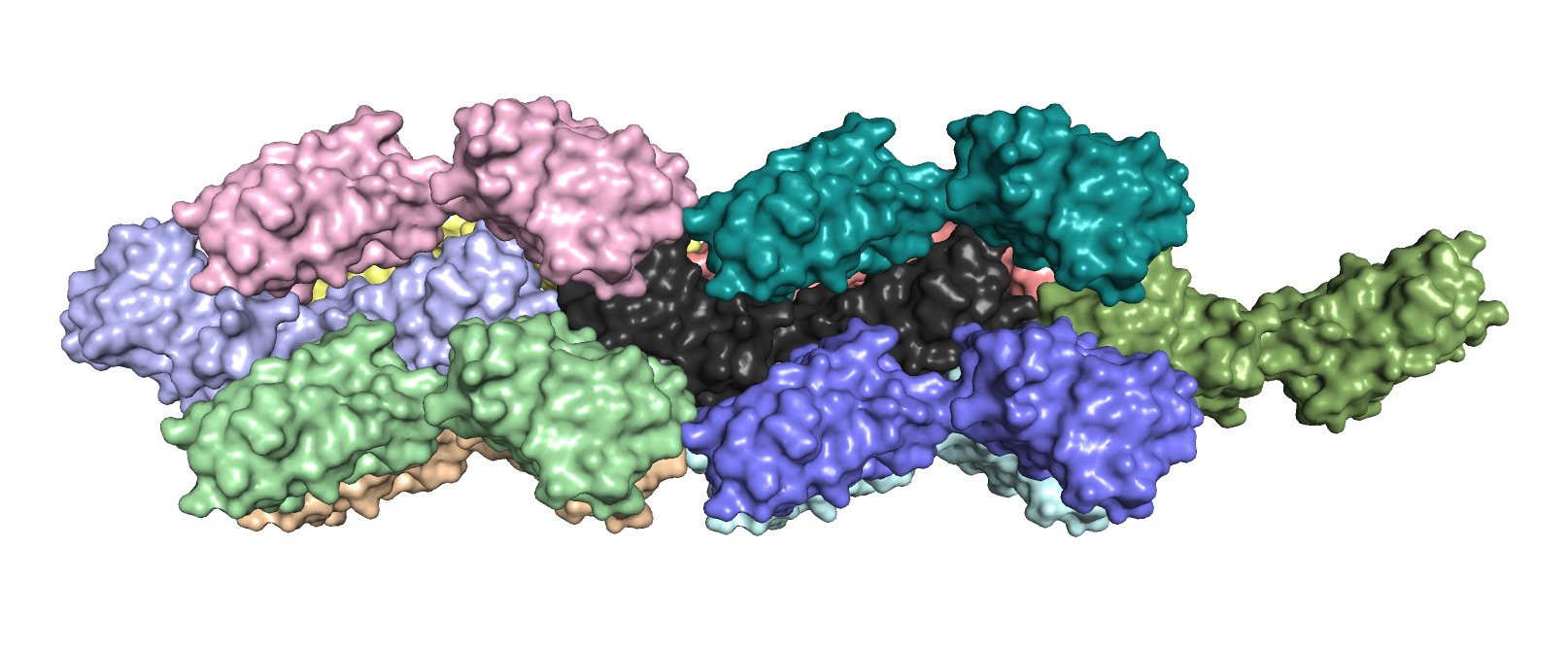
Рисунок 3.3. Соседи белка 3CVB (изображение с противоположной стороны).
Сайт находится на этапе разработки.
© Бруман Софья, 2020