PDBID: 2KLF (ЯМР) и 1JW5 (РСА)
В данном задании я работала с структурами мальтодекстрин-связывающего белка, полученными методом ЯМР и методом РСА.
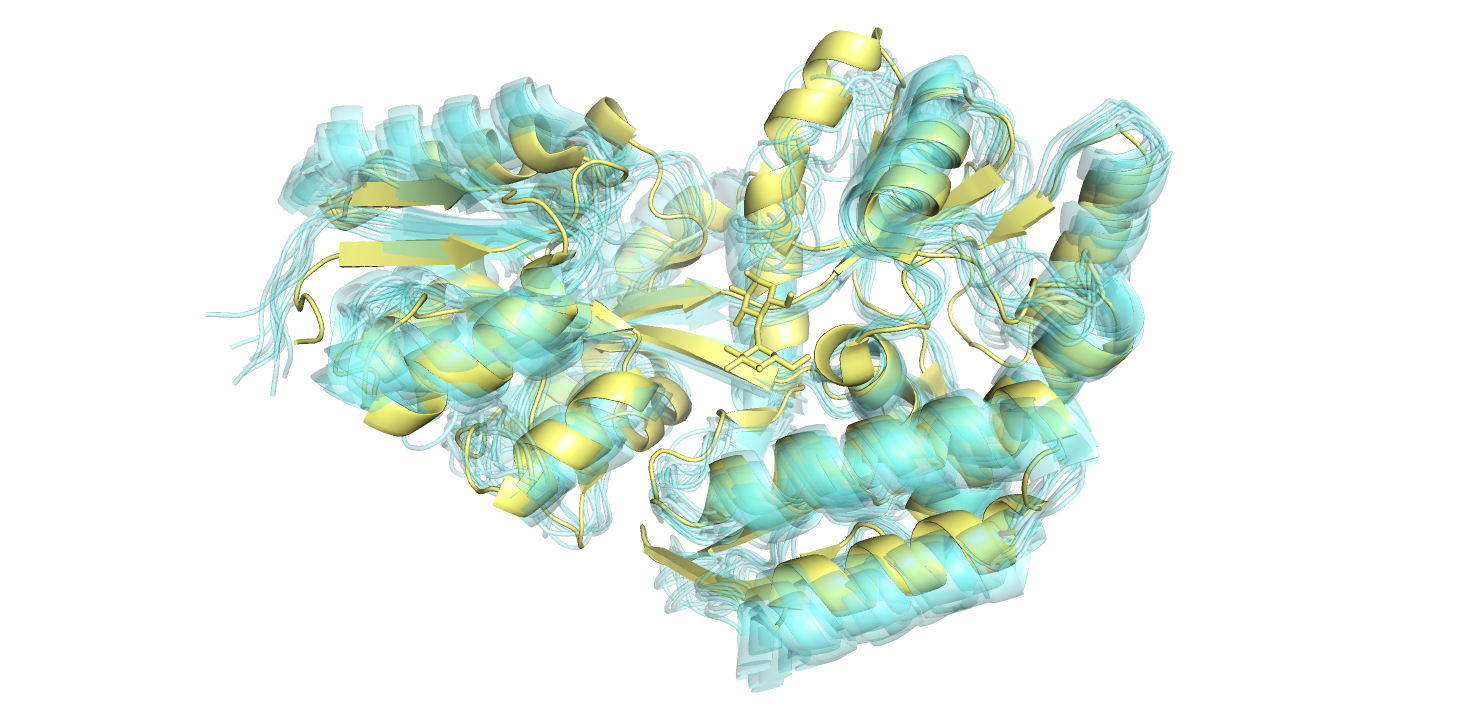
Первая - 2KLF, полученная методом ЯМР, представлена 10ю моделями, вторая - 1JW5, полученная методом РСА имеет разрешение 2 Å. На рисунке 1.1 показаны различия
между моделями.
На рисунке 1.1 модели ЯМР обозначены голубым, а модель РСА - желтым. Сразу нужно отметить, что все молекулы воды (не показаны на рисунке 1.1 для удобства), присутсвующие при наслаивании структур ЯМР и РСА друг на друга, происходят из структуры РСА (при ЯМР вода не детектируется в экмперименте, так как используется специальная тяжелая вода). Отсутствующие остатки у моделей РСА и ЯМР совпадают (и находятся на поверхности белковой глобулы), что говорит о большой подвижности этих остатков у обеих структур и/или, возможно, неправильно предподгототовкой белка к экспериментам.
Можно заметить, что относительно хорошо структуры совпадают в альфа-спиралях (хоть и не везде см. рисунок 1.1), хуже - в бета-листах, плохо - в петлях и концевых остатках на поверхности белковой глобулы. Так происходит, потому что в ряду альфа-спираль - бета-лист - петля
падает стабильность (и увеличивается подвижность) положения остатка в данном окружении вторичной структуры и остатки становится сложнее восстановить из-за размазывания электронной плотности по пространству (при РСА) или же из-за неполноты данных об ограничениях на расстояния и ковалентную связность, получаемых из эксперимента (при получении равновероятных по энергии структур ЯМР).
Также было замечено, что очень много петель в моделях ЯМР соответствуют бета-слоям, и, даже, альфа-спирялям в модели РСА.
Также, нужно отметить, что в модели РСА присутствует лиганд - мальтоза, которого нет в модели ЯМР.

Рисунок 1.1. Наслоение моделей 2KLF (ЯМР) - голубые на модель 1JW5 (РСА) - желтая.
На рисунке 1.1 сверху правее от ценра отлично видно альфа-спираль в РСА-модели, которая совсем не схожа с аналогичными остатками петель ЯМР моделей. Ее я и решила ближе рассмотреть на рисунке 1.2 ниже. Сразу можно заметить наличие атомов водорода в структуре ЯМР. Я попыталась расположить структуры одинаково, ориентируясь на остатки триптофанов и лизина.
В случае структуры РСА (желтая) хорошо просматривается альфа-спираль и водородные связи ее стабилизирующие (хоть и не с идеальной геометрией и длиной (до 3.4 Å)), в то время, как в структуре ЯМР такое ощущение, что геометрия углов и связей структуры весьма хаотична: нет стабилизирующих водородных связей и остатки ориентированы
друг относительно друга совершенно иначе и энергетически не выгодно. Аналогичная ситуация наблюдалась с бета-тяжами в структуре РСА.
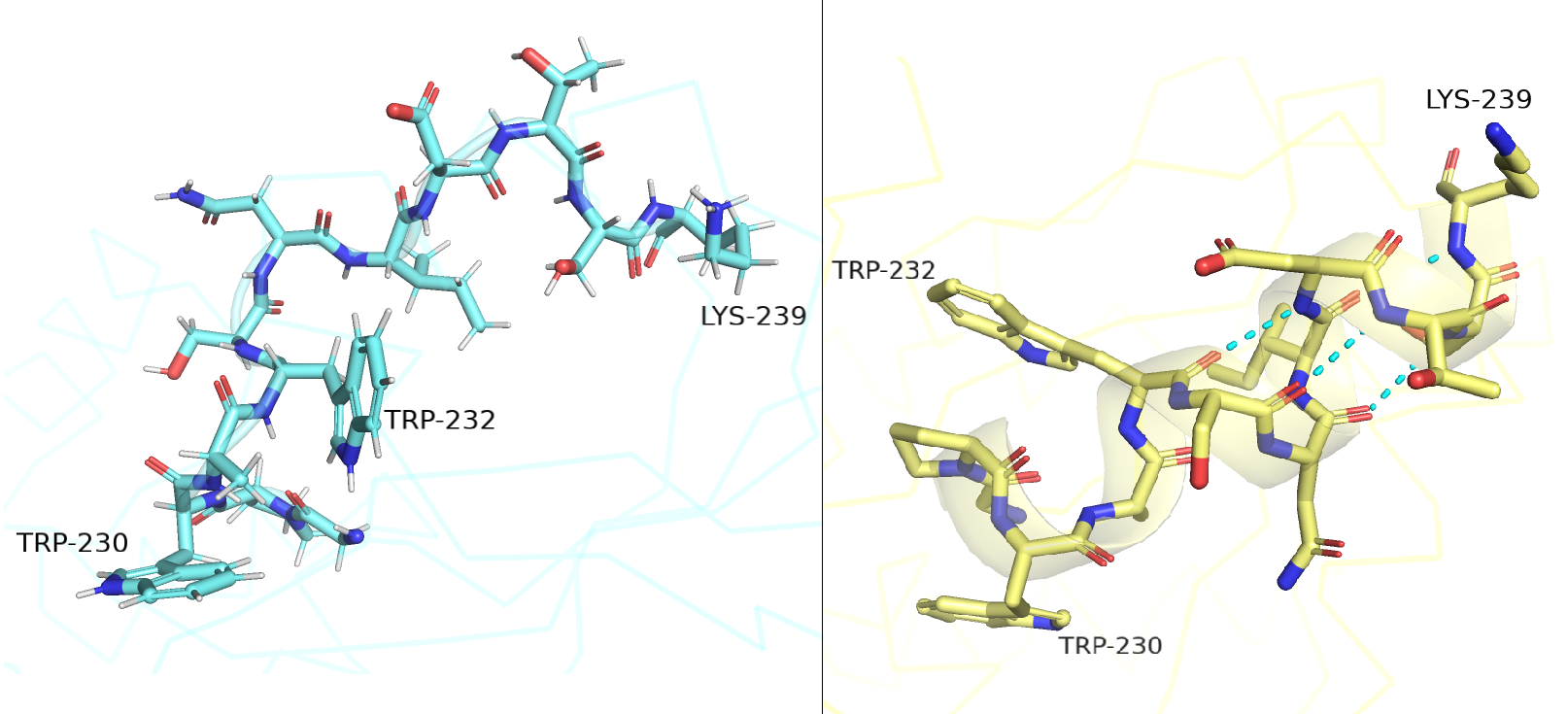
Рисунок 1.2. Остатки с 228 по 238 модели 2KLF (ЯМР) - голубые и модели 1JW5 (РСА) - желтые.
В целом, основная проблема структуры, полученной ЯМР в том, что из-за некоторой хаотичности структуры и неоднозначного расположения остатков и химических групп в пространстве, могут 'образовываться' новые менее стабильные (в сравнении с РСА) состояния, которые искажают понимание структуры, как, например, на рисунке 1.3 ниже (также, можно заметить явную ошибку интерпретации: слева у голубой структуры ЯМР у остовного атома азота GLY-174 есть водород, у которого есть связь с кислородом - авторы, видимо, не смотрели на структуру глазами; мы будем считать, что кислорода там нет и что чисто гипотетически там возможно образование водородной связи). Понятно, что желтая структура РСА гораздо более стабильно исходя, как минимум, из одинаковых, близких к идеальной, длин связей.
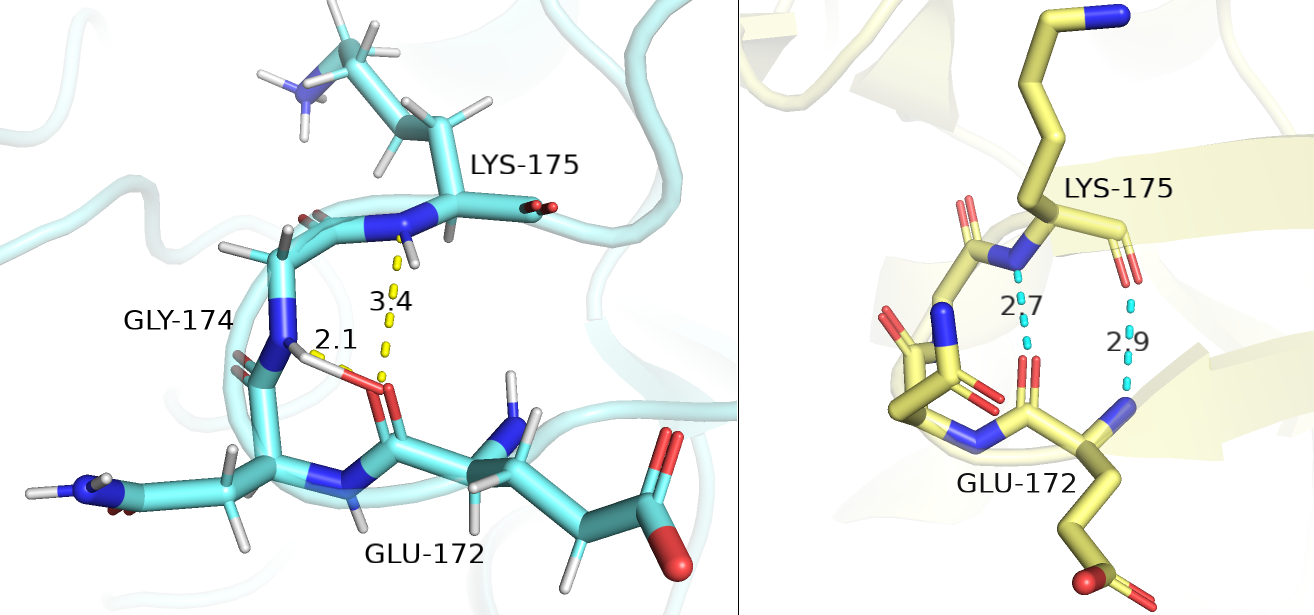
Рисунок 1.3. Остатки с 172 по 175 модели 2KLF (ЯМР) - голубые и модели 1JW5 (РСА) - желтые.
PDBID: 2KLF (ЯМР) и 1JW5 (РСА)
Как мы уже заметили выше, остатки модели РСА совпадают по выравниванию и количеству с остатками моделей ЯМР.
В этом задании было интересно построить график зависимости величины B-фактора для структуры РСА от величины RMSF для структур ЯМР того же белка. Ниже на рисунке 2.1 приведен график этой зависимости. По виду графика можно предположить о линейной зависимости
средних значений В-фактора от RMSF - чем больше значение B-фактора, тем больше значение RMSF (то есть подвижность атомов сказывается на значении RMSF и неполнота данных появляется не только из-за шума). Нужно отметить, что остатки с большим RMSF по большей части имеют В-фактор между 20 и 35, что говорит о том, что неполнота данных ЯМР, из-за которой растет RMSF, в данном случае, может быть частично вызвана шумом в данных и неидеальностью эксперимента.
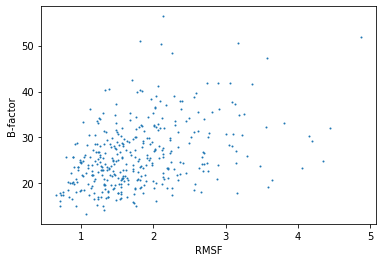
Рисунок 2.1. График зависимости величины B-фактора для структуры РСА от величины RMSF для структур ЯМР того же белка.
PDBID: 2KLF (ЯМР) и 1JW5 (РСА)
В этом задании было интересно сравнить водородные связи в различным местах белка.
Первая водородная связь — в бета-листе в ядре белка между остатками GLY-265 и ILE-60. Ниже на рисунке 3.1 изображена водородная связь между данными остатками структуры РСА (желтая) и структуры ЯМР (голубая). Можно заметить, что все 10 моделей ЯМР имеют на глаз хорошую сходимость и практически совпадают со структурой РСА для данных остатков.
Таким образом, водородная связь сохраняется для всех моделей ЯМР между данными остатками (направления азота и кислорода и длина связи остаются подходящими).
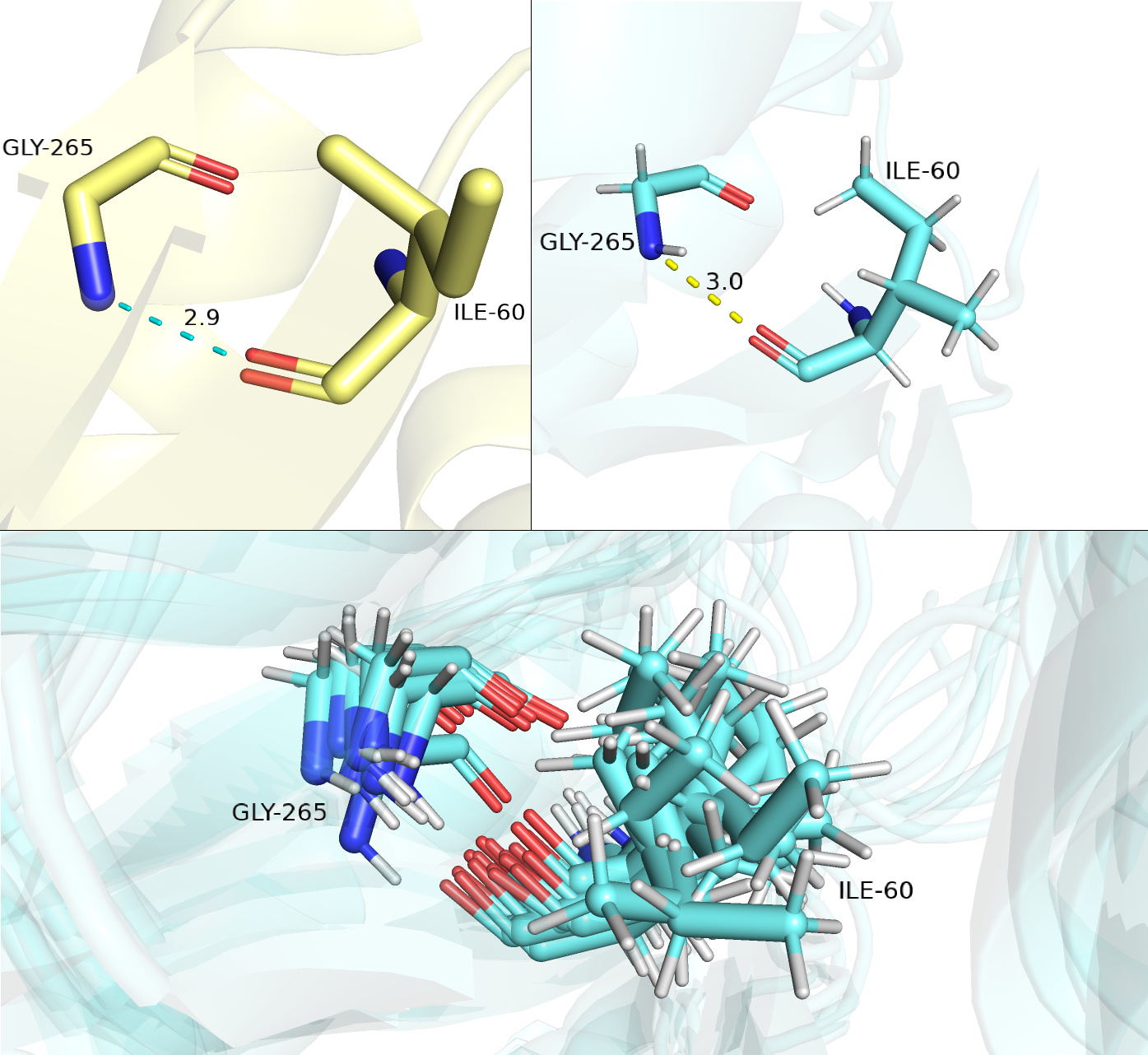
Рисунок 3.1. Водородная связь между остатками GLY-265 и ILE-60 в структурах РСА (желтая) и ЯМР (голубые).
Вторая водородная связь — между боковыми цепями ASN-227 из бета-листа и
TRP-230 из альфа-спирали. Ниже на рисунке 3.2 изображена водородная связь между данными остатками структуры РСА (желтая) и структуры ЯМР (голубая). Мы можем заметить, что оба остатка в голубой ЯМР
структуре ориентированы иначе, чем в желтой РСА структуре - донор и акцептор отвернуты друг от друга, длина связи говорит об отсутствии каких-либо взаимодействий меджу данными атомами (такая ситуация наблюдается у всех ЯМР моделей). Дело в том, что если смотреть на структру ЯМР, то мы не увидим вообще альфа-спирали в том месте, где находится остаток триптофана.
Авторы структуры ЯМР посчитали, что там находися просто петля видимо из-за неполноты данных этого региона, вызванных шумом или большой подвижностью. Также, если посмотреть на параметры Ramachandran outliers и Sidechain outliers для структуры РСА и ЯМР, то для РСА значения будут 0,8% и 3,8% соответственно, что сильно меньше значений для структуры ЯМР - 9% и 28,1% соответственно.
Поэтому в данном случае я больше склонна доверять структуре РСА в целом.
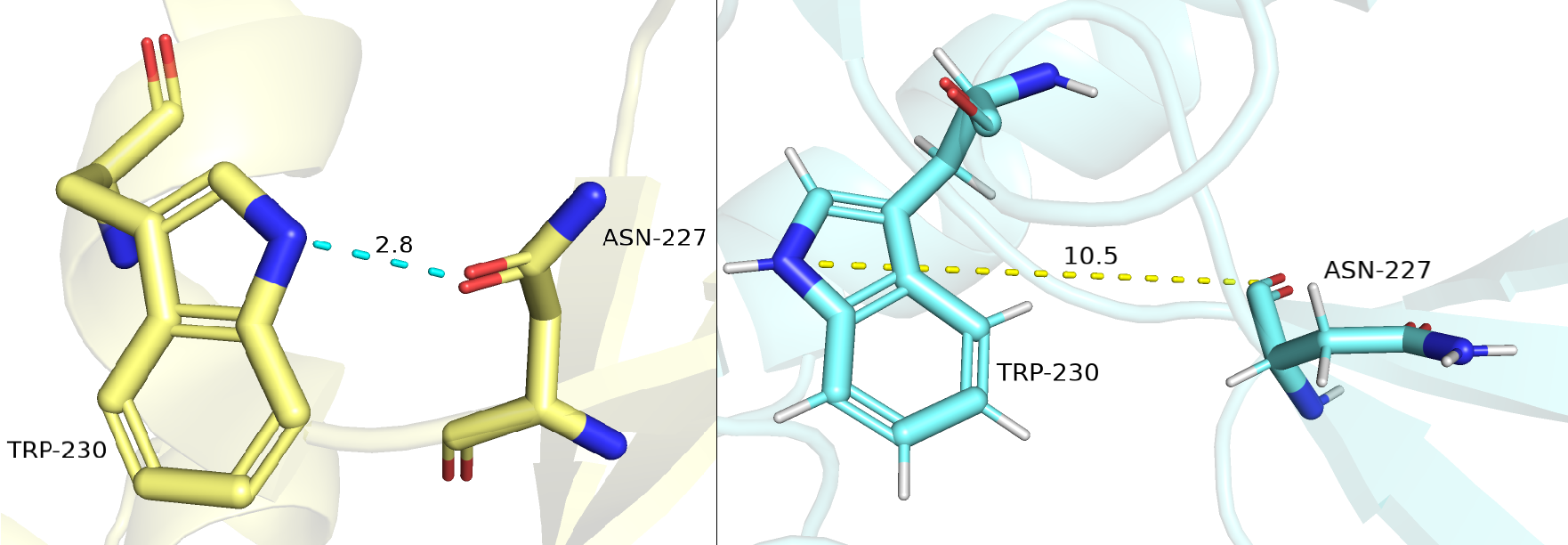
Рисунок 3.2. Водородная связь между остатками ASN-227 и TRP-230 в структурах РСА (желтая) и ЯМР (голубые).
Наконец третья связь между боковой цепью ASN-267 и остовной частью ASP-55. Ниже на рисунке 3.3 изображена водородная связь между данными остатками структуры РСА (желтая) и структуры ЯМР (голубая).
Можно заметить, что хоть ASN-267 ориентирован в структуре РСА так же, как в структуре ЯМР, остаток ASP-55 развернут в структуре ЯМР по сравнению с структурой РСА: боковая группа остатка разворачивается на примерно 90 градусов по горизонтальной оси в сторону от наблюдателя, а соответственно, остовной кислород, образующий водородную связь, поворачивается
к наблюдателю, тем самым делая невозможным образование водородной связи - так происходит в 50% моделей ЯМР. В остальных 50% происходит ровно наоборот и остовной кислород поворачивается в сторону от наблюдателя, однако образование водородной связи все равно невозможно.
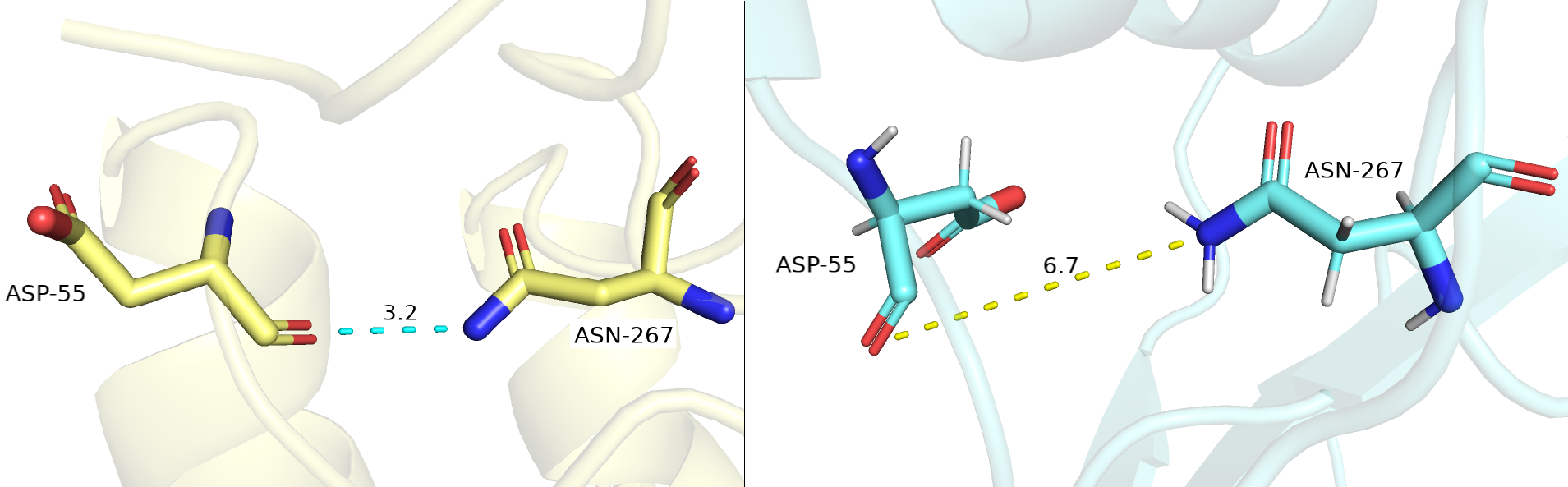
Рисунок 3.3. Водородная связь между остатками ASN-267 и ASP-55 в структурах РСА (желтая) и ЯМР (голубые).
Ниже приведена сравнительная таблица для каждого из трех случаев водородной связи.
| Номер водородной связи | Расстояние в РСА, Å | Процент присутствия в ЯМР | Минимальное расстояние в ЯМР, Å | Максимальное расстояние в ЯМР, Å | Медианное расстояние в ЯМР, Å |
|---|---|---|---|---|---|
| 1 | 2,9 | 100 | 2,40 | 3,1 | 2,7 |
| 2 | 2,8 | 0 | 7,2 | 11,4 | 10,1 |
| 3 | 3,2 | 0 | 5,1 | 11 | 7,95 |
Сайт находится на этапе разработки.
© Бруман Софья, 2020