PDBID: 5REB
В данном задании была предпринята попытка получить двухмерную диаграмму взаимодействия с помощью сервиса Poseview на сайте Proteins.Plus для структуры 5REB с лигандом T0Y_A_404.
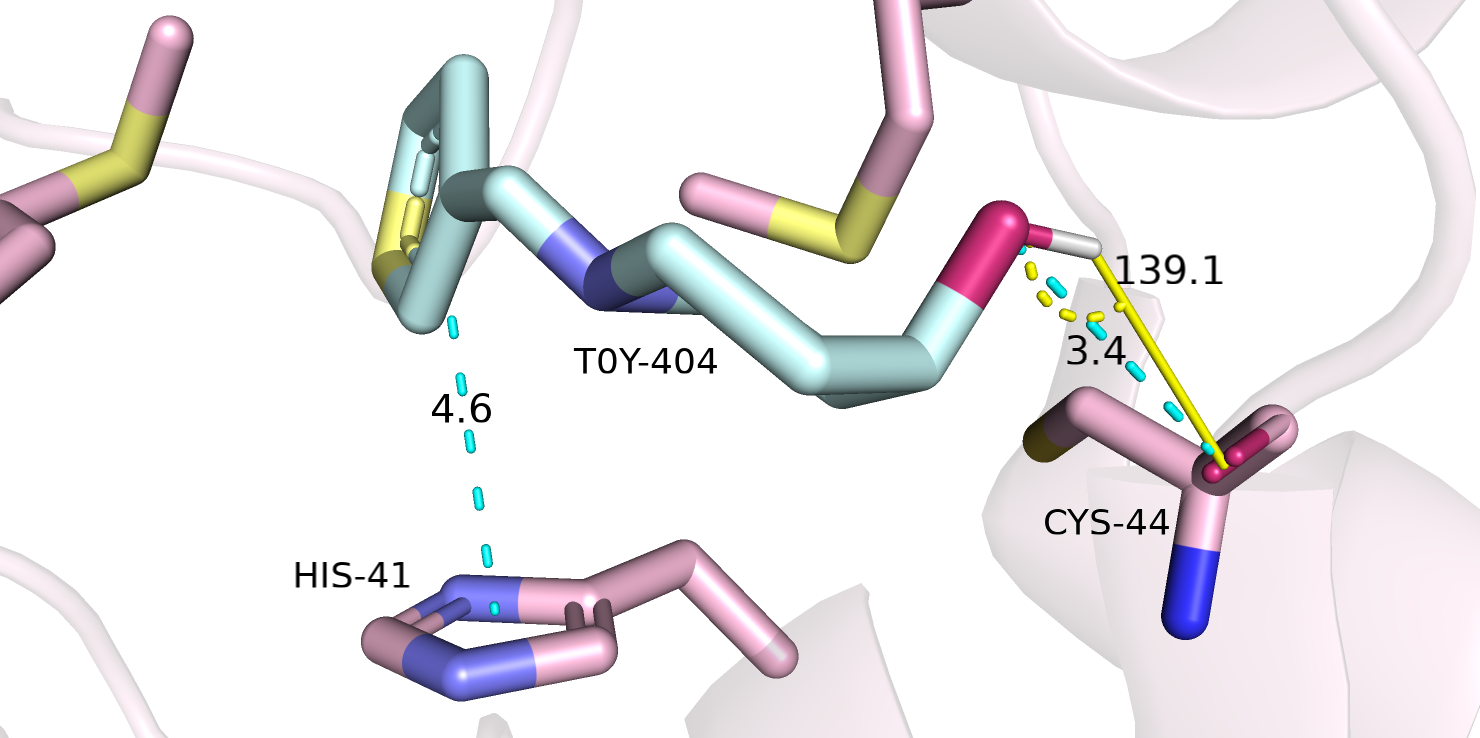
Однако, никаких взаимодейтсвий программа не нашла, что достаточно неудивительно. В первом практикуме мной были обнаружены (см. рисунок 1) два взаимодействия: Т-стэкинг между имидазольным кольцом гистидина HIS-41 и тиофеновым кольцом TOY-404, а также
водородная связь между атомом кислорода T0Y-404 и остовным атомом кислорода CYS-44. Сейчас я бы сказала, что достоверно можно говорить только о присутствии Т-стэкинга, так как расстояние между кольцами находится в пределах нормы (4,5 - 5 Å), а также, действительно, тиофеновое кольцо плоское, все атомы sp2-гибридизованные и атомы водорода с частичным положительным зарядом одной ароматической системы направлены к центру другой ароматической системы перпендикулярно плоскости последней. Возможно, такой тип взаимодействий просто не обнаруживается программой адеватно. Что касается водородной связи, сейчас
я не была бы так уверена в ней, так как геометрия совсем не идеальна: даже если учесть, что из-за sp3-гибридизации водород и две электронные пары кислорода TOY-404 находятся в вершинах тетраэдра и угол донор-протон-акцептор получается достаточно неплохим (139,1 градуса), все равно связь здесь маловероятна, так как
кислород CYS-44 ориентирован неблагоприятно - его неподеленные электронные пары лежат в плоскости двойной связи и совсем не смотрят в сторону водорода донора.

Рисунок 1. Отрендеренная картинка протеазы SARS-CoV-2 с лигандом T0Y-404.
AB1: 0021, chain P, pos. 110; AB2: 0080, chain P, pos. 11
В данном задании требовалось выяснить, какой аминоксилотный остаток был смутирован в конкретной позиции конкретной цепи с помощью PyMol Wizard > Mutate на глицин, исходя из аминокислотного окружения данного остатка.
Первая рассматриваемая структура - 0021. Я буду рассматривать взаимодейтсвия именно атомов радикала, так как взаимодействия с остовом будут аналогичными у аминокислотных остатков. Открыв структуру, первое, что мы увидим - это то, что все атомы остатков, которые потенциально могли бы привести к образованию водородной связи или других взаимодействий, находятся достаточно далеко от остовных атомов искомой аминокислоты - атомы, находящиеся на подходящем расстоянии это кислород остова THR-92 и карбоксильная группа ASP-27D. Из всего вышеперечисленного я сделала вывод, что радикал искомого остатка должен быть достаточно длинным, гибким и иметь на конце атомы, которые могли бы выступить донорами/акцепторами водородной связи.
Под описание подошли ARG, LYS, GLU, GLN. Рассмотрим сначала GLU и GLN: они потенциально могли бы взаимодействовать не с упомянутыми группами, а с остовным кислородом HIS-111, однако при рассмотрении ротамеров для GLU (рисунок 2.1) и GLN я получила количества ротамеров - по 14 для каждого, и достаточно большие значения strain для самых оптимальных - 12,98 (Rotamer 13/14; 1,2%) и 15,73 (Rotamer 9/14; 3,2%) соответственно. Нужно отметить, что во всех ротамерах, кроме одного (будет обсуждаться далее) расположение глутамата было невыгодным, а в самом оптимальном (из плохих) угол водородной связи между OE2-кислородом и, собственно, остовным кислородом HIS-111 был невозможным для образования водородной связи. У GLU был один неплохой ротамер, который как раз таки взаимодействовал с карбоксильной группой ASP-27D (Rotamer 3/14; 11,7%) - выступал донором протона для водородной связи, однако strain этого ротамера составил 13,98, что еще больше, чем у других ротамеров, зато представленность больше.
В случае GLN расположение, ситуация и параметры аналогичные. Конечно, если бы мы выбирали из ротамеров GLU, мы бы выбрали 3/14, а если бы из ротамеров GLN - 9/14 (3,2%). Из них двух мы выбрали бы глутамат!
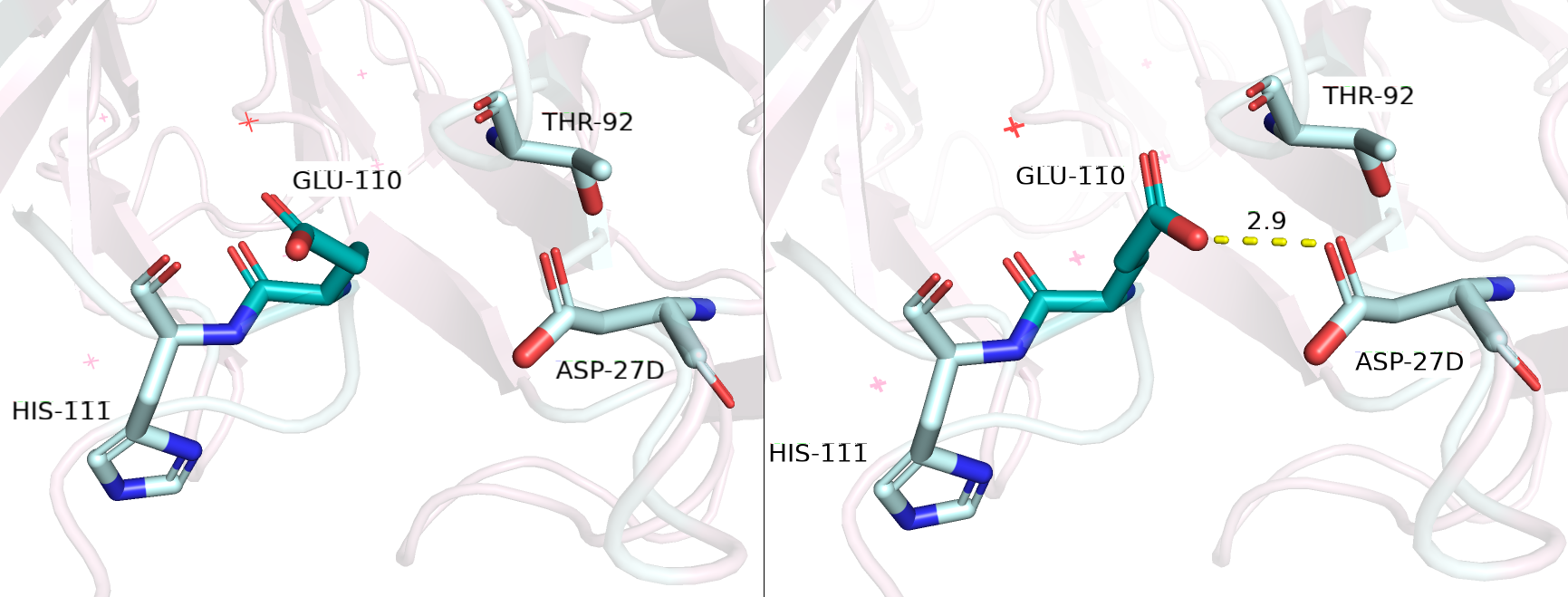
Рисунок 2.1. Мутация GLY-110 на GLU-110 (отмечено темно-бирюзовым). Слева - rotamer 13/14, справа - rotamer 3/14.
Далее, я решила рассматривать остатки ARG и LYS. Рассмотрим сначала ARG. Количество ротамеров у аргинина - 21. Из них есть два, подходящих под данную ситуацию - rotamer 5/21 (strain 10,20; 6,8%) и rotamer 1/21 (strain 10,26; 10,1%) (см. рисунок 2.2). Нужно отметить, что strain у обоих ротамеров меньше, чем у вышеупоминавшихся других остатков, а представленность у наиболее удачного ротамера примерно такая же. Итак, в случае ротамера 5/21, NE азот ARG-110 образует водородную связь с OD1 кислородом карбоксильной группы ASP-27D, однако водородная связь кажется не очень успешной, так как расстояние в 3,5 Å, а также далеко не идеальный угол в 130,5 градусов (не показан на рисунке) являются неоптимальными параметрами для образования водородной связи, хотя нужно отметить, что со стороны кислорода карбоксильной группы ASP-27D неподеленная электронная пара лежит в плоскости двойной связи и смотрит прямо на NE азот ARG-110. Что касается ротамера 1/21, NH1 гуанидиновой группы ARG-110 образует водородную связь с остовным кислородом THR-92: на картинке видно, что угол практически идеальный, а вот расстояние опять же 3,4 Å, что не идеально. Таким образом, аргинин достаточно хорошо подходит под данное окружение, но есть 'ненаучное' ощущение, что он образует одну водородную связь радикалом так или иначе, зачем для этого целая гуанидиновая группа, если есть LYS, в котором ничего лишнего, а водородная связь будет образовываться, возможно даже с лучшими параметрами аналогично ротамеру 1/21. Но если бы мы выбирали из ротамеров ARG, мы бы, конечно, выбрали 1/21.
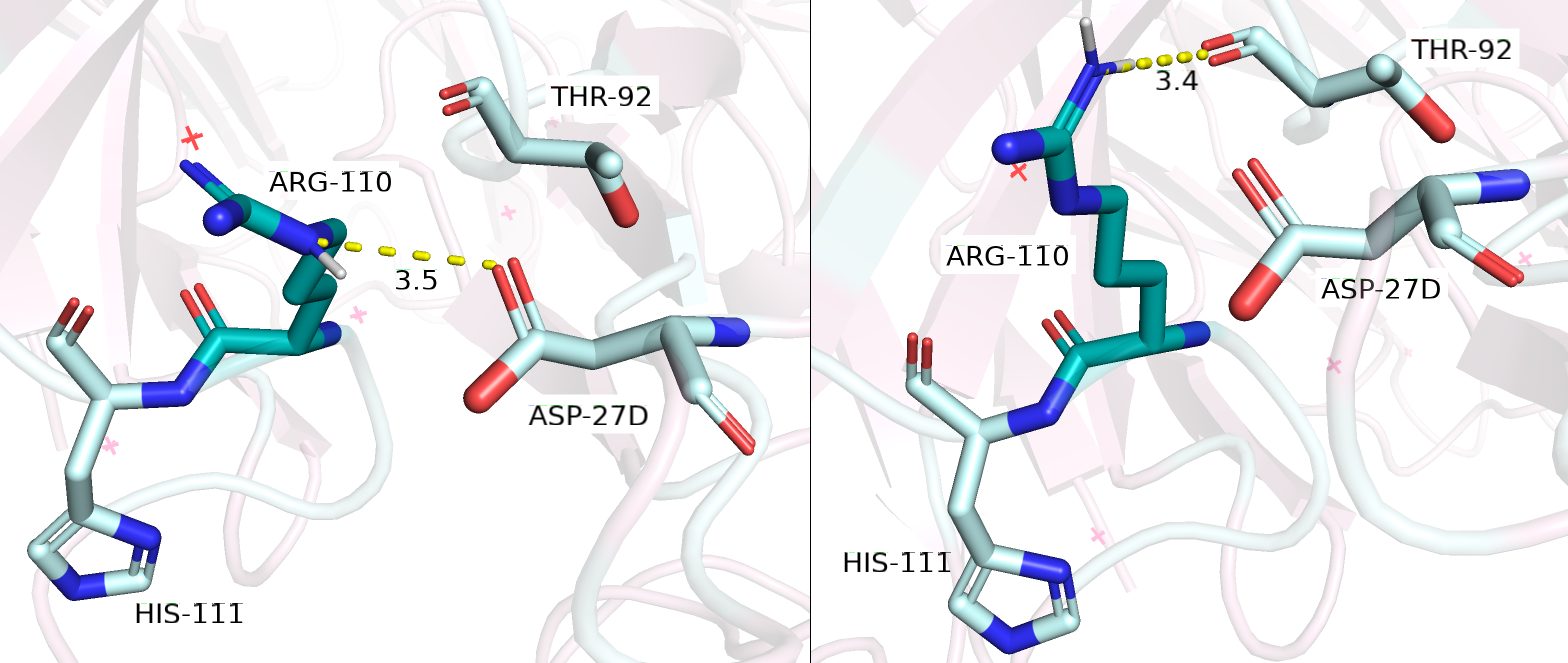
Рисунок 2.2. Мутация GLY-110 на ARG-110 (отмечено темно-бирюзовым). Слева - rotamer 5/21, справа - rotamer 1/21.
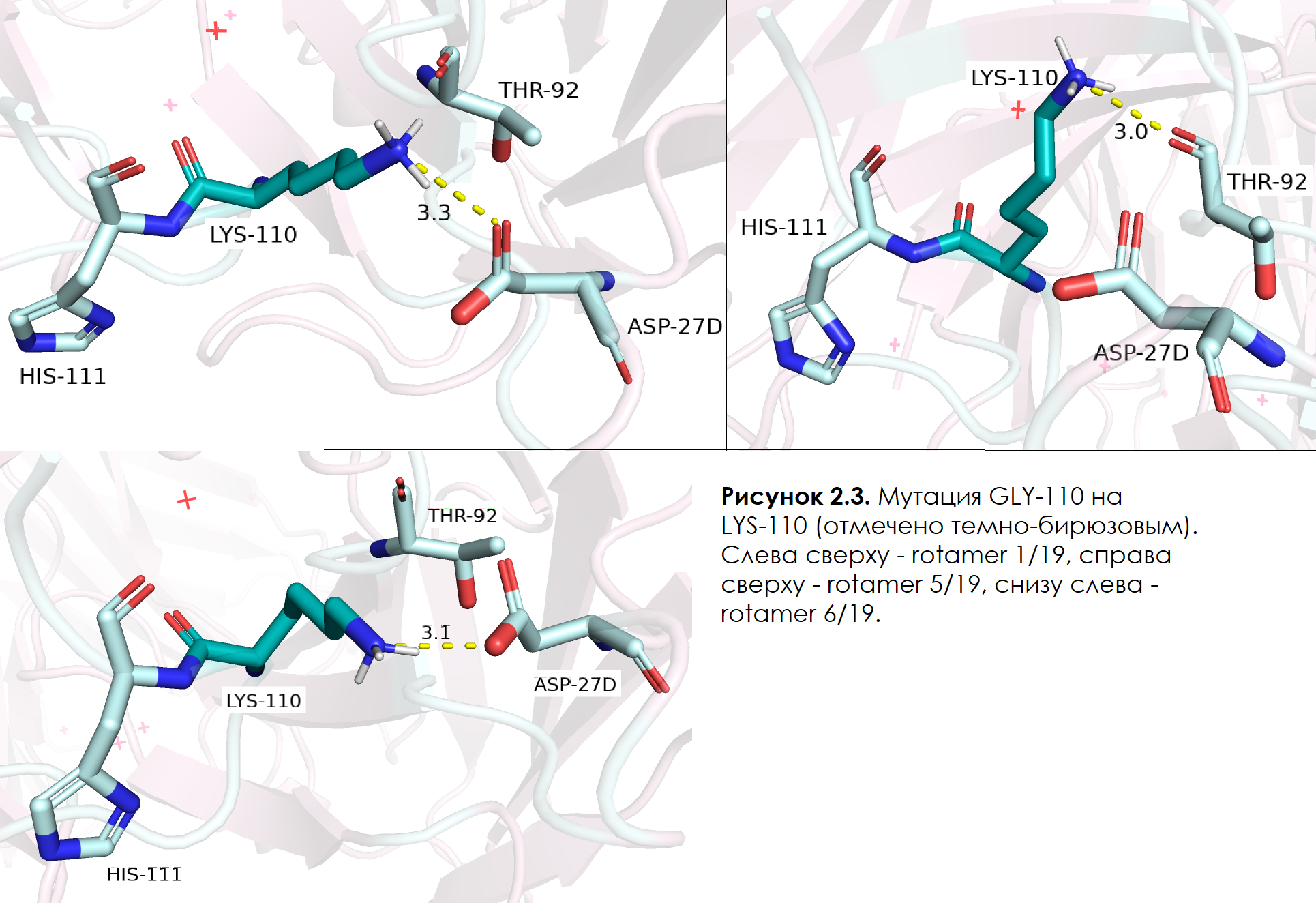
Далее я решила рассмотреть ротамеры LYS. Всего ротамеров у лизина 19. Наиболее оптимальных с низким strain - 3: 1/19 (22,9%, strain = 11,72), 5/19 (5,6%, strain = 5,6%) и 6/19 (4,9%, strain = 11,45) (см. рисунок 2.3). Нужно отметить, что самый оптимальный из них (1/19) имеет представленность на 10% больше самых оптимальных других остатков, а strain примерно такой же (но все равно меньше, чем у оптимального глутамата). В случае этого ротамера NZ лизина образует водородную связь с OD1 ASP-27D: угол практически идеальный и протон смотрит немного под угом - именно в сторону неподеленной электронной пары кислорода. Честно говоря, другие ротамеры, представленные на рисунке ниже, имеют также неплохие углы и хорошие расстояния между донором и акцептором водородной связи. Однако, по параметрам представленности ротамера и strain, 1/19 ротамер LYS побеждает среди и ротамеров лизина, и ротамеров других аминоксилотных остатков.
Вторая рассматриваемая структура - 0080. Посмотрев на окружение исследуемого остатка, я заметила остатки TRP-50, который смотрел в сторону остатка своим азотом NE1, а также остатки TRP-47 и PHE-96. Также, я заметила, что между исследуемым остатком и названными выше нет ни одной молекулы воды, что намекнуло мне на неполярную природу моего остатка. Однако, меня все же смущал NE1 азот, смотрящий в сторону моего остатка и я решила, что там также могло бы быть что-то короткое с акцептором протона на конце радикала: под описание подошли, а также имели небольшой strain и большую представленность ротамера следующие остатки. Подошел 1/8 ротамер ASP (strain = 11,30; 41,3%), однако угол между донором протона NE1 TRP-50 и акцептором протона (96,8 градусов) и рассояние между ними (2,4 Å) были неоптимальными для образования водородной связи (см. рисунок 2.4 слева). Также, подошел ротамер 1/8 HIS (strain = 14,41; 36,9%) (см. рисунок 2.4 справа), однако водородная связь могла бы образовываться только если гистидин не протонирован, а так неподеленная электронная пара лежит в плоскости кольца, образование водородной связи даже при хорошем расстоянии в 3,3 Å невозможно из-за плохого угла.
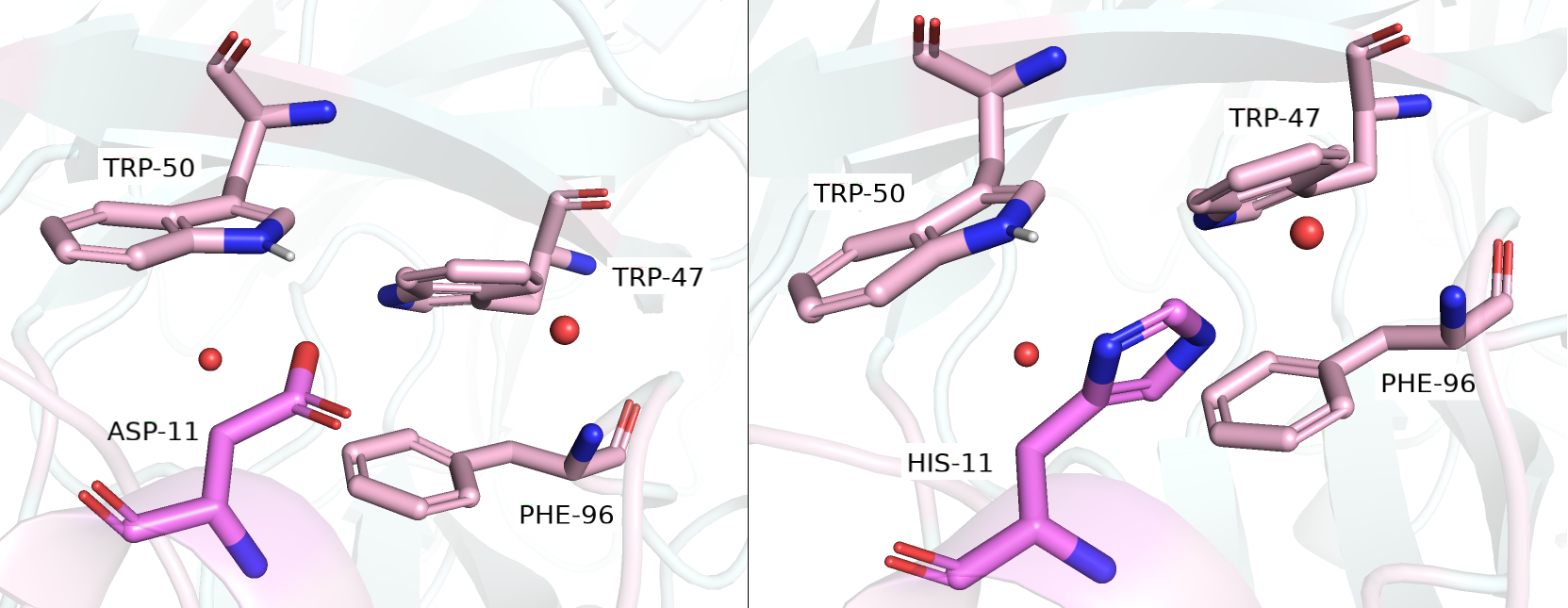
Рисунок 2.4. Мутация GLY-11 на ASP-11 слева и HIS-11 справа (отмечено темно-розовым).
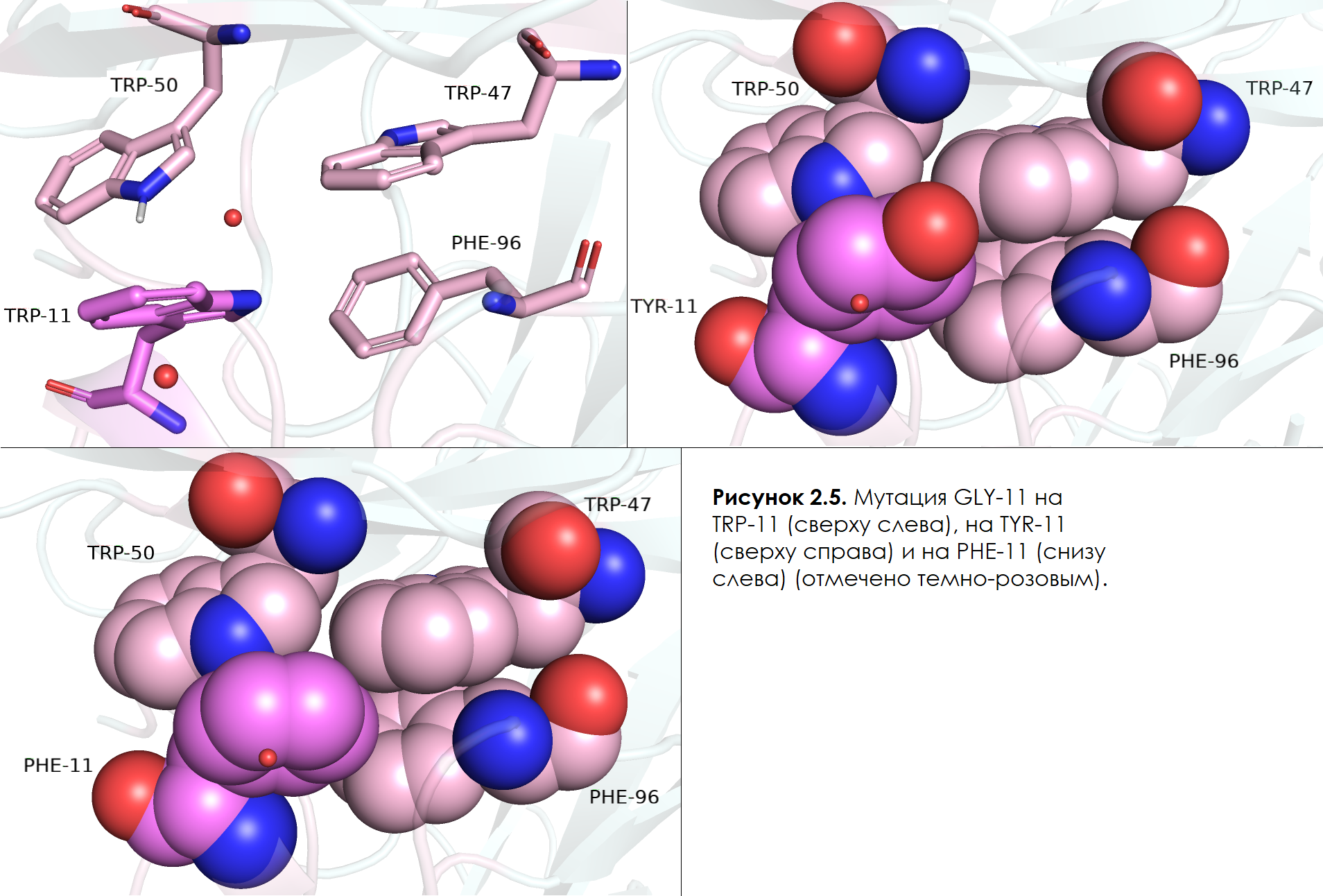
Таким образом, осталось рассмотреть только что-то, имеющее неполярный элемент в радикале, такой, что вода не помещается между TRP-50, TRP-47 и исследуемым остатком. Такими кандидатами стали:
1/9 ротамер TRP (strain = 10,12; 46,8%), 1/4 ротамер TYR (strain = 14,21; 66,9%) и 1/4 ротамер PHE (strain = 21,62; 68,1%) (см. рисунок 2.5). В случае триптофана, не было никакого вклада в гидрофобность, в своем лучшем ротамере, триптофан смотрел в сторону TRP-50 и TRP-47 своим NE1 азотом; хоть у него и наименьший из strainов среди вышеупомянутых остатков, частота встречаемости ротамера на 20% и более меньше, чем у остальных. Поэтому далее рассмотрим TYR: в данном случае, хоть strain и чуть больше, однако частота встречаемости ротамеров на 20% выше; кольцо тирозина отлично вписывается с краю между колец TRP-47 и PHE-96, и не дает воде проникнуть, однако, ему немного мешает кислород. Исходя из этого я решила, что если кислорода не будет, то получится фенилаланин и встречаемость ротамера увеличится, а strain уменьшится. Однако, в случае замены на ротамер 1/4 PHE strain вырос чуть меньше, чем в два раза, а встречаемость ротамера тоже выросла почти на 1,5% и стала 68,1%. Как мне сначала показалось, оптимальным в данной ситуации является тирозин, так как у него высокая частота встречаемости ротамера и небольшой strain, но фактически когда мы заменили на фенилаланин, положение самого кольца не изменилось и непонятно, почему strain вырос настолько. Проанализировав все вышесказанное, я все же решила, что в данной позиции лучше всего был бы 1/4 ротамер PHE , потому что все же кольцо практически никуда не двигается, а вот частота встречаемости ротамера из высокой (от тирозина) выросла еще на почти полтора процента!
Сайт находится на этапе разработки.
© Бруман Софья, 2020