PDBID: 1AMO (biological assembly 1) и 3ES9 (biological assembly 1)
В данном задании было дано 2 PDB ID, один из которых соответствует белку в закрытой конформации, а другой - в открытой. Для обеих конформаций нужно было показать различия и посчитать площадь молекулярной поверхности (MS) и площадь поверхности, доступной растворителю (SAS).
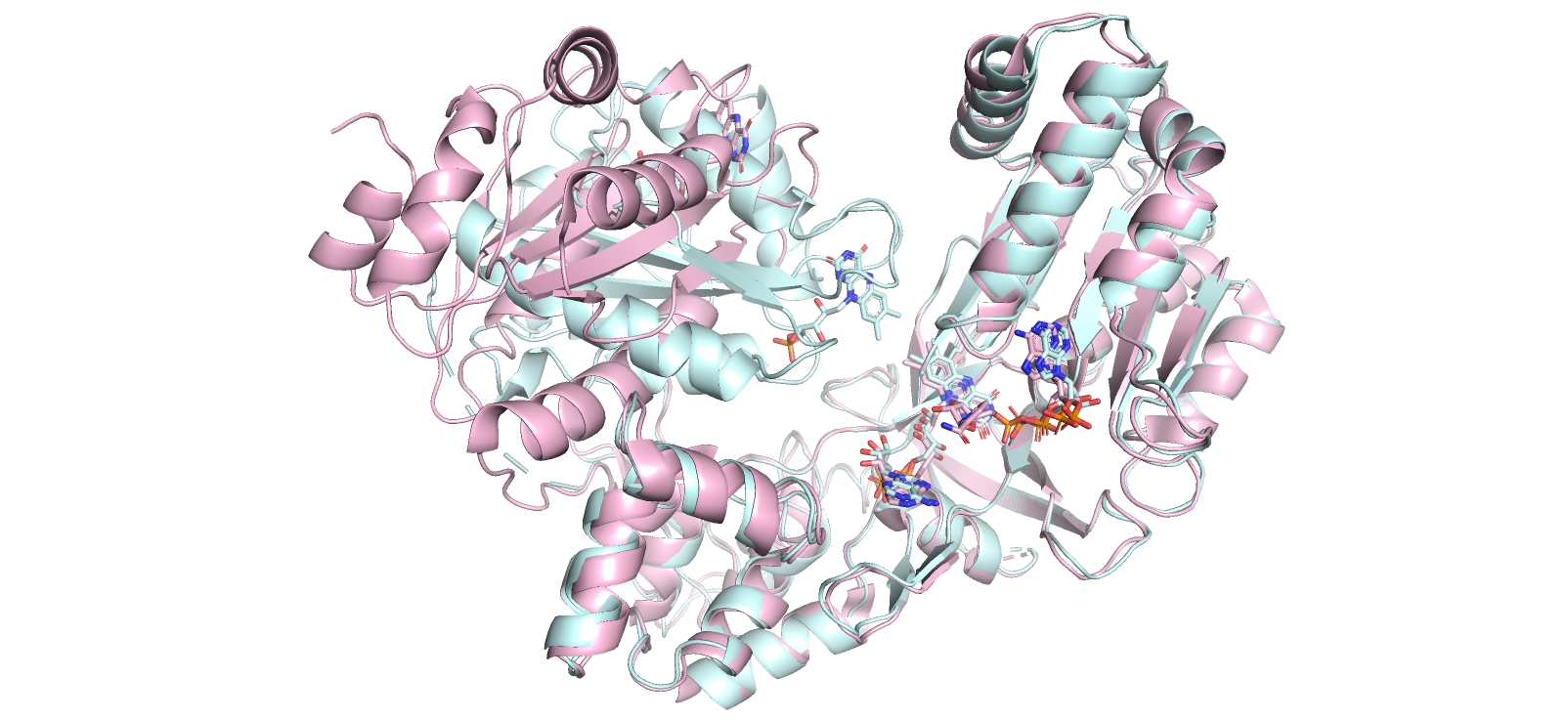
На рисунке 1.1 показано наслоение структур открытой (E3S9 - розовая) и закрытой (1AMO - голубая) конформаций друг на друга.

Рисунок 1.1. Наслоение моделей структур открытой (E3S9 - розовая) и закрытой (1AMO - голубая) конформаций.
При рассмотрении моделей хорошо заметны мелкие отличия, например для остатков 245-247 и 348-350 в голубой структуре, показаны петли, а для розовой - бета-слои (см. рисунок 1.2 слева); а также, для розовой структуры показан лиганд NAP-753 (NADP), который отличается куском от лиганда голубой структуры NAP-752. Вообще, если посмотреть статью (DOI:10.1074/jbc.m101731200) и механизм ферментативной реакции, то можно заметить, что в этом месте для обеих структур должен быть NADPН. Таким образом, отсутствие куска NADPН говорит о не самом лучшем качестве струкуры 1AMO.
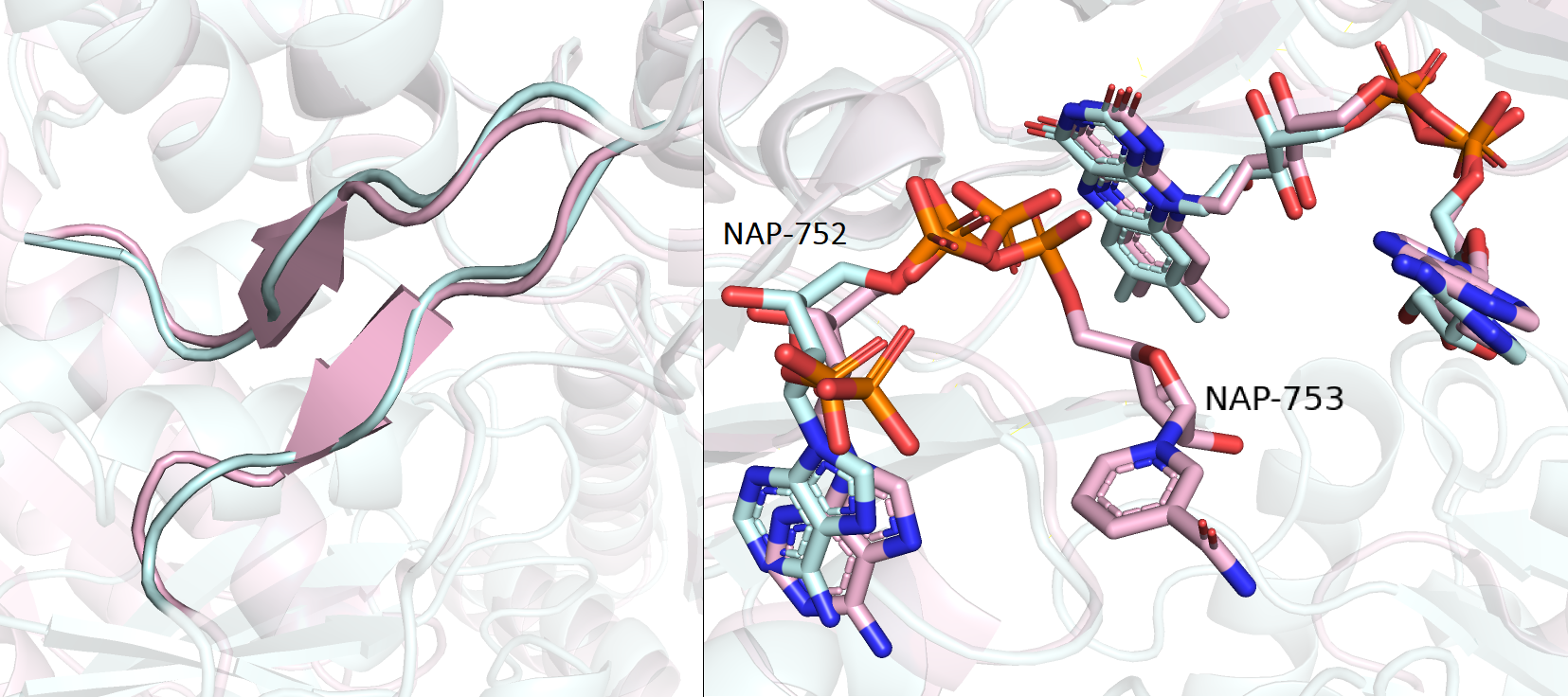
Рисунок 1.2. Наслоение моделей структур открытой (E3S9 - розовая) и закрытой (1AMO - голубая) конформаций.
Также можно заметить бета-тяжи с правой части рисунка 1.1 (остатки 528-534, 626-631, 672-678). Можно заметить, что в открытой (розовой) конформации, они короче и дальше и от центра молекулы и от активного центра (см. рисунок 1.3), а в случае голубой (закрытой) конформации, они как-будто также способствуют закрыванию, как и подвижный 'домен', описанный ниже.
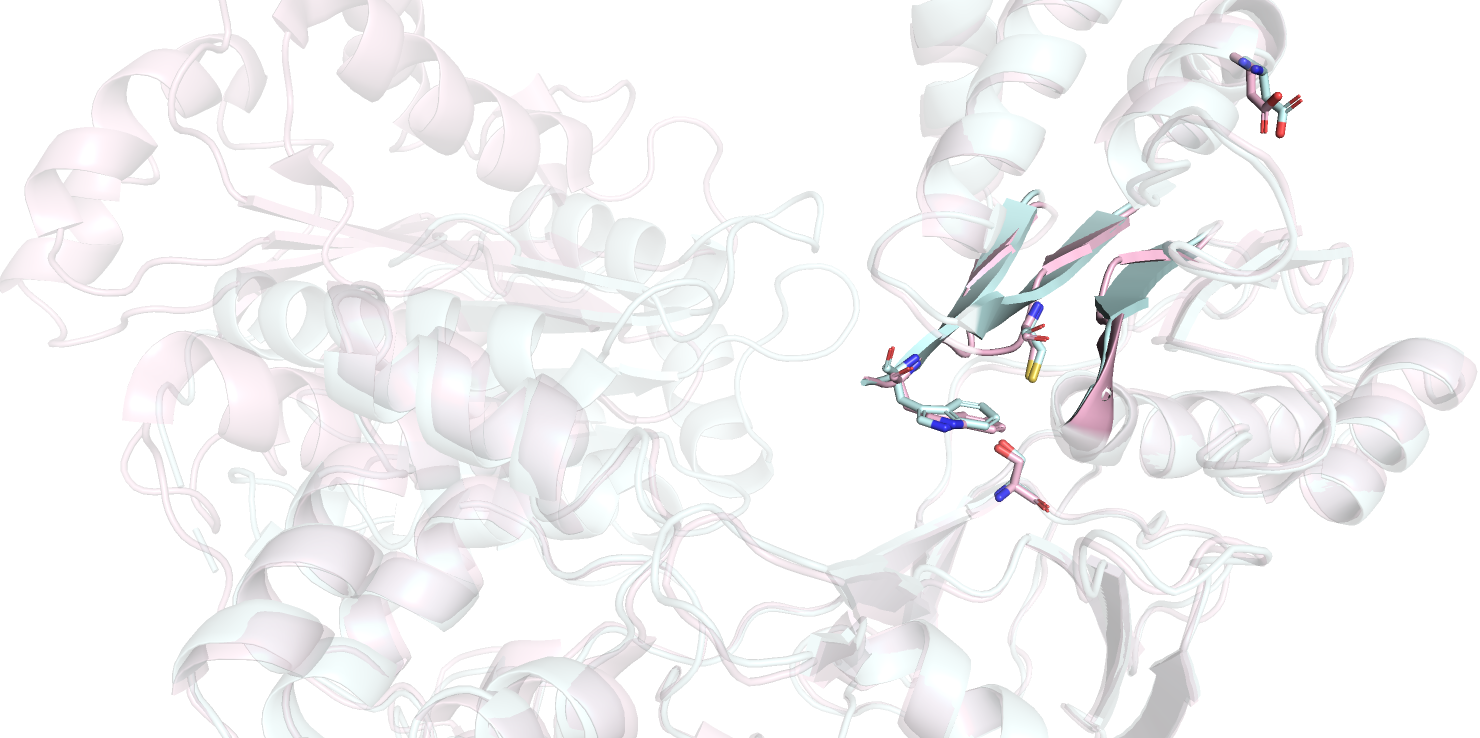
Рисунок 1.3. Наслоение моделей структур открытой (E3S9 - розовая) и закрытой (1AMO - голубая) конформаций, бета-тяжи.
Что касается структурных различий, характеризующих переход из открытой конформации в закрытую, на рисунке 1.1 можно было рассмотреть левую половину, которая совсем не совмещается у структур, рассмотрим ее ближе на рисунке 1.4. Мы можем увидеть, что при переходе в открытую (розовую) конформацию, эта подвижная часть белка с 66 по 240 а.о. как будто 'отворачивается' от остальной части белка: это отлично заметно по лигандам FMN-751 (они смотрят в разные стороны друг от друга для двух конформаций белков).
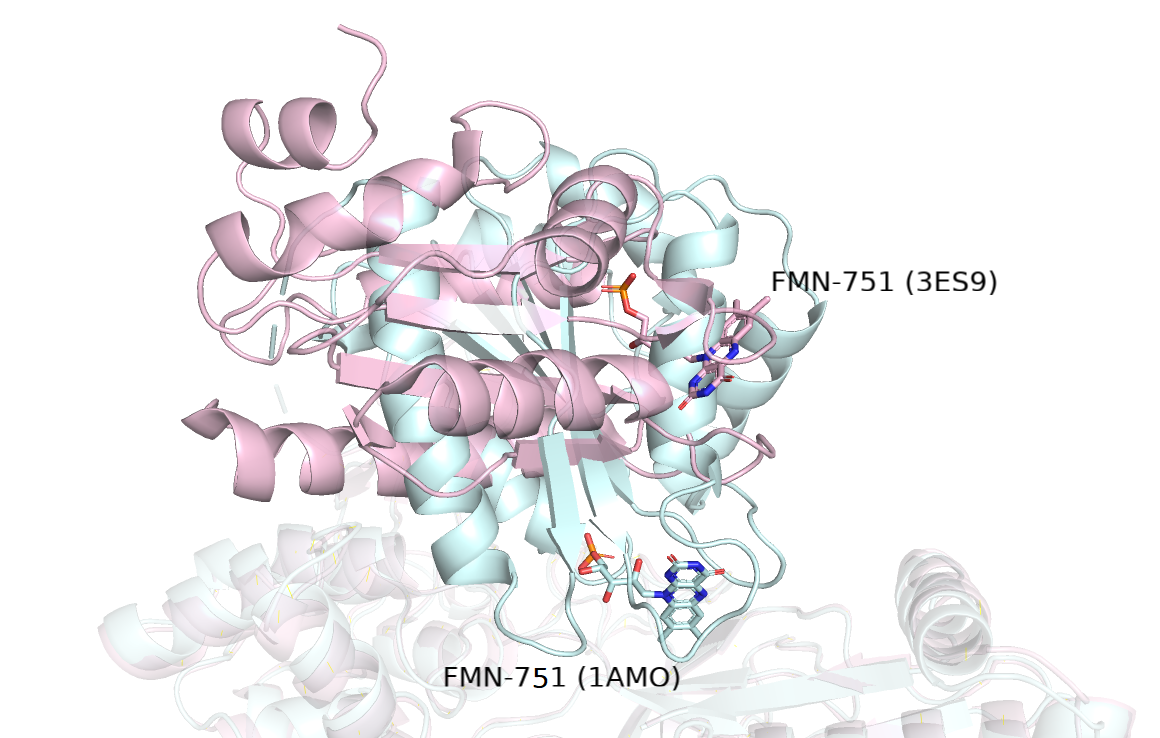
Рисунок 1.4. Наслоение моделей структур открытой (E3S9 - розовая) и закрытой (1AMO - голубая) конформаций, подвижный 'домен'.
Затем для двух структур были измерены площади молекулярной поверхности и поверхности, доступной растворителю (в ангстремах^2).
Получилось:
1AMO (закрытая конформация): 62058.094 (MS), 26927.459 (SAS)
3ES9 (открытая конформация): 61392.473 (MS), 28615.045 (SAS)
Можно заметить, что площадь молекулярной поверхности у белка с закрытой конформацией
больше, чем у открытой. Это может быть связано с тем, что при открытой конформации некоторые остатки не экспонируются наружу, чтобы ни с чем не взаимодействовать, а
при закрытии конформации они экспонируются и, возможно, участвуют в каталитической реакции или просто важных электростатических или гидрофобных взаимодействиях, стабилизирующих закрытую конформацию для спокойного протекания реакции.
Площади же поверхностей, доступных растворителю, у закрытой конформации меньше, чем у открытой, что вполне логично.
PDBID: 1AMO и 3ES9
На данном этапе нужно было определить положение основного кармана связывания. С помощью сервиса fpocket нужно было предсказать положение и параметры карманов на поверхности молекул. Визуально не совсем очевидно, где находится карман связывания, но если взглянуть на структуру и пометить аминокислоты активного центра, становится более понятно (см. гифка 2.1).
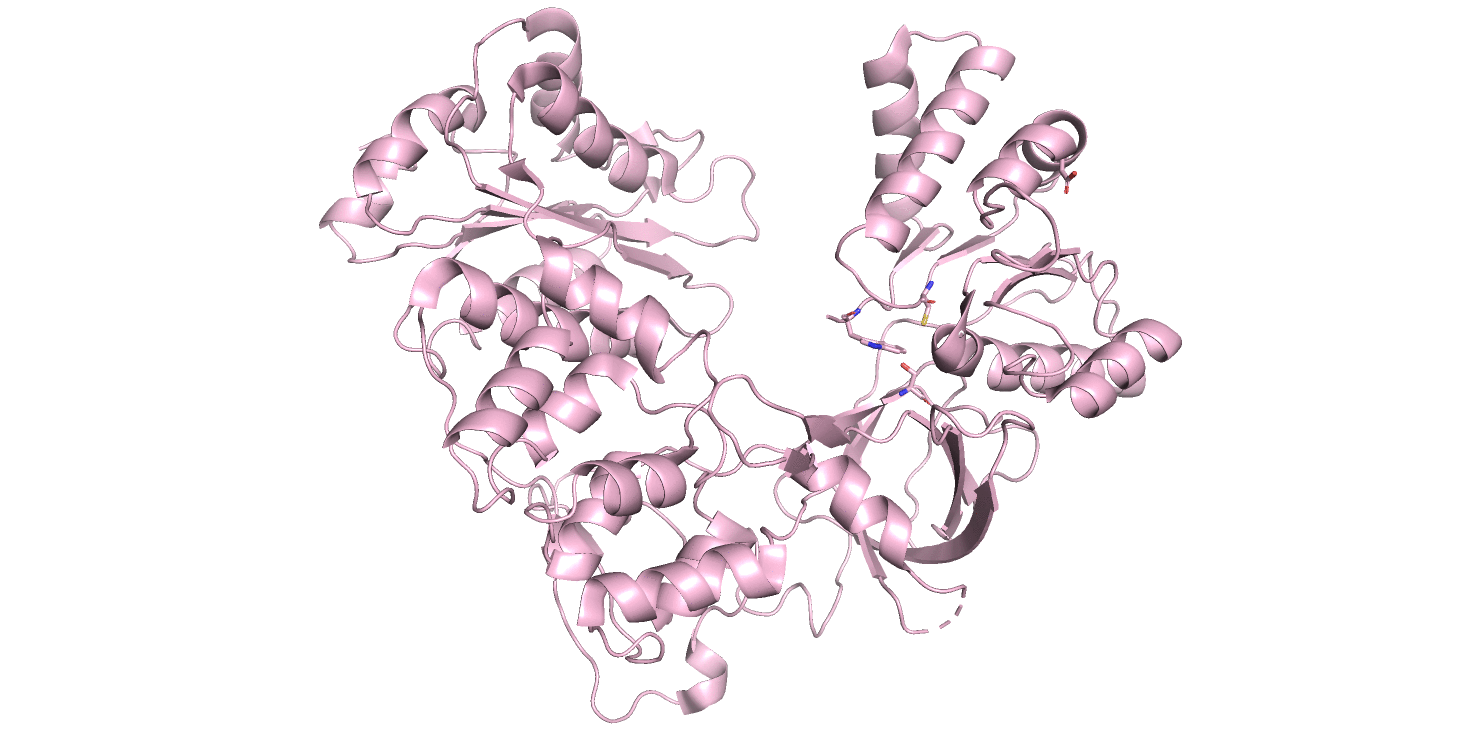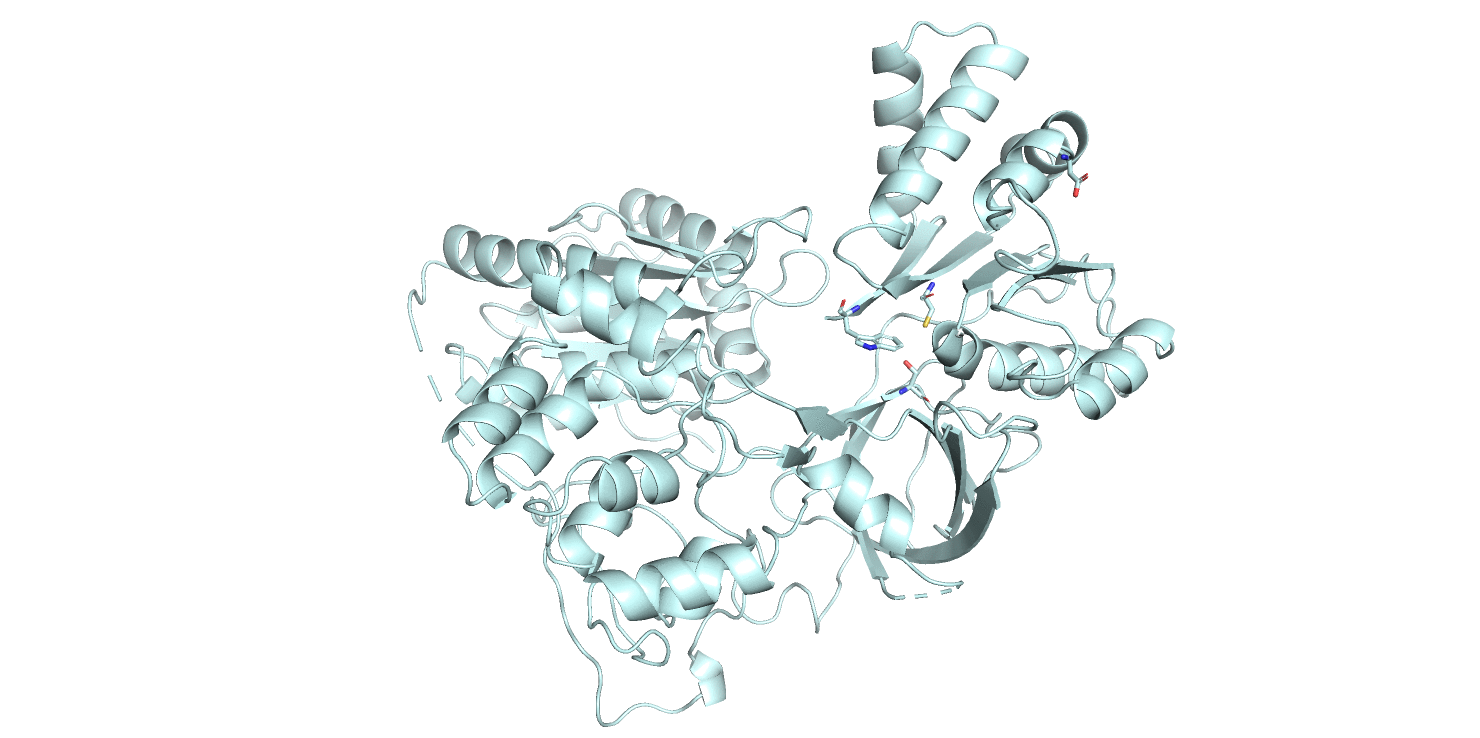
Гифка 2.1. E3S9 - розовая (открытая конформация) и 1AMO - голубая (закрытая конформация); аминокислотные остатки активного центра показаны sticks.
В результате работы сервиса со структурой 1AMO (закрытая конформация) было получено 37 возможных карманов связывания, наиболее похожим был выбран карман 1 (см. рисунок 2.2 слева, нумерация в скобках = нумерация в сервисе fpocket), он изображен в виде розовых сфер. Объем данного кармана составил 6526.3525 ангстрем^3. Нужно отметить, что карман находится рядом с аминокислотными остатками активного центра (показаны темно-синим). При работе с структурой 3ES9 (открытая конформация), сервис обнаружил 48 возможных карманов связывания. Наиболее подходящим и совпадающим с кармоном, обнаруженным в закрытой конформации оказался карман 2 (см. рисунок 2.2 справа), изображен голубыми сферами рядом с ярко-розовыми остатками, входящими в активный центр. Его объем составил 3262.9473 ангстрем^3. Как можно заметить объём кармана у структуры с открытой конформацией оказался меньше, чем объём кармана у закрытой конформации, что странно. Однако, нужно отметить, что в случае закрытой конформации в области кармана образуется 'пещерка с тоннелями', которая целиком сервисом считается за карман, чего нет в случае открытой конформации.
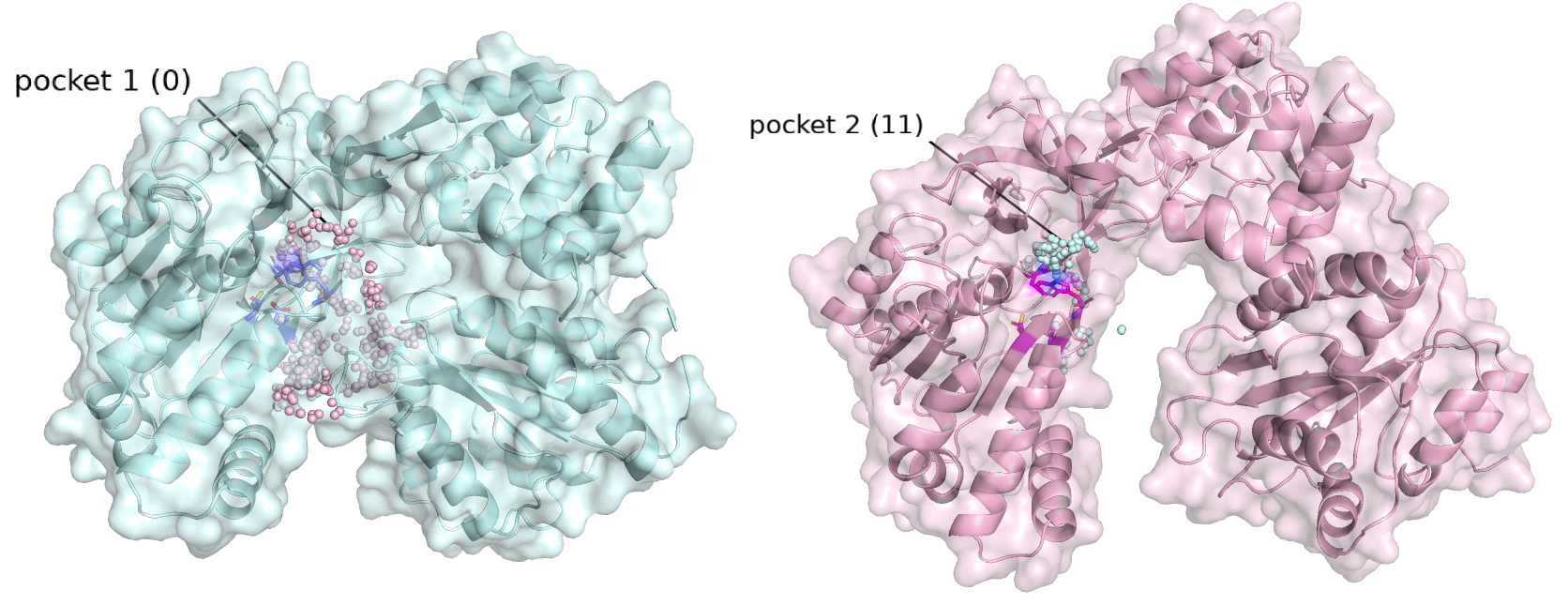
Рисунок 2.2. E3S9 - розовая (открытая конформация) и 1AMO - голубая (закрытая конформация); аминокислотные остатки активного центра показаны sticks.
PDBID: 1AMO и 3ES9
В данном задании нужно было посчитать экспонированность остатков с помощью пакета DSSP, и далее сопоставить экспонированность остатка с его номером для обеих структур, после чего определить, какой остаток больше всего изменил свою экспонированность при "закрытии" белка.
В результате анализа выяснилось, что остаток, наиболее изменивший экспонированность, - это GLU-229. В закрытой конформации (голубая, 1AMO) его экспонированность составляет 170, а в откртытой конформации (розовой, 3ES9) - 35. Разница в 135 является самой большой по модулю среди остатков.
На рисунке 3.1 слева показана закрытая конформация, а справа - открытая. Можно заметить, что в случае закрытой конформации, GLU-229 находится на поверхности белковой глобулы и смотрит радикалом наружу, образуя остовным азотом водородную связь с PRO-225, такм образом, остаток является доступным для взаимодействий с растворителем. В случае открытой конформации (рисунок 3.1 справа), можно увидеть, что радикал находится внутри глобулы белка и стабилизирован, так как также, помимо водородной связи с пролином, образует водородную связь с TYR-387.
Собственно, нужно отметить, что этот остаток пренадлежит тому самому подвижному куску белковой глобулы, о котором говорилось в задании 1.
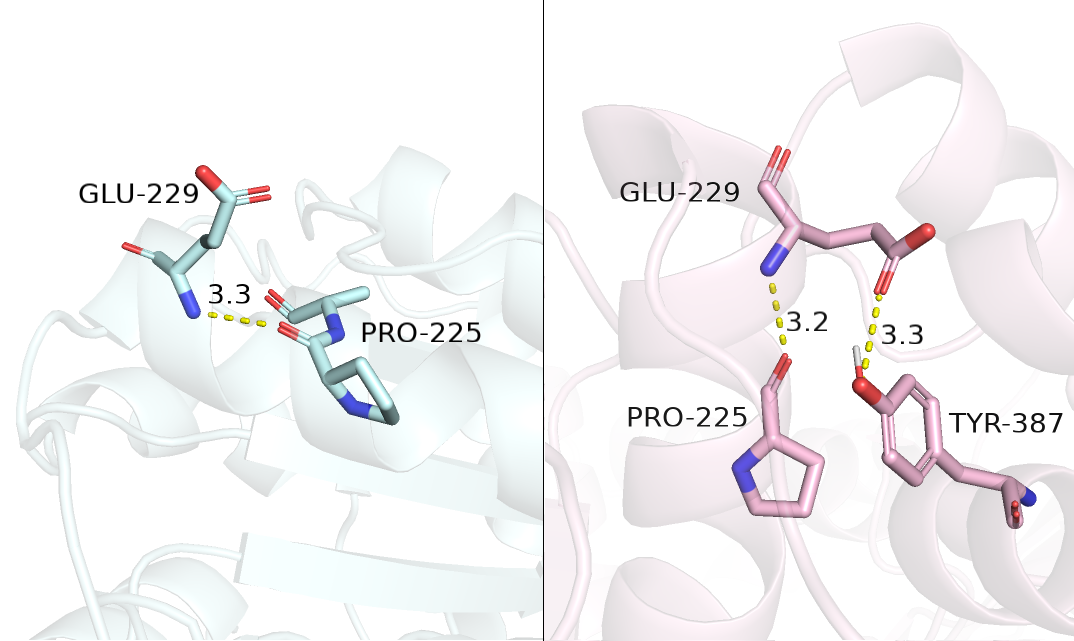
Рисунок 3.1. E3S9 - розовая (открытая конформация) и 1AMO - голубая (закрытая конформация); различное расположение остатка GLU-229 в двух конформациях.
Сайт находится на этапе разработки.
© Бруман Софья, 2020