СОЛЕВЫЕ МОСТИКИ
Солевые мостики (ионная связь) образуются в результате взамодействия между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой (Asp) и глутаминовой (Glu) кислот и положительно заряженными (катионными) группами радикалов лизина (Lys), аргинина (Arg) или гистидина (His)[5].
Для определения солевых мостиков сначала выбирались необходимые аминокислоты, затем раскрашивались в разные цвета (color positive red; color negative blue) и выбирались те остатки, которые находились не более чем в 4 Å друг от друга.
Как вы можете заметить, атом азота в аргинине находится в протонированном состоянии, что означает наличие частичного положительного заряда. Это означает, что, поскольку на атомах кислорода аспарагиновой кислоты присутствует частичный отрицательный заряд, они образуют солевой мостик (или ионную пару) засчет кулоновских сил. То же самое справедливо для второй пары, в которой частичный положительный заряд находится на атоме азота лизина, а частичный отрицательный - на атоме кислорода глутаминовой кислоты.
ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ
Поскольку вода настолько хороша в образовании водородных связей с самой собой, она наиболее гостеприимна к молекулам или ионам, которые в наименьшей степени разрушают ее сеть H-связей. Наблюдения за маслами, плавающими на поверхности воды, демонстрируют, что молекулы масла неполярны - они не несут заряд и не растворяются в воде, но при этом могут разрушить сеть водородных связей. Вода не хочет жертвовать своей стабильностью, которая уменьшится если разорвутся связи, поэтому, чтобы этого избежать, молекулы изворачиваются и частично замораживают рядом с гидрофобной поверхностью аминокислоты свободу своих тепловых движений. Образуется стабильная среда обитания белка: белок не растворяется в воде и не образует с ней связей, то есть свободен от нее, но в тоже время вода также накладывает условия на то как должны размещаться аминокислоты в белке.
Таким образом, гидрофобный эффект берет на себя 90 % работы по созданию белковой глобулы, сворачивая первичную цепь во вторичные и третичные структуры белка. Правда сам по себе он не может создать твердый белок, он создает лишь расплавленную белковую глобулу, то есть гидрофобный эффект заставляет аминокислоты держаться вместе, что затем вызывает другие процессы, которые уже придают более точную форму белкам. [6]
Для поиска гидрофобных ядер был использован сервис CluD[7].
Из исследований одного из остатков гидрофобного ядра ([PHE]199:H) было выявлено, что:
- Минимальное расстояние от остатка, на котором расположены атомы, полностью покрывающие его поверхность 6Å.
- Расстояние между не связанными ковалентно атомами составляет в среднем 3Å, что неудивительно, учитывая Ван-дер-Ваальсовы радиусы и взаимодействия.
- Молекула воды между соседними атомами поместиться не может, поскольку диаметр молекулы воды составляет примерно 2.8Å, поэтому между соседними атомами возникнут силы отталкивания, что приведет к дестабилизации системы.
Лиганды
|
|
В биохимии и фармакологии лиганд — это химическое соединение (часто, но не всегда, малая молекула), которое образует комплекс с той или иной биомолекулой (чаще всего белком, например клеточным рецептором, но иногда, например, с ДНК) и производит, вследствие такого связывания, те или иные биохимические, физиологические или фармакологические эффекты. В случае связывания лиганда с белком, лиганд обычно является малой сигнальной молекулой, связывающейся со специфическим участком связывания на белке-мишени (например, на рецепторе). [8]
В данной структуре в качестве лигандов присутствуют:
- Катион натрия (Na+)
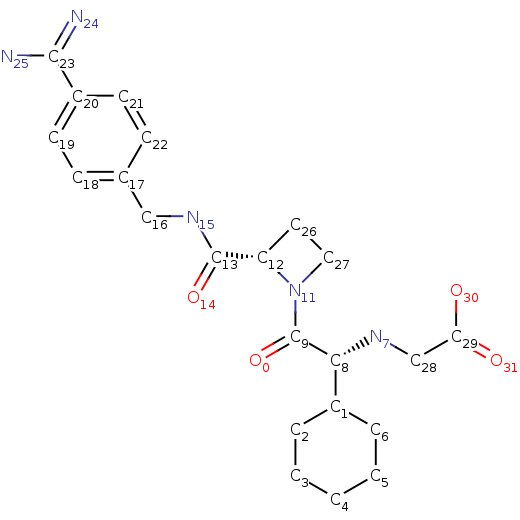
- MEL (C22H31N5O4) – мощный, конкурентный и обратимый прямой ингибитор альфа-тромбина, конвертирующего превращение фибриногена в фибрин в коагуляционном каскаде. Ингибирование тромбина предотвращает развитие тромба. Ингибирует как свободный, так и связанный с фибрином тромбин, а также тромбин-индуцированную агрегацию тромбоцитов. [9]
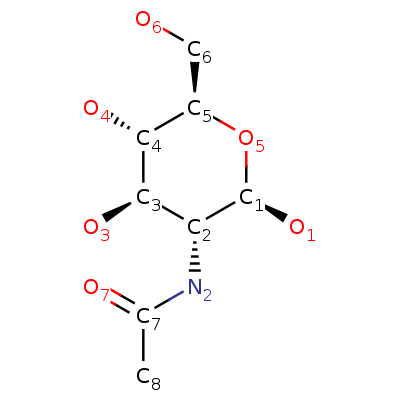
- NAG (C8H15NO6) - является моносахаридным производным глюкозы. Химически это амид между глюкозаминами и уксусной кислотой. Единственный фрагмент N-ацетилглюкозамина, связанный с остатками серина или треонина на ядерных и
цитоплазматических белках -O-GlcNAc, является повсеместной посттрансляционной модификацией белка. [10]
Для нахождения лигандов использовалась команда select ligand, затем командой restrict показывался только необходимый в настоящий момент лиганд и его контакты с биомолекулой.
|
| Ссылка на скрипт |
|
|
[1] Bode W (2006) Structure and interaction modes of thrombin. Blood Cells, Molecules & Diseases 36: 122–130.
[2] Arunan et al (IUPAC), 2011
[3] Водородная связь. Википедия
[4] Биохимия: Учебник / Под ред. Е.С. Северина. - 2-е изд., испр. - М.: ГЭОТАР-МЕД, 2004. 23-25 стр.
[5] Биохимия: Учебник / Под ред. Е.С. Северина. - 2-е изд., испр. - М.: ГЭОТАР-МЕД, 2004. 26-27 стр.
[6] Физика белка: Курс лекций с цветными и стереоскопическими иллюстрациями и задачами: учебное пособие / А.В. Финкельштейн, О.Б.Птицын, - 4-е изд., испр. и доп. – М.: КДУ, 2012. 59-68 стр.
[7] Сервис CluD
[8] Лиганд (биохимия). Википедия
[9] Мелагатран
[10] Human Metabolome Database (HMDB)
Софья Бруман: дизайн сайта, разделы: Водородные связи; Лиганд-биомолекулярные контакты; Лиганд.
Воробьева Маргарита: текст, разделы: Введение; Гидрофобное взаимодействие; Солевые мостики.