Цитохром c’ из бактерии Thermochromatium tepidum
Введение
Thermochromatium (Tch.) tepidum - грамотрицательная бактерия из семейства Chromatiaceae (класс Gammaproteobacteria), представители которого являются фотосинтезирующими анаэробами. Бактерии из семейства Chromatiaceae для фотосинтеза используют, как правило, серу (из сульфидов / тиосульфатов). Характерной чертой этого семейства является образование бактериями глобул серы, которая является промежуточным соединением при окислении сульфидов до сульфатов, и запасание этих глобул внутри клетки. Thermochromatium tepidum - термофильная бактерия, впервые была обнаружена в 1980-х годах в геотермальном источнике Йеллоустонского национального парка, США. Цитохром c’ Цитохромы: содержат ковалентно связанный гем; в состав гема входит железо Fe(II) /Fe(III), — таким образом, цитохромы способны участвовать в транспорте электронов и выступать в качестве катализаторов за счет окисления и восстановления атома железа в составе гема. В зависимости от функций , цитохромы могут быть мембранными или глобулярными (цитохромы c) белками. Цитохромы с: гем ковалентно связан с белком одной/двумя тиоэфирными связями, которые образуются в большинстве случаев между остатками цистеина и виниловыми группами гема. В роли первого аксиального лиганда атома железа выступает аминокислотный остаток гистидина, вторым аксиальным лигандом может быть другой аминокислотный остаток белка, молекулы субстрата или воды. Белок цитохром c’ бактерии Tch. tepidum относится к семейству цитохромов c, гем обладает пятью связями, причем ковалентные связи - с C-концом полипептидной цепи, состоящий приблизительно из 150 аминокислотных остатков. Гомологи цитохрома c’ найдены у большого числа бактерий с самыми различными типами метаболизма: он имеется у многих фотосинтезирующих, денитрифициру ющих, фиксирующих азот бактерий, а также у некоторых метанотрофных бактерий. До сих пор неясно, какую именно физиологическую роль выполняет этот белок. Предполагается, что цитохром c’ включен в транспорт электронов и поддерживает окислительно-восстановительный потенциал. Кроме того, этот белок может связывать некоторые нейтральные (CO, NO) и заряженные (CN-) молекулы. Аминокислотные последовательности цитохрома c’ различных бактерий могут значительно отличаться друг от друга, но, тем не менее, все цитохромы c’ схожи своей общей структурой, для которой характерно наличие four-helix bundle. Далее будут обсуждаться структура и свойства только цитохрома c’ бактерии Tch. tepidum. Цитохром c’ этой бактерии имеет относительно компактную структуру, что обеспечивает его высокую стабильность; в том числе, температура денатурации белка равняется приблизительно 75 °C , что, очевидно, связано с термофильностью бактерии. Аминокислотная последовательность белка в формате fasta (файл скачан с Uniprot)
| PDB ID | 3VRC |
|---|---|
| Uniprot ID | C7G528_THETI |
| Название гена | cycA |
| Название белка | Cytochrome c’ | Длина белка (а.о.) | 154 |
Информация о лигандах
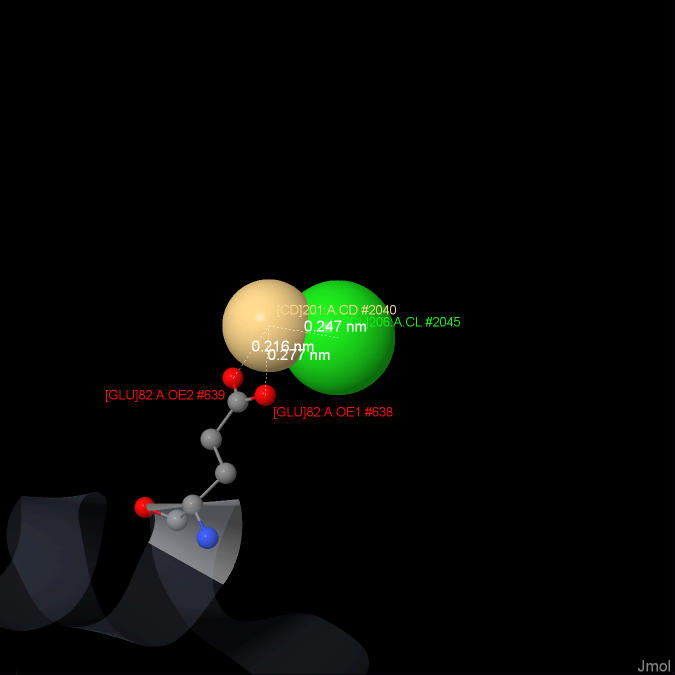
1)Хлорид ион
Название по IUPAC: Chloride ion
Брутто-формула: Cl-
Молярная масса: 35.45 г/моль
Ссылку на идентификатор в базе данных PubChem: 312
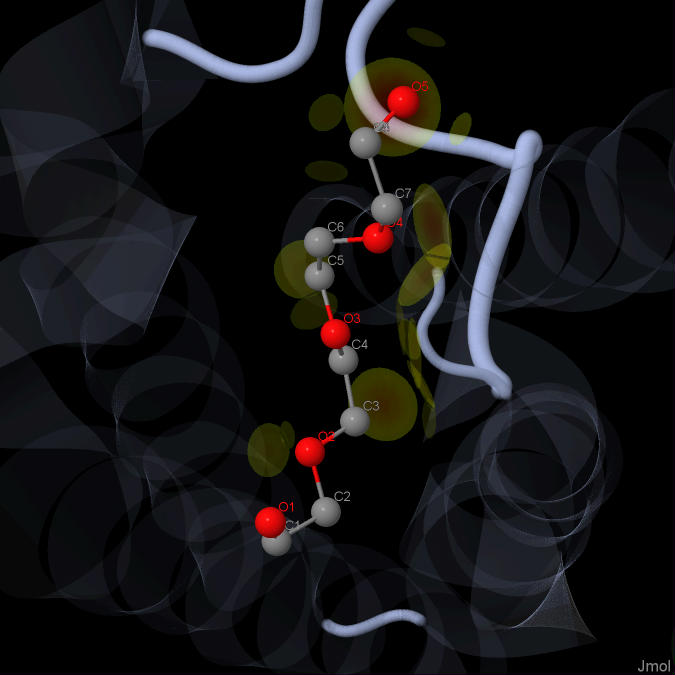
2)Тетраэтиленгликоль
Название по IUPAC: 2,2'-((Oxybis(ethane-2,1-diyl))bis(oxy))diethanol
Брутто-формула: C8 H18 O5
Молярная масса: 194.227 г/моль
Ссылку на идентификатор в базе данных PubChem: 8200
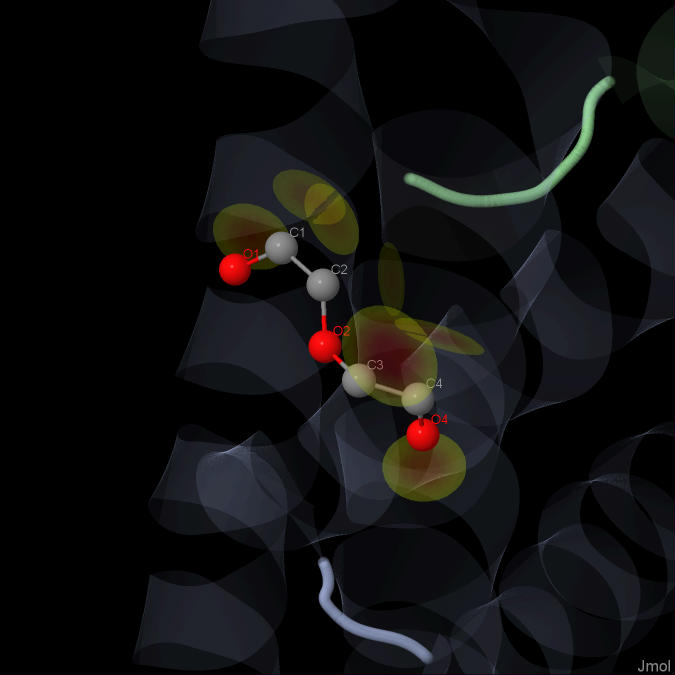
3)Дигидроксиэтил эфир Название по IUPAC: 2,2'-Oxydiethanol Брутто-формула: C4 H10 O3 Молярная масса: 106.121 г/моль Ссылку на идентификатор в базе данных PubChem: 8117
4)Ион кадмия (2+) Название по IUPAC: Cadmium ion Брутто-формула: Cd(2+) Молярная масса: 112.414 г/моль Ссылку на идентификатор в базе данных PubChem: 31193
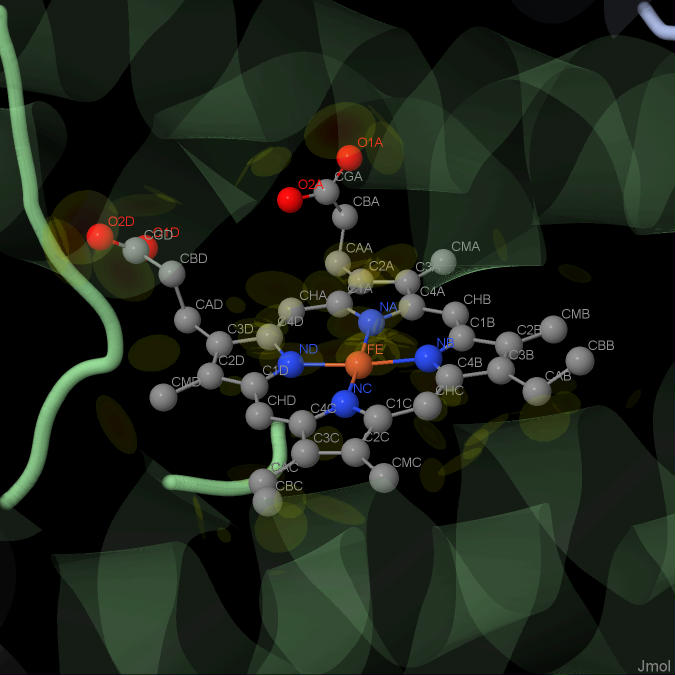
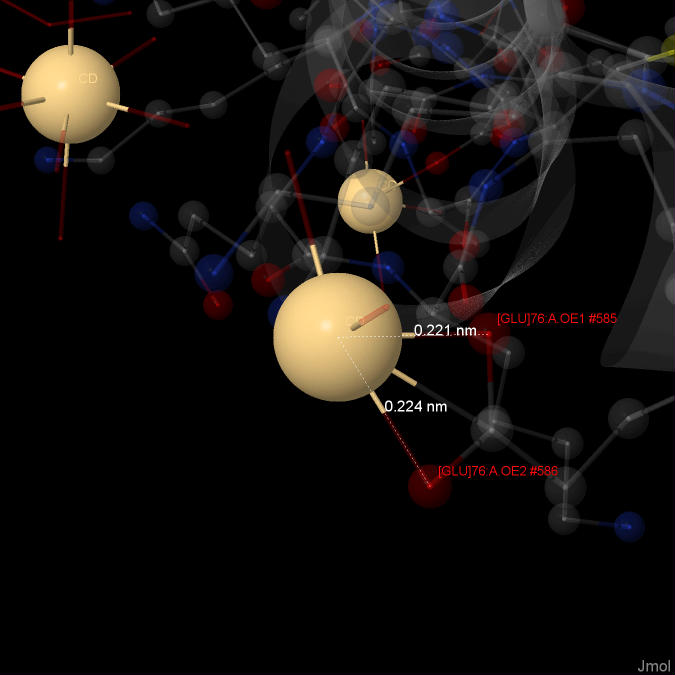
5)Гем C Брутто-формула: C34 H34 Fe N4 O4 Молярная масса: 618.50 г/моль Гем С имеется у всех цитохромов c. Две боковые цепи гема образуют ковалентные тиоэфирные связи с белком, — как правило, с его цистеиновыми остатками. Эти ковалентные связи являются достаточно прочными, чтобы не дать гему отделиться от белка даже при относительно экстремальных условиях, что, в свою очередь, делает возможным все разнообразие структур и функций цитохромов c. Функции цитохромов с преимущественно связаны с переносом электронов. В бактериальных цитохромах могут присутствовать от 2 до 16 гемов; считается, что количество гемов непосредственно связано с выполняемой цитохромом функцией (зависит от числа переносимых электронов в реакции, в которой участвует цитохром). Любопытно отметить, что гем С в составе цитохрома играет важную роль в процессе апоптоза. В каждом из мономеров цитохрома c’ бактерии Tch. tepidum находится по одному гему (всего, соответственно, в белке имеется 2 гема). Гем с соединяется с белком 5-ю связями (однако лиганд-биомолекулярных контактов значительно больше!) : 4 связи образованы четырьмя боковыми цепями гема, две из которых связываются ковалентно тиоэфирными связями с цистеиновыми остатками, лежащими близко к C-концу пептида ; оставшиеся две цепи гема, заканчивающиеся карбоксильными группами, образуют солевые мостики с остатками аргинина; 5-я связь осуществляется между атомом железа в составе гема и гистидиновым остатком пептида. Атом железа в геме образует, соответственно, 4 связи с пиррольнми кольцами порфиринового кольца, 1 связь с гистидиновым остатком белка, а также может образовывать 6-ю связь с аминокислотным остатком белка, молекулой субстрата или с молекулой воды. Гем со всех сторон окружен аминокислотами, остается только один участок, контактирующий с водой (растворителем), — пиррольное кольцо IV. Стоит отметить, что некоторые параметры связей в гемах мономеров несколько отличаются друг от друга: так, например, как следует из статьи (3), в мономере А расстояние между атомомами Nε2 (His 125) и Fe составляет 2.16 Å, в то время как расстояние между соответствующими атомами в мономере B равняется 2.12 Å, однако измерения в JMol покзаывают одинаковые значения (2.13 Å) для обоих расстояний, так что в дальнейшем незначительные различия в параметрах связей в обоих мономерах учитываться не будут.
Связи между мономерами
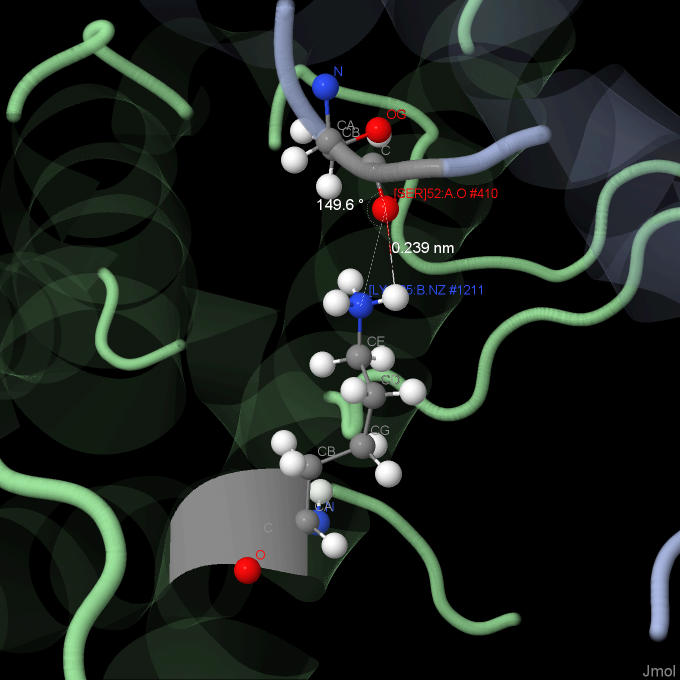
Водородные связи При помощи команды contact {:A and not HOH} {:B and not HOH} были выделены связи между двумя мономерами. Были обнаружены два контакта: [SER]52:B.O + [LYS]25:A и аналогичный [SER]52:A.O + [LYS]25:B. Расстояние между взаимодействующими атомами 0.274 nm и 0.249 nm Радикал лизина, заканчивающийся NH3+ и С=О группа серина связавны водородной связью. Расстояние O-H = 2.39Å, угол C-О-N = 149.6 что соответствует параметрам водородной связи.
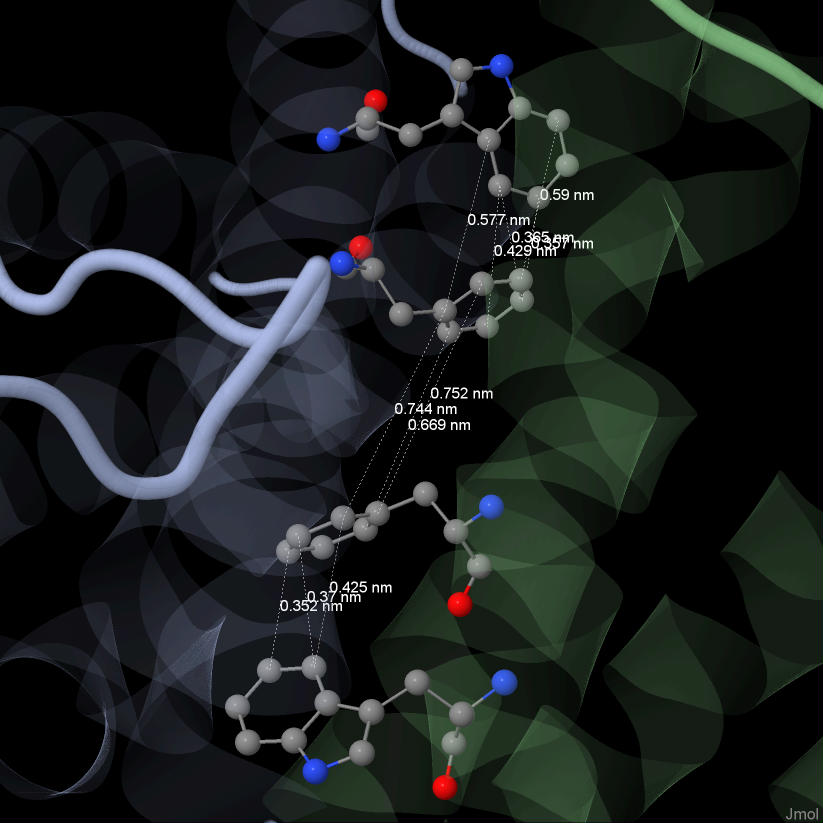
Стэкинг Для поиска стэкинг-взаимодействий были выделены ароматические остатки командой restrict aromatic. Стекинг взаимодействия в данном случае (электростатические) вызваны перекрыванием p-орбиталей в π-сопряженных системах. Мы считали, что два ароматических кольца могут взаимодействовать, если между из центрами не более 12Å [McGaughey, GB; Gagné, M; Rappé, AK (1998)]. Найденная нами система состоит из двух фенилаланинов и двух триптофанов. При этом кольца расположены в ряд: [TRP]21:B - [PHE]18:B - [PHE]18:A - [TRP]21:A и находятся в месте контакта двух мономеров. Расстояние между двумя фенилаланинами разных цепей примерно 8Å, что мы сочли достаточным, чтобы счесть взаимодействие возможным. Расстояние между кольцами из одной цепи около 4Å, то есть наличие связи очень вероятно. Наличие такого симметричного контакта, в котором учавствуют гидрофобные радикалы, свидетельствует о том, что мономеры также соединяются друг с другом в силу гидрофобных взаимодействий. Чуть больше измерений. UPD: При обсуждении практикума нам посоветовали ресурс (http://pic.mbu.iisc.ernet.in/job.html), который считает взаимодействия в белке. И в соответствии с этим ресурсом, ароматических взаимодействий между [PHE]18:B - [PHE]18:A нет.
Расстояние между атомами
Нами был взят [PHE]18:A (Фенилаланин). Каждый из мономеров цитохрома представлен 4-я альфа-спиралями, которые параллельны друг другу и расположены по кругу. Гидрофобный радикал выбранного остатка находится в области между мономерами. Исследуя этот остаток мы хотели также посмотреть, связаны ли мономеры гидрофобно. На расстоянии в 5Å остаток становиться практически не видно (атомы полностью покрывают его поверхность) Характерное расстояние между окружающими атомами и атомами остатка - около 2-3 (значительная часть атомов появляется при выделении на расстоянии 2 и 3 ангстрем). Молекула воды (диаметр атома кислорода - 3.2Å) не поместилась бы в данной области, поэтому можно с уверенностью сказать что это гидрофобная область. UPD: При обсуждении практикума нам посоветовали ресурс (http://pic.mbu.iisc.ernet.in/job.html), который считает взаимодействия в белке. И в соответствии с этим ресурсом, в области [PHE]18:A действительно находится гидрофобное ядро, включающее [TRP]21:A, [VAL]45:A и [ILE]49:A
Личный вклад
С.Г. изучила белок-белковые взаимодействия, писала текст про расстояние между атомами. О.Ф написал параграф про лиганды и вступление, делал скрипт к параграфу про расстояние между атомами и лигандами. Кроме того, О.Ф. писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он написал, что писал заключение, в котором он писал, что писал заключение... Авторы хотят выразить благодарность Руслану Салимгарееву за помощь с оформлением! А также Анжелике Додоновой за обсуждение.
Литература
- Hirano, Y., Kimura, Y., Suzuki, H., Miki, K., & Wang, Z.-Y. (2012). Structure Analysis and Comparative Characterization of the Cytochrome c′ and Flavocytochrome c from Thermophilic Purple Photosynthetic Bacterium Thermochromatium tepidum. Biochemistry, 51(33), 6556–6567.doi:10.1021/bi3005522
- Основы биохимии Ленинджера: в 3т. Т.1: Строение и катализ / Д. Нельсон, М. Кокс
- https://www.sciencedirect.com/science/article/pii/002228369291058W - данные об углах
- Jeffrey, George A.; An introduction to hydrogen bonding, Oxford University Press, 1997
- http://www.jbc.org/content/273/25/15458.long - stacking info
- https://en.wikipedia.org/wiki/Cytochrome
- https://en.wikipedia.org/wiki/Cytochrome_c_family
- Hirano, Y., Kimura, Y., Suzuki, H., Miki, K., & Wang, Z.-Y. (2012). Structure Analysis and Comparative Characterization of the Cytochrome c′ and Flavocytochrome c from Thermophilic Purple Photosynthetic Bacterium Thermochromatium tepidum. Biochemistry, 51(33), 6556–6567.doi:10.1021/bi3005522
- https://en.wikipedia.org/wiki/Heme_C