| Ссылки на скрипты: |
|---|
| Core |
| Residue |
| DNA-protein complex |
Выходные данные:
1. В апплете продемонстрировно самое крупное гидрофобное ядро белка, другие гидрофобные кластеры не столь значительны. Данное ядро содержит 1292 атома, что составляют порядка 23% от общего числа атомов в белке. При отображении гидрофобного кластера видно, что значительная часть поверхности является гидрофобной.
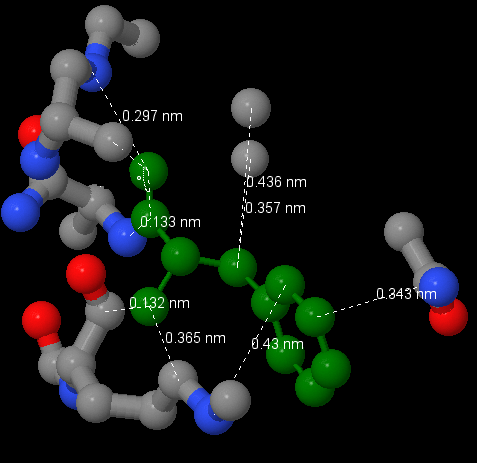
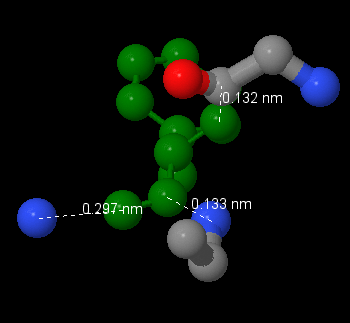
2. Рассмотрим координационно окружение 6-го остатка фенилаланина А-цепи. Этот остатток входит в вышеозначенное гидрофобное ядро и имеет достаточно крупный радикал. Сразу хотелось бы отметить, что на расстоянии 1-го ангстрема вокруг аминокислотного остатка атомного окружения не было обнаружено. Кроме того, остаток аминокислоты не покрывается соседними атомами полностью. Это связано с тем, что исследумый остаток находится на периферии белковой молекулы. Ближайшее окружение данного исследуемого фенилаланина расположено, в пределах 3 ангстрем, хотя самые малые значения это расстояние в 1.3 ангстрема. Стоит напомнить, что 1 ангстрем это 0.1 нанометр.


На закономерный вопрос, сможет ли молекула воды примоститься где-нибудь вокруг исследуемого остатка в достаточно большом гэпе, рассмотрим наиболее благоприятный нам случай - углерод 61-го изолейцина образует с фенилаланином в исследумом учатске карман в 4.36 ангстрем. Зная, что радиус атома углерода равен примерно 1.4 ангстрема [1], мы можем посчитать, что пространство между атомами составит 1.56 ангстрем. Радиус кислорода -уже 1.52 ангстрема, значит, молекула воды не сможет поместиться в данный зазор. Рассматривать атомы в пределах шире, чем три ангстрема, не иммет смысла, так как упомянутые близлежащие будут мешать молекуле воды встроиться подходящим образом.
3. Теперь перейдём к исследованию белкового комплекса с ДНК. Рассмотрим таковой у человеческой полимеразы, способной к репликации. (PDB ID:5KFV). Молекула ДНК буквально зажата цепью белка, она контактирует с ним обеими цепями, условно вложенная внутрь специального углубления в его форме. На одной из цепей наблюдается очень интересная картина: цепь вывернута в районе второго нуклеотида на 180 градусов, который в этот момент не спарен с комплементарным. Естественно, это связано с процессом репликации, ведь для его осуществления цепи нужно разъеденить. Что не делает конформацию менее любопытной. Белки, взаимодействующие с нуклеиновыми кислотами, в принуипе, могут выполнять разнообразные функции. С одной из таких мы только что стокнулись - многие из них обслуживают ядерный аппарат, связываются с н.к. для репарации или репликации, есть те, что способны делать специфичные разрезы в таких молекулах, гидролизовать оные, есть регуляторные молекулы, обеспечиващие какие-то иные процессы, вроде факторов транскрипции и трансляции, метки, для облегчения взаимодействия третьих белков. В целом, такой разбор достоин отдельной лекции.
5. И последняя часть - интерактивная! На видео приведена визуализация химической реакции. В изысканиях по вопросу, какая же на самом деле реакция представлена в ролике, вне сомнения нам безмерно поможет механизм реакции, представленный в ролике. Похоже, что центральная молекула вместо пара-нитро-фенола присоединяет тирозин. Это похоже на реакцию бимолекулярного нуклеофильного замещения. У нас одновременно отщепляется уходящая группа, в данном случае, паранитрофенол, и присоединяется новая. Как не сложно догадаться, атаку в данном случае осуществляет молекула-нуклеофил, несущая неподелённую электронную пару. Эта самая электронная пара, в данном случае, это электронная пара кислорода. К слову, данный механизм, если уж мы вспоминаем термины, называет Sn2.
На главную страницуВернуться назад
©Solonovich Vera,2017