Поиск ферментативной реакции по названию субстрата и продукта.
Субстрат: 3-Phospho-D-glycerate.Продукт: 3-Phosphonooxypyruvate.
P.S. Русские названия приведены на картинке ниже (наведите курсор).
Схема реакции:
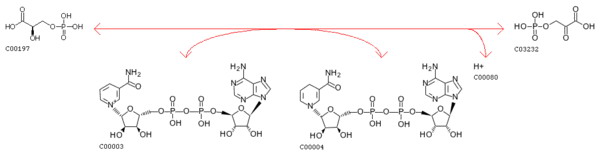
Код реакции: rn:R01513
Метаболический путь (метаболизм глицина, серина и треонина).
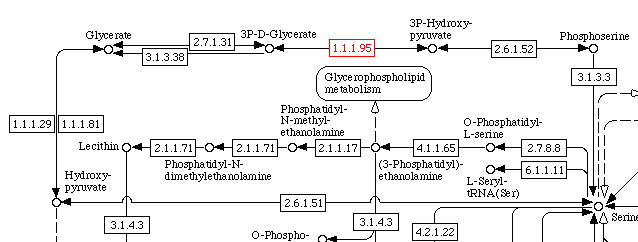
Ниже представлен фрагмент схемы.
Комментарий: Красным прямоугольником на схеме выделен наш фермент, стрелочка вправо
указывает на продукт, а влево - на субстрат. Названия на схеме являются синонимами к названиям нашего субстрата и продукта. Как видно,
продукт участвует в дальнейшем превращении в фосфосерин, и эта реакция катализируется ферментом с номером 2.6.1.52 (фосфосерин
трансаминаза). Субстрат же, судя по схеме, мог появиться из глицерата при участии фермента 2.7.1.31 (глицерат киназа), который,
кстати, может также обратить реакцию вспять, как и фермент 3.1.3.38 (3-фосфоглицерат фосфотаза), но последний это делает уже
необратимо.
Некоторые сведения о единственном ферменте:
- код: EC 1.1.1.95;
- название в переводе с английского: фосфоглицерат дегидрогеназа;
- класс: оксиредуктазы;
- функция: действует на группу СН-ОН доноров, используя NAD+ или NADP+ как акцепторы;
- Число генов, которые по данным KEGG являются ортологами гену данного фермента, — 232.
Данный субстрат мог возникнуть в результате 8 разных реакций.
Данный продукт, по-видимому, не участвует ни в каких дальнейших реакциях.
Катализ одной и той же реакции ферментами разного типа.
Название метаболического пути: Fructose and mannose metabolism (метаболизм фруктозы и маннозы). Поиск по названию дал 379 хитов. Если рассматривать схемы метаболизма, то там есть ссылки (отмеченные зелёным цветом), имеющие отношениу к конкретному организму. Если использовать в названии слова reference и map, то получается 3 и 1 хит, соответственно. Использование map привело к схеме, на которой каждая ссылка указывает на множество организмов, т.е. она не специфична. А использование reference помимо резульата, полученного с map, даёт также неспецифичные ссылки на базу данных KO, которая содержит курирующиеся вручную онтологи генов.При поиске используем reference и рассмотрим схему со ссылками на КО, например:
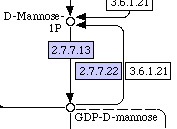 .
.
Здесь интересно рассмотреть необратимую реакцию изменения ГДФ-D-маннозы в D-маннозу-1Р, которая катализируется 2 ферментами с кодами EC 2.7.7.22 и 3.6.1.21.
Сравнение:
| Код | EC 2.7.7.22 | EC 3.6.1.21 |
| Название | Манноза-1-фосфат гуанилилтрансфераза (ГДФ) | АДФ-сахароза дифосфотаза |
| Класс | Трансферазы | Гидролазы |
| Функция | Перенос фосфоро-содержащих групп | Действует на кислые фосфосодержащие ангидриды |
| Число ортологов гена фермента | 145 | Нет ссылок |
| Реакция | GDP + alpha-D-mannose 1-phosphate = phosphate + GDP-mannose | ADP-sugar + H2O = AMP + alpha-D-aldose 1-phosphate |
Фермент с EC 3.6.1.21 был получен из тканей млекопитающих. Другой фермент также встречается у млекопитающих. Но видно, что ферменты оказывают противоположное действие: если один присоединяет, то другой - отщепляет. Вызывает удивление, почему тогда в схеме показано, что ферменты катализируют необратимую реакцию. Наверное, этот факт учитывается тем, что на приведённых ниже схемах мы можем сами выбирать направление реакции.
Схема реакции, катализируемая ферментом с кодом EC 2.7.7.22
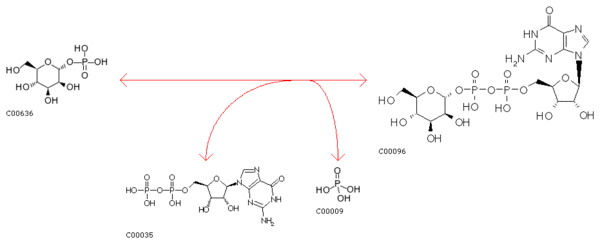
и с кодом EC 3.6.1.21 (1 из 6 примеров)
Cравнение метаболических путей у разных организмов.
Рассмотрим следующий метаболический путь: Биосинтез фенилаланина из хоризмата (сhorismate).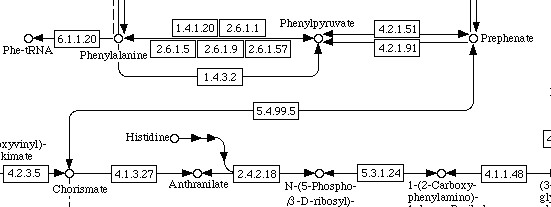
Как видно, биосинтез идёт через образование префената и фенилпирувата и катализируется многими ферментами.
Теперь поиск этого пути у человека и Arabidopsis thaliana. Ниже приведены лишь фрагменты этих схем:
Arabidopsis thaliana |
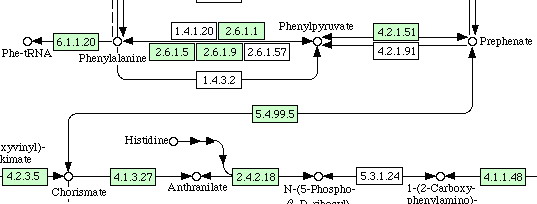 |
Homo sapiens |
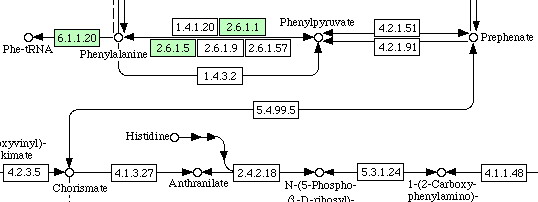 |
Обсуждение: по-видимому, у человека отсутствуют ферменты для биосинтеза фенилаланина из хоризмата; точнее есть только
такие, которые принимают участие в непосредственном синтезе из предшественника фенилаланина — фенилпирувата. Исходя
из схемы, можно предположить, что фенилаланин поступает в наш организ извне. Дальнейшая его судьба в биосинтезе у человека
связана с превращением в тирозин: "...если избыток фенилаланина не окисляется в тирозин, то он оказывает на человека
токсическое действие" (Д.Мецлер "Биохимия").
В отличие от человека, у Arabidopsis thaliana присутствуют все необходимые ферменты для биосинтеза фенилаланина из
хоризмата. А вот дальнейшее превращение его в тирозин у них не происходит, т.к. нет нужного фермента, и фенилаланин
идёт только на биосинтез белков и некоторых метаболитов данной аминокислоты
В заключение, у человека фенилаланин является незаменимой аминокислотой, а растения могут синтезировать его сами.