Общая характеристика структуры белка pdaA
Немного общей информации о структурe предполагаемой дезацетилазы полисахаридов
|
Идентификатор PDB
|
1W1B
|
|
Название белка
|
Предполагаемая дезацетилаза полисахаридов (Probable polysaccharide deacetylase)
|
|
Краткое описание структуры белка, количество цепей в PDB-файле (их названия указаны в скобках) (рис.2)
|
Белок pdaA состоит из 2 одинаковых цепей (1 и 2). В нем нет 1-23 аминокислотных остатков.
|
|
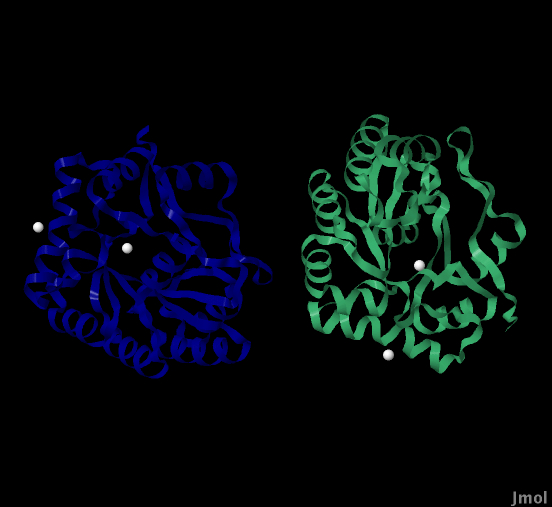
Молекулы, которые есть в PDB-файле, отличные от собственного белка и воды (их количество указанно в скобках) (рис.1)
|
CD молекулы (4)
|
|
.png)
|
|
Рис.1 Наглядное изображение белка pdaA с неотносящимися к нему молекулами. Зеленым и синим цветом обозначены 1 и 2 цепь белка соответственно. Белым цветом окрашены 4 молекулы, не входящие в состав белка - ионы кадмия, как указанно в текстовом PDB-файле.
|
Рис.2 Изображение белка: начало цепи раскрашено синим, далее цепь окрашена по градиенту до зеленого.
|
Анализ структуры альфа-спиралей и бета-листов в цепи 1 (2 цепь такая же) белка с кодом PDB 1W1B
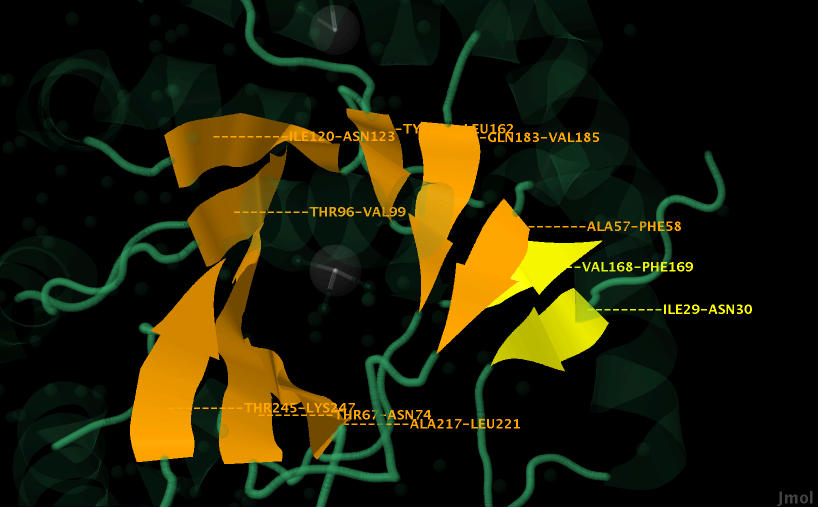
В цепи 1 белка pdaA есть 12 альфа-спиралей (helix) и 4 бета-листа (sheet) (рис. 3). Устройство альфа-спирали и бета-листа можно увидеть на рисунках 3-12.
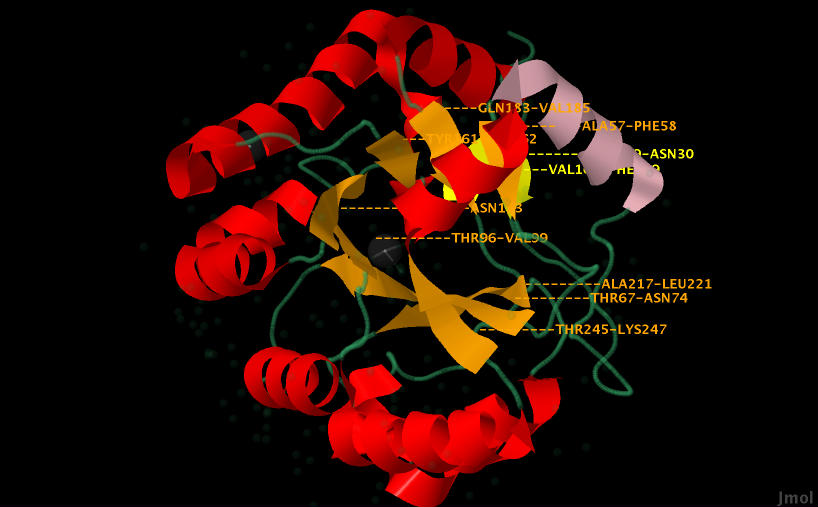 |
| Рис. 3. Общий вид расположения бета-листов и альфа-спиралей в цепи 1 белка (цепи 1 и 2 идентичны в белке pdaA). оранжевым и желтым окрашены бета-листы, розовым, иследуемая альфа-спираль, красным другие спирали, зеленым иные структуры в белке.
|
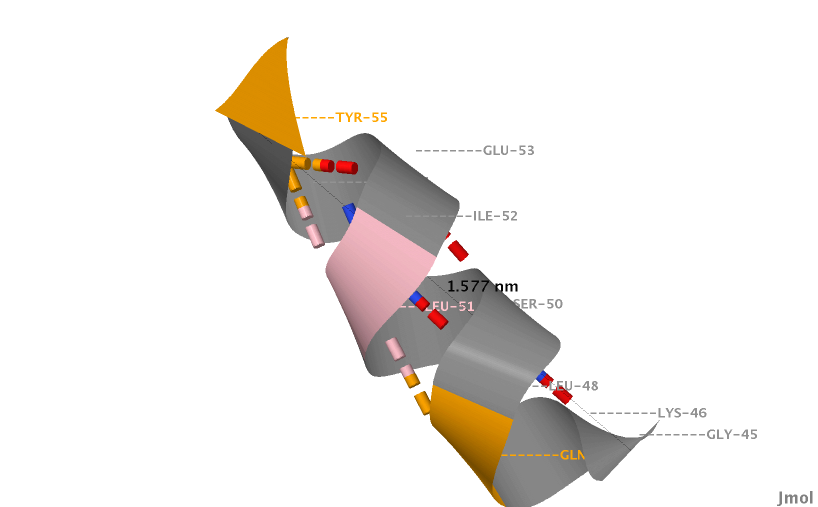
Для выбранной спирали выяснила ее параметры (спираль от 45 до 55 аминокислотного остатка):
- Шаг спирали (средний) равен приблизительно 5,63 нанометров или 56,3 ангстрем (рис. 4). Для подсчета делим длину спирали (рис. 4) на число витков, равное 2.8.
- Число остатков спирали на один виток (среднее значение) равно приблизительно 3.6. Для подсчета делим количество аминокислотных остатков (55-45=10) на количество витков спирали (2.8).
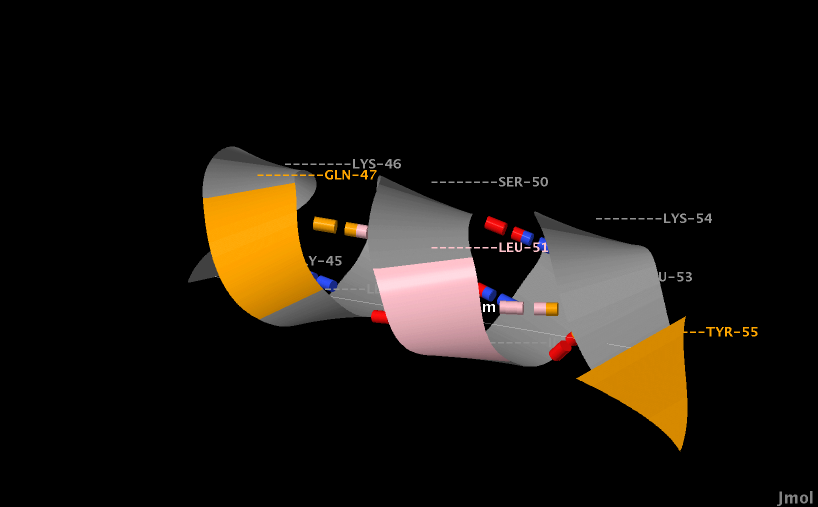
- Аминокислотный остаток с номером n образует водородные связи с остатками с номерами (n-4) и (n+4) (рис. 5, 6, 7, 8).
|
|
|
Рис. 4. Структура альфа-спирали. Штриховкой обозначены водородные связи, черным подписана длина спирали в нанометрах, серым, розовым, оранжевым обозначены аминокислотные остатки.
|
Рис. 5. Водородные связи обозначены на рисунке штриховкой. Остаток с номером n окрашен розовым цветом, оранжевым - остатки (n-4) и (n+4).
|
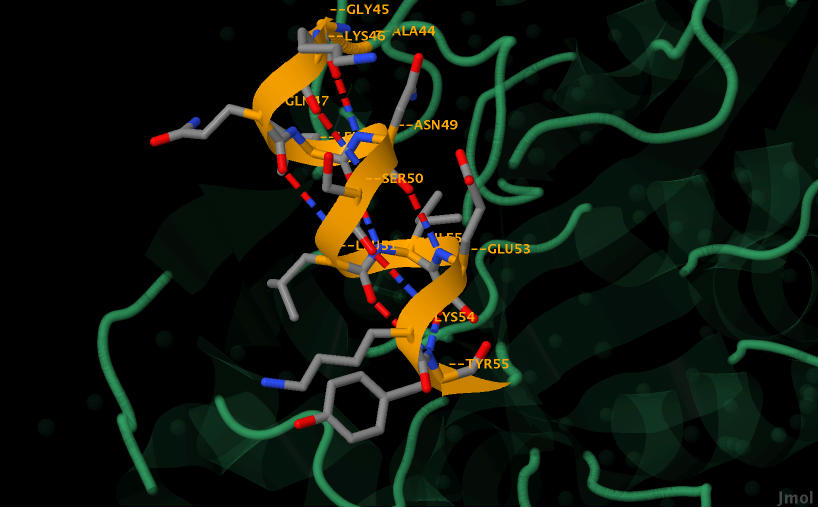 |
| Рис. 6. Более наглядное изображение водородных связей в альфа-спирали, которая состоит из аминокилотных остатков с 45 по 55. На рисунке подписаны аминокилотные остатки. Синим обозначены атомы азота, красным - кислорода, оранженым - С-альфа атомы, серым - другие атомы. |
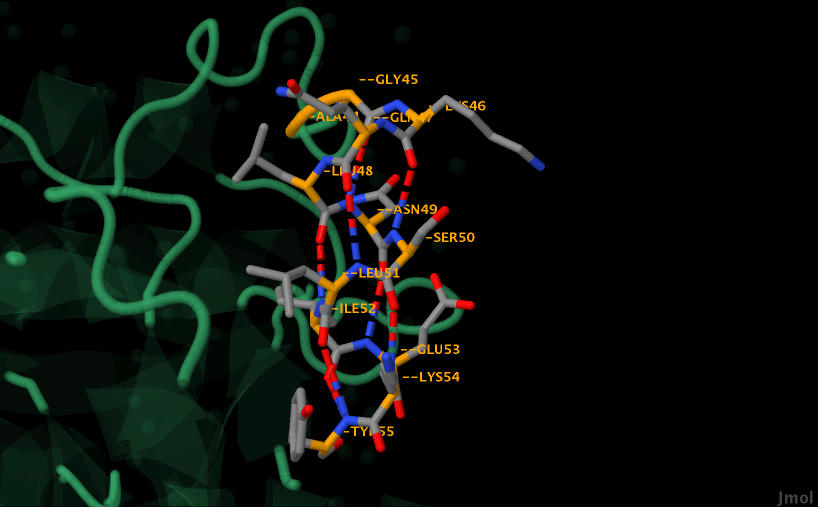
|
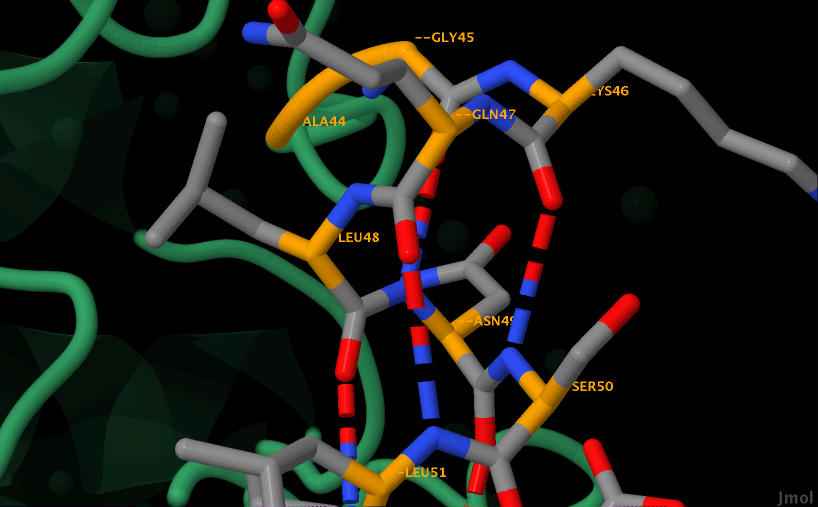
|
|
Рис. 7. Изображение с водородными связями между кислородом и азотом в структуре спирали. Синим обозначены атомы азота, красным - кислорода, оранженым - С-альфа атомы, серым - другие атомы.
|
Рис. 8. Водородные связи. Приближены. Синим обозначены атомы азота, красным - кислорода, оранженым - С-альфа атомы, серым - другие атомы.
|
Устройство бета-листов:
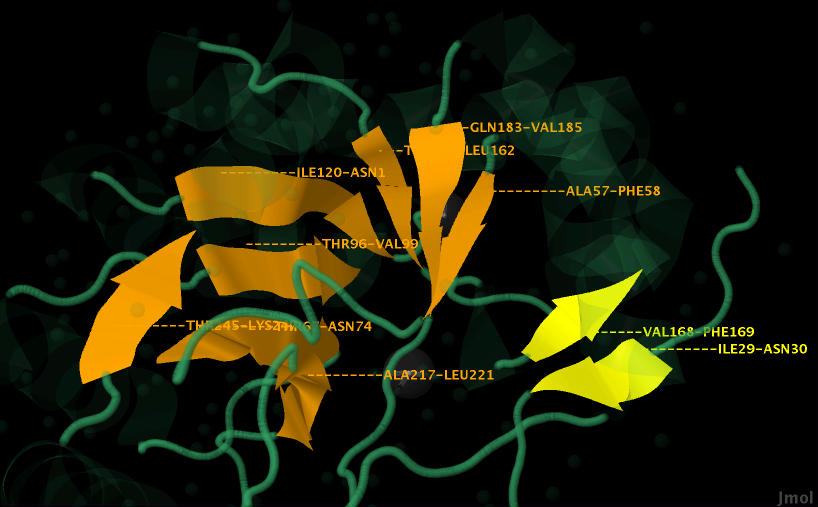
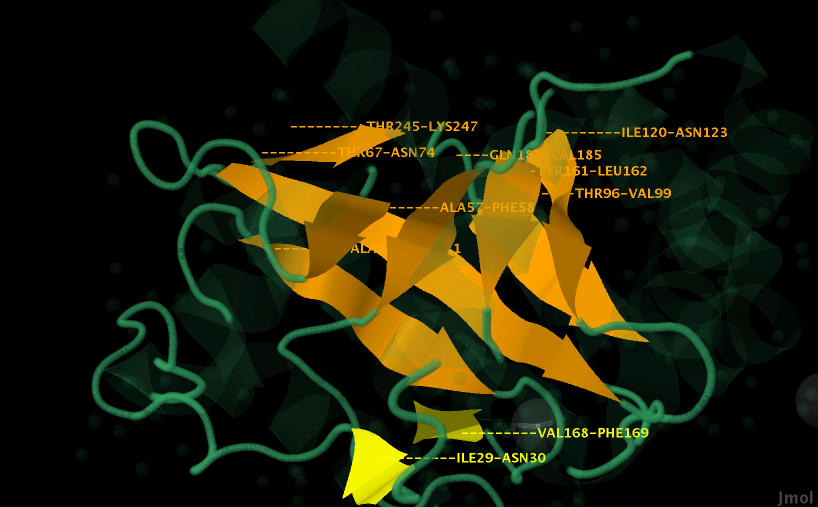
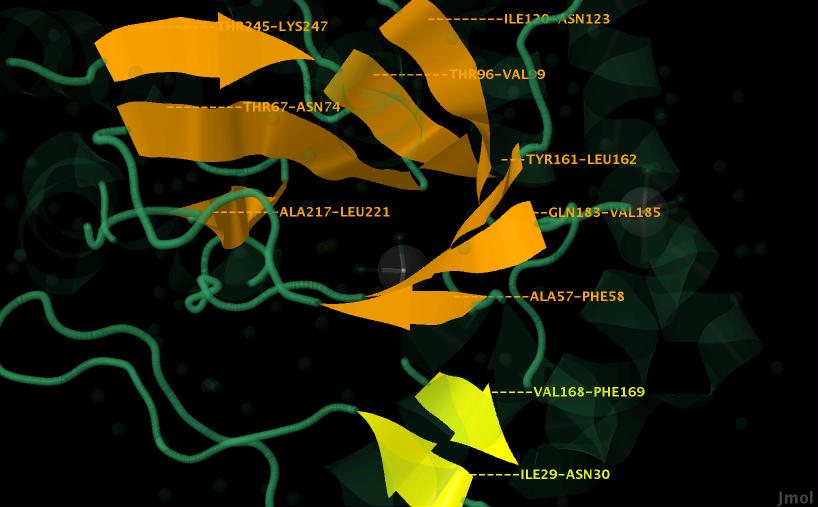
Все тяжи, окрашенные оранжевым, параллельны, так направленны в одну сторону (видно по стрелочкам). Они образуют своеобразную воронку, которая погружена в цепь белка. Рассмотреть это с различных ракурсов можно на рисунках 9-12.
Желтый бета-лист состоит из 2 антипараллельных тяжей, т.е. направленных в разные стороны (разнонаправленных). Они не имеют изгибов. Это можно увидеть на рисунках 9-12.
 |
 |
|
Рис.9. Оранжевые тяжи параллельны и образуют воронку. Желтые антипараллельны и расположены в одной плоскости.
|
Рис. 10. Оранжевые тяжи параллельны и образуют воронку. Желтые антипараллельны и расположены в одной плоскости.
|
 |
 |
|
Рис.11. Оранжевые тяжи параллельны и образуют воронку. Желтые антипараллельны и расположены в одной плоскости.
|
Рис. 12. Оранжевые тяжи параллельны и образуют воронку. Желтые антипараллельны и расположены в одной плоскости.
|
Внутримолекулярные взаимодействия боковых групп белка в цепи 1 структуры 1W1B
- Для обнаружения дисульфидных мостиков необходимо найти цистеиновые остатки. А их нет в белке pdaA. Следовательно и нет дисульфидных мостиков.
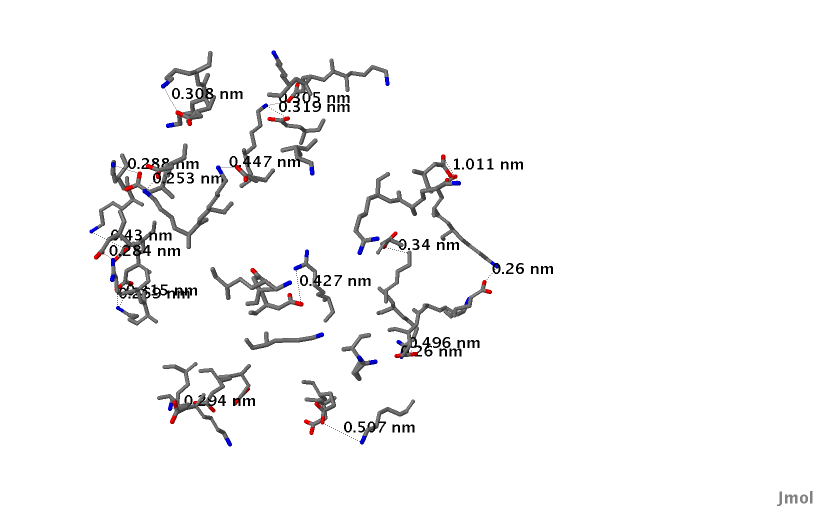
- В белке много солевых мостиков, т.е взаимодействий положительно заряженной аминокислоты с отрицательно заряженной (рис. 13). Изображение одиночного солевого мостика можно посмотреть на рисунке 14.
|
|
Рис.13 Солевые мостики в цепи 1 белка pdaA - общий вид. Синим обозначен атом азота, красным -кислорода, в солевом мостике они заряжены положительно и отрицательно соответственно.
|
|
|
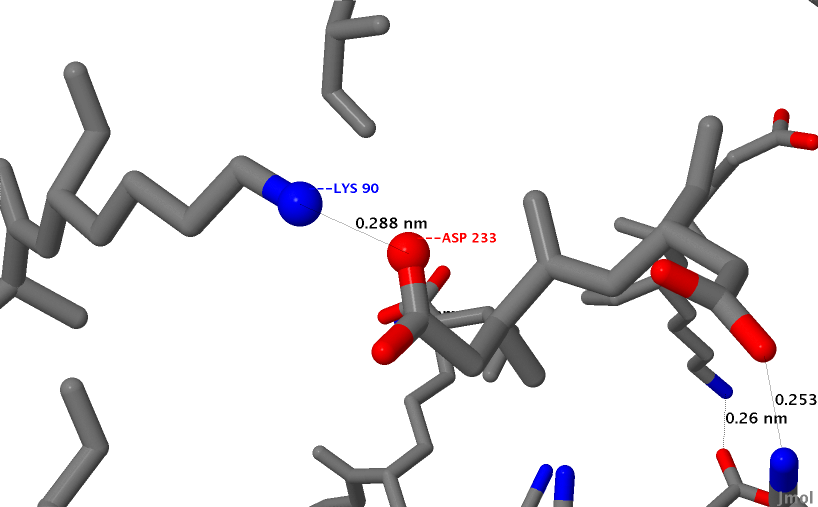
Рис.14 Отдельный солевой мостик из аминокислот лизина и аспаргиновой кислоты. Синим обозначен атом азота, которые в мостике заряжен положительно, а красным - атом кислорода, который в мостике заряжен отрицательно.
|

.png)












