| Главная | Семестры | Проекты | Обo мне | Ссылки | Заметки | Назад к оглавлению |
Особенности мембранных белков
Задание 0
Для трех трансмембранных бета-баррелей и трех трансмембранных альфа-спиральных белков определим параметры. Опишем в табл. 1.
| Таблица 1. Описание трансмембранных белков с известной 3D структурой. При подсчете медианы числа остатков использовался тот остаточк, который погружен в мембрану | ||||||||||||||||||||||||||||||||||
| PDB код | Тип
(спираль, баррель) |
Какая мембрана (внутренняя или внешняя, организм, органелла) |
Толщина гидрофобной части мембраны в ангстремах | Медиана числа остатков в одном трансмембранном участке |
| 3PIK | баррель | Внешняя мембрана Escherichia coli | 24.3 ± 1.2 | 12.5 |
| 1BXW | баррель | внешняя клеточная мембрана E.Coli | 25.4 ± 1.9 | 9.5 |
| 3GP6 | баррель | Плазматическая мембрана Escherichia coli | 24.7 ± 1.5 | 10 |
| 2GFP | спираль | Мембрана эндоплазматического ретикулума Homo sapiens | 29.4 ± 1.1 | 22 |
| 3BEH | спираль | Внутренняя клеточная мембрана Rhizobium loti | 30.6 ± 0.8 | 24 |
| 2BS2 | спираль | Внутренняя мембрана аэробных бактерий | 31.8 ± 0.8 | 23 |
Задание 1: отбор гомологов
Для изучения особенностей мембранных белков был взят белок 3PUV. Изображение с ним можно увидеть на рис. 1.
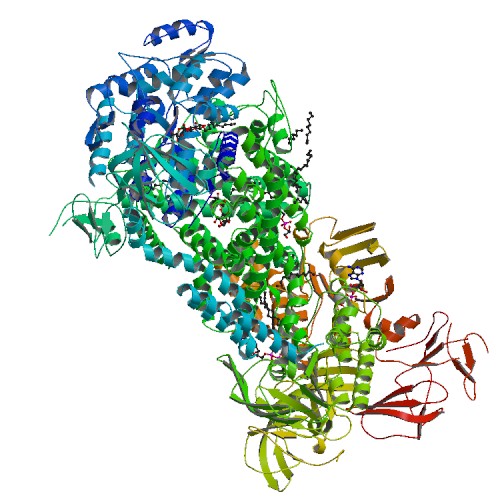 |
| Рис. 1. Изображение белка 3PUV |
Для этого белка отберем его гомологи. Для этого в программе blastp, в качестве исходной последовательности используем белок 3PUV (MALG_ECOLI). Указываем максимальное количество хитов (max target hits) равное 500, исключим белки из того же филума (в поле Organism введем название филума E.coli - Proteobacteria и поставим галочку напротив "Exclude"). E-value у самой худшей находки 4e-39. Вы можете посмотреть: файл с именами выбранных белков, файл с их последовательностями.
Задание 2: анализ структуры выданного белка
В базе данных OPM находим белок 3PUV (см. рис. 1), и заполняем про него таблицу:
| PDB ID | Организм | Тип мембраны | TC-код | Угол наклона спиралей к нормали | Количество трансмембранных спиралей |
| 3PUV/2R6G | Escherichia coli | внешняя бактрериальная мембрана | 3.A.1.1.1 | разный, в среднем 20-30 градусов | 14 (в E и G цепи) |
Описание TC-ID:
3: Primary Active Transporters - основные активные транспортеры
3.A: P-P-bond-hydrolysis-driven transporters - транспортеры связанные с гидролизом Р-Р связи
3.A.1: The ATP-binding Cassette (ABC) Superfamily - АТФ-связывающая касета (ABC) надсемейство
3.A.1.1: The Phage Infection Protein (PIP) Family all uptake system; the Carbohydrate Uptake Transporter-1 (CUT1) Family - белок связанный с инфекцией, семество всех белков захвата вируса; переносчики карбонильной группы
3.A.1.1.1: порядковый номер
В общем случае ТС-код V.W.X.Y.Z расшифровывается так: -V (число) соответствует классу транспортера (то есть, канал, переносчик, работающий отдельно или связанный в цепь) -W (БУКВА) соответствует подклассу транспортера, который в случае первичных активных переносчиков относится к источнику энергии, используемому для управления транспортом -X (число) соответствует семейству транспортера (иногда на самом деле надсемейства) -Y (число) соответствует подсемейству -Z соответствует субстрату или набору транспортируемых субстратов
Задание 3: анализ множественного выравнивания трансмембранных белков
Построим множественное выравнивание отобранных гомологов с помощью программы Muscle. И добавим к нему две новые строки анотации: TM_PREDICTED - участки предсказанные программмой TMHMM для белка-гомолога (Bacillus vireti-WP_024026335.1) и TM_REAL - спирали иследуемого белка (рис. 2). И получили изображение 3.
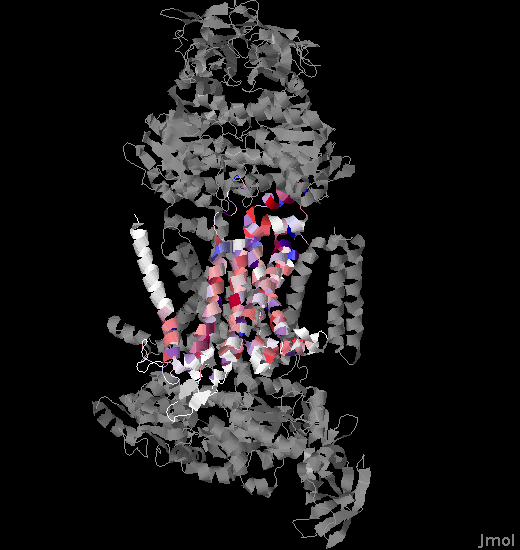 |
| Рис. 2. Изображение белка 3PUV с раскрашенными по выравниванию аминокислотами. |
Консервативны ли в вашем белке участки, относящиеся к трансмембранным спиралям, и какие аминокислотные остатки встречаются чаще в спиралях? Достаточно консервативны (рис. 3), чаще всего встречаются глицин, лейцин, изолейцин, пролин, фенилаланин, валин, серин (треонин, что логично, т.к. они имеют близкое строение), аргинин, глутамин, т.е. в основном гидрофобные аминокислоты включены в трансмембранные спирали.
Консервативны ли участки между спиралями (или, если спираль только одна - цитоплазматический участок)? Да, весьма консерватины, причем в некоторых случаях даже более консервативны, чем сами спирали.
Есть ли в трансмембранных спиралях вашего белка консервативные заряженные или просто полярные остатки? Если да, то как бы вы объяснили их присутствие? Есть, но их очень мало. Так, например, пару раз встречается пролин, что связано с поворотами спирали в этих места, а также аспарагин и аспарагиновая кислота встретились по разу, что имеет какое-то значение, предположительно связанное с функцией мальтозного транспортера.
Лишних спиралей программа TMHMM не нашла, но зато одну не увидела. Поскольку они довольно короткие, то скорее всего эти спирали у белка-гомолога целиком или частично просто заменены на петли, т.к. они, судя по всему, особой роли не играют в формировании структуры. И в целом создалось впечатление, что у Bacillus vireti гомологичный белок компакнее.
Дополнительные задания
Первое. Зная, что размеры клетки E.coli 0,4—0,8 х 1—3 мкм, возьмем среднюю клетку размером 0.6 x 3 мкм, если бы она была шарообразной, то это где-то 1.7 мкм, толщина мембраны 40А = 0.0004 мкм. Предствим, что наша клетка стала размером с дыню, допустим, что эта дыня 25 см, тогда размер мембраны у такой увеличенной клетки будет равен приблизительно 589 мкм, что в 6 раз больше средней толщины человеческого волоса (80-110 мкм) и в 84 раза больше диаметра эритроцита (7 мкм).
Второе. Проверим правило "positive inside" для белка 3PUV и его гомологов. Правило заключается в том, что часть белка, расположенная с n-стороны от мембраны содержит больше положительно заряженных остатков (Lys, Arg, His). Для этого посмотрим на рисунок 3, структуру моего белка в JMol и воспользуемся результатами предсказания программмы TMHMM. И действитльно, правило выполняется, на n-стороне больше положительных остатков, когда как на p-стороне их почти нет.
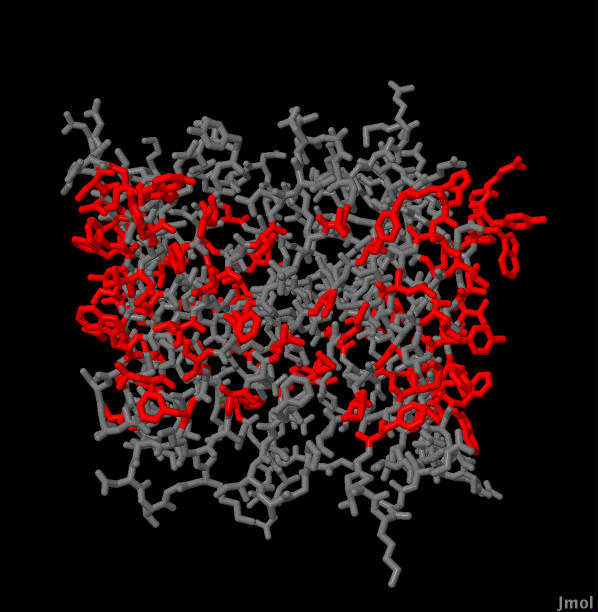
Третье. Проверим, что остатки бета-барреля 2JK4, обращенные в мембрану, гидрофобны. Для этого воспользуемся сервером SheeP и получим карту, на которой красным выделены аминокислотные остатки, у которых боковые цепи направлены наружу, а желтым - внутрь (рис. 4). Затем выделим в JMol направленные наружу (в фосфобилипидный слой) остатки (рис. 5). Как видно из изображения 6 смотрят наружу цепи у неполяных аминокислот в основном, хотя и есть полярные, но они находятся ближе к одной из сторон мембраны, большая часть образуют перегибы.
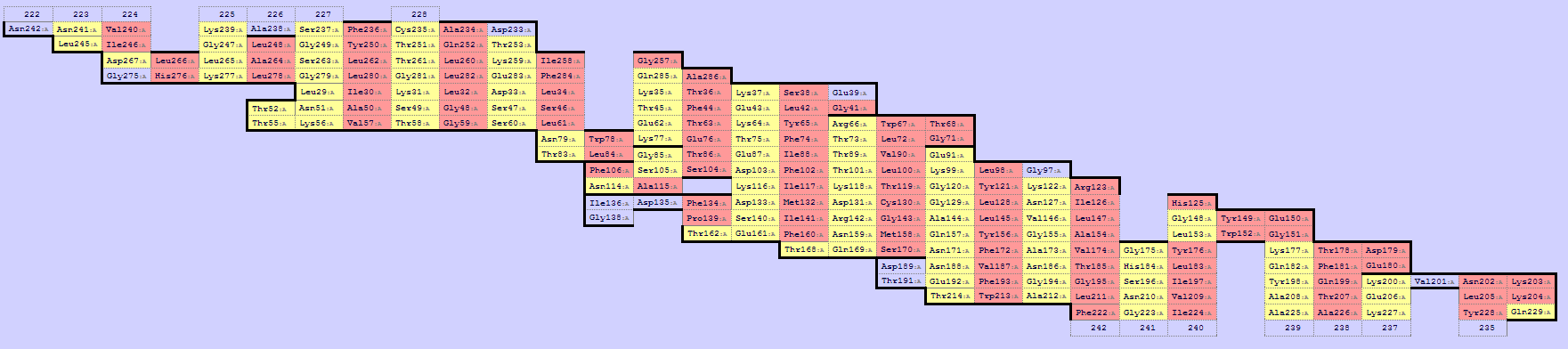 |
| Рис. 4. Результат работы программы SheeP. |