Transcriptional regulator TetR family относится к ДНК связывающим белкам, которые имеют ДНК-связывающие домены и, таким образом, обладают специфическим или общим сродством к одноцепочечной или двухцепочечной ДНК. Они напрямую влияют на геномные функции, главным образом путем выполнения транскрипции, репликации ДНК или восстановления ДНК. Семейство транскрипционных регуляторов TetR (TetR — это тетрациклин-связывающий репрессор) — это группа белков-регуляторов, которые связываются с участками ДНК (опе-раторами) и регулируют экспрессию генов путем связывания с тетрациклинами и индукторами. Члены этого семейства, такие как белки TetR и TetA, способны регулировать экспрессию различных генов, что делает их ценными инструментами в генной инженерии, особенно для создания адаптивных систем контроля экспрессии.
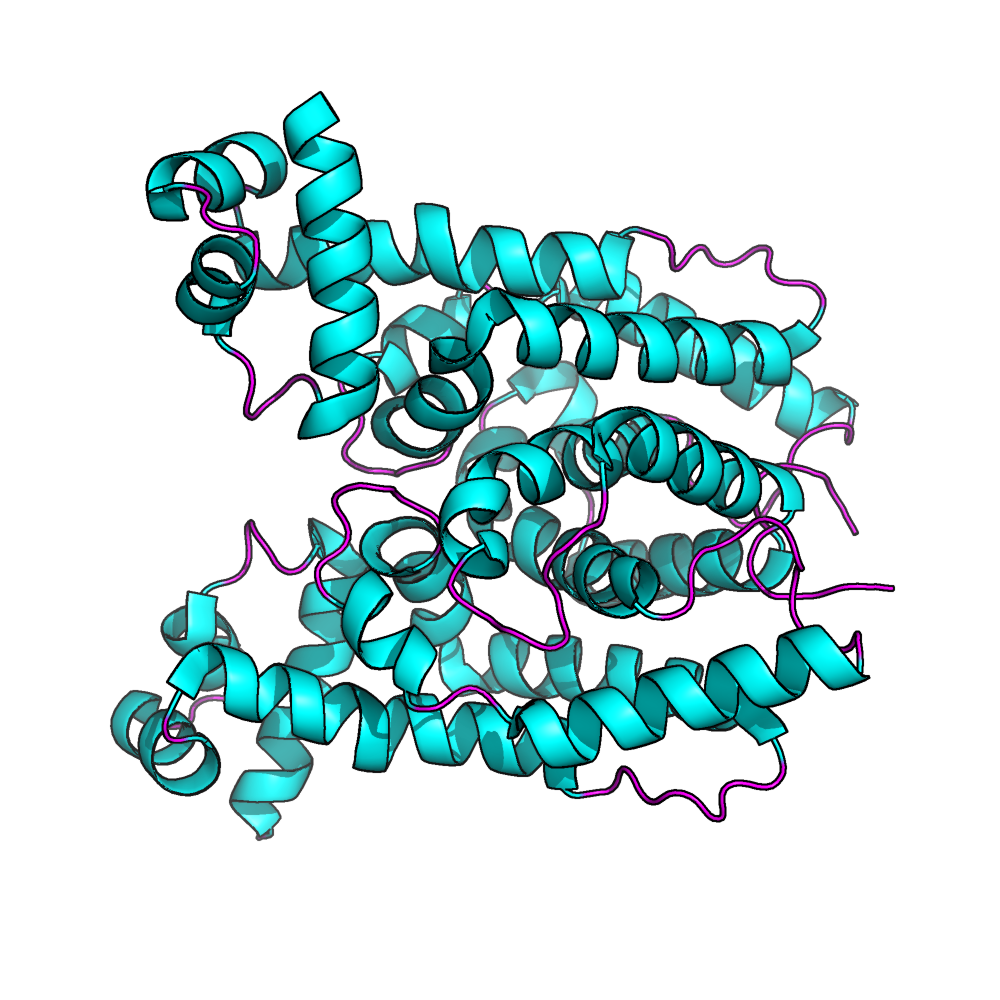
В структуре 2 полимерные цепи (A и B). Они идентичны по последовательности. Биологической единицей является гомодимер, состоящий из этих двух цепей (A и B).
Обзор белка 3S5R.
Структура в целом

Отдельные цепи
Обе цепи относятся были обнаружены в организме Syntrophus aciditrophicus (strain SB), а экспрессировались в кишечной палочке (Escherichia coli). Во вторичной структуре только α-спирали (19)
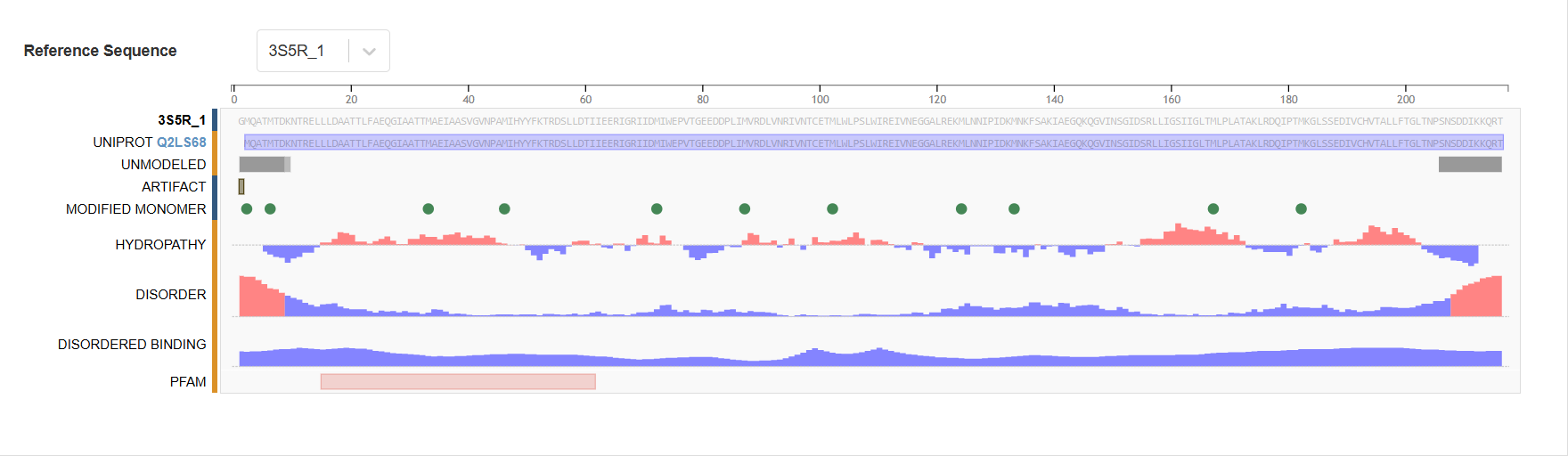
Данные из Uniprot:
Uniprot_id: Q2LS68
Название: Transcriptional regulator TetR family
Функция: DNA binding
Согласно данным Uniprot цепи не содержит мутаций. Есть модифицированные аминокислотные остатки
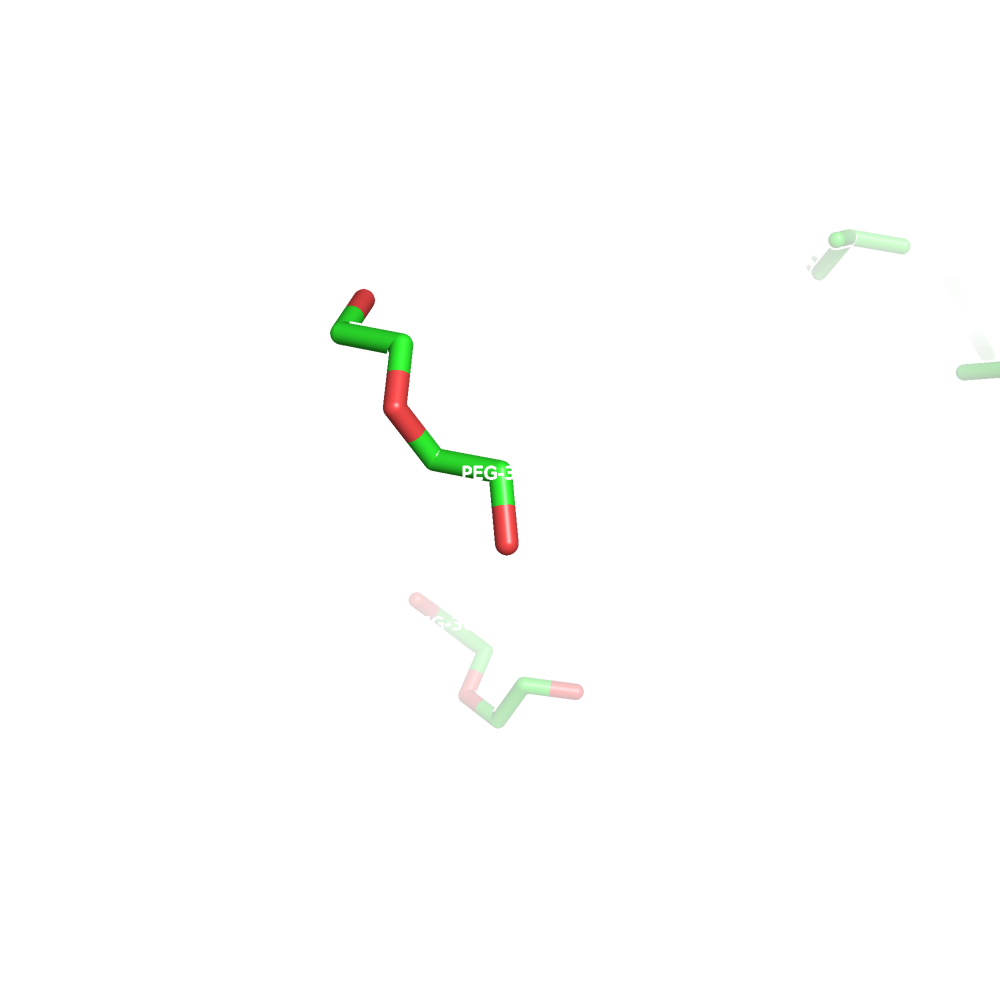
Малые молекулы
В записи о малых молекулах найдено 2 лиганда:
PEG(DI(HYDROXYETHYL)ETHER)
EDO(1,2-ETHANEDIOL)

Взаимодействия в белке 3S5R.
Рассмотрим разные типы связей в молекуле белка 3S5R.
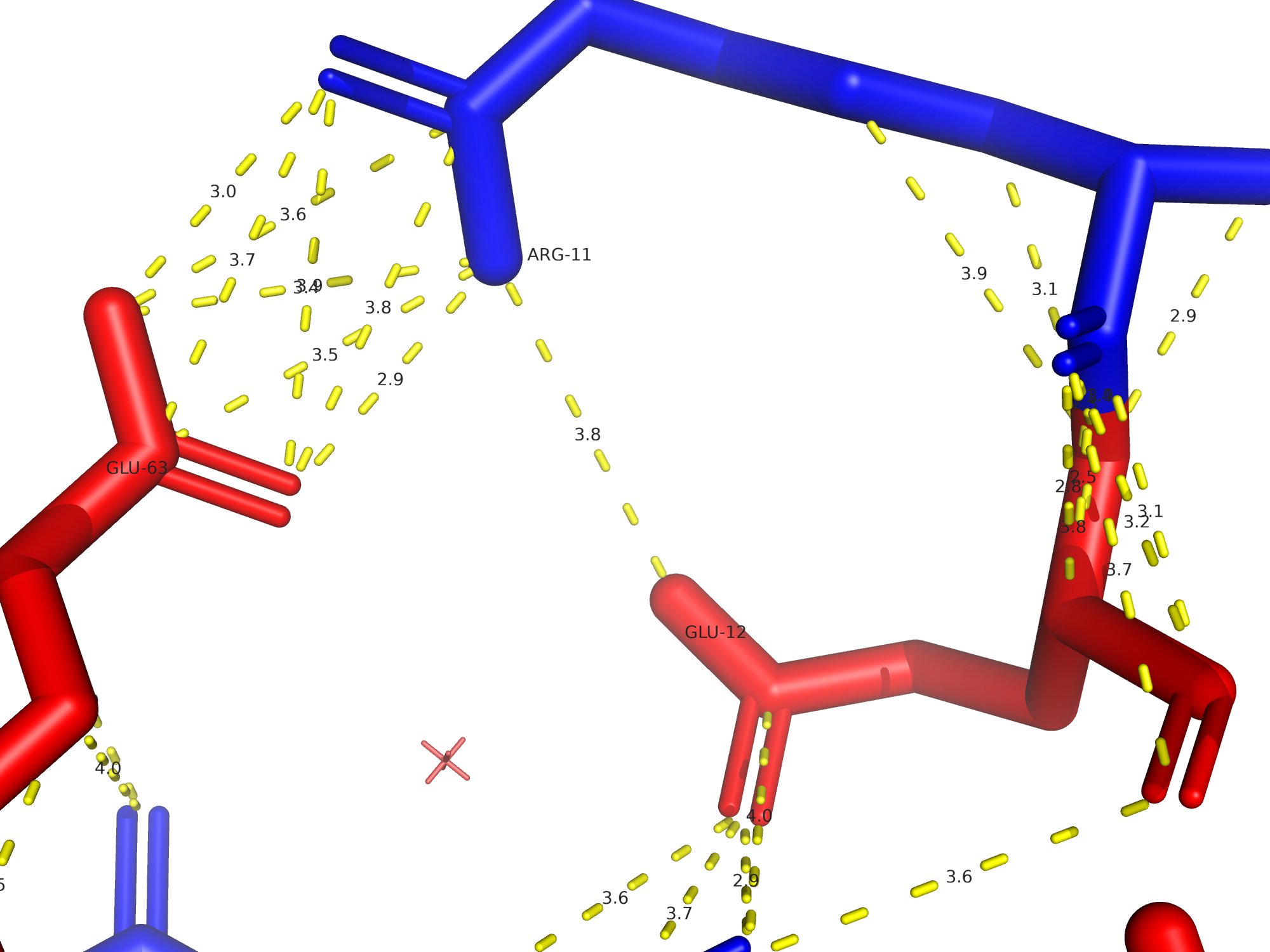
Водородные связи
Посмотрим взаимодействия, затрагивающие атомы остова белка (связи образуются между атомами пептидного остова: N-H (донор) и C=O (акцептор) групп) и затрагивающие атомы боковых радикалов аминокислот (связи образуются с участием боковых цепей аминокислот).

Дисульфидные связи
Дисульфидные связи образуются между двумя цистеинами. Дисульфидные мостики играют ключевую роль в поддержании пространственной структуры белка, скрепляя его различные части и предотвращая распад. К сожалению, в белке 3S5R их нет, поэтому мне не удастся их продемонстрировать.
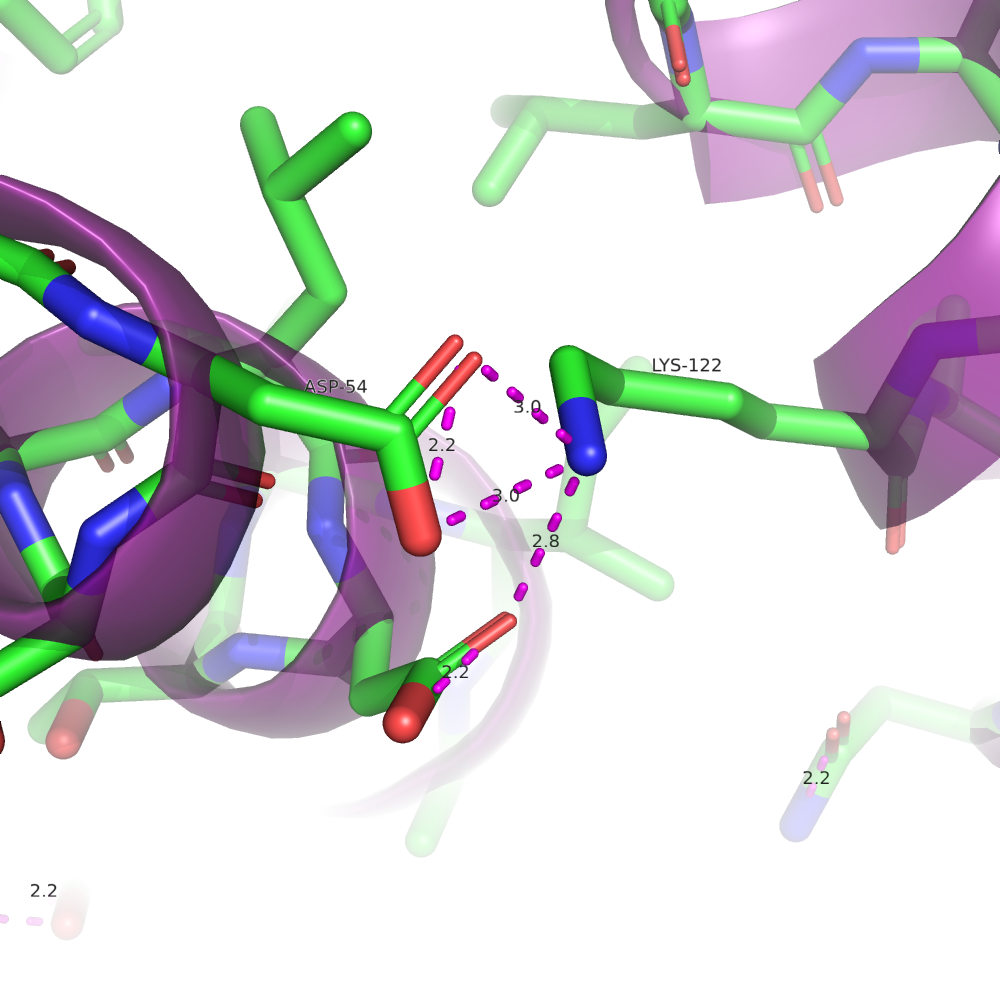
Солевой мостик
Солевые мостики образуются между радикалами положительно и отрицательно заряженных аминокислот. Характерная длина электростатических взаимодействий - 3.5-4 Å. В 3S5R можем наблюдать солевые мостики между аминокислотами GLU-63, GLU-12 и ARG-11.
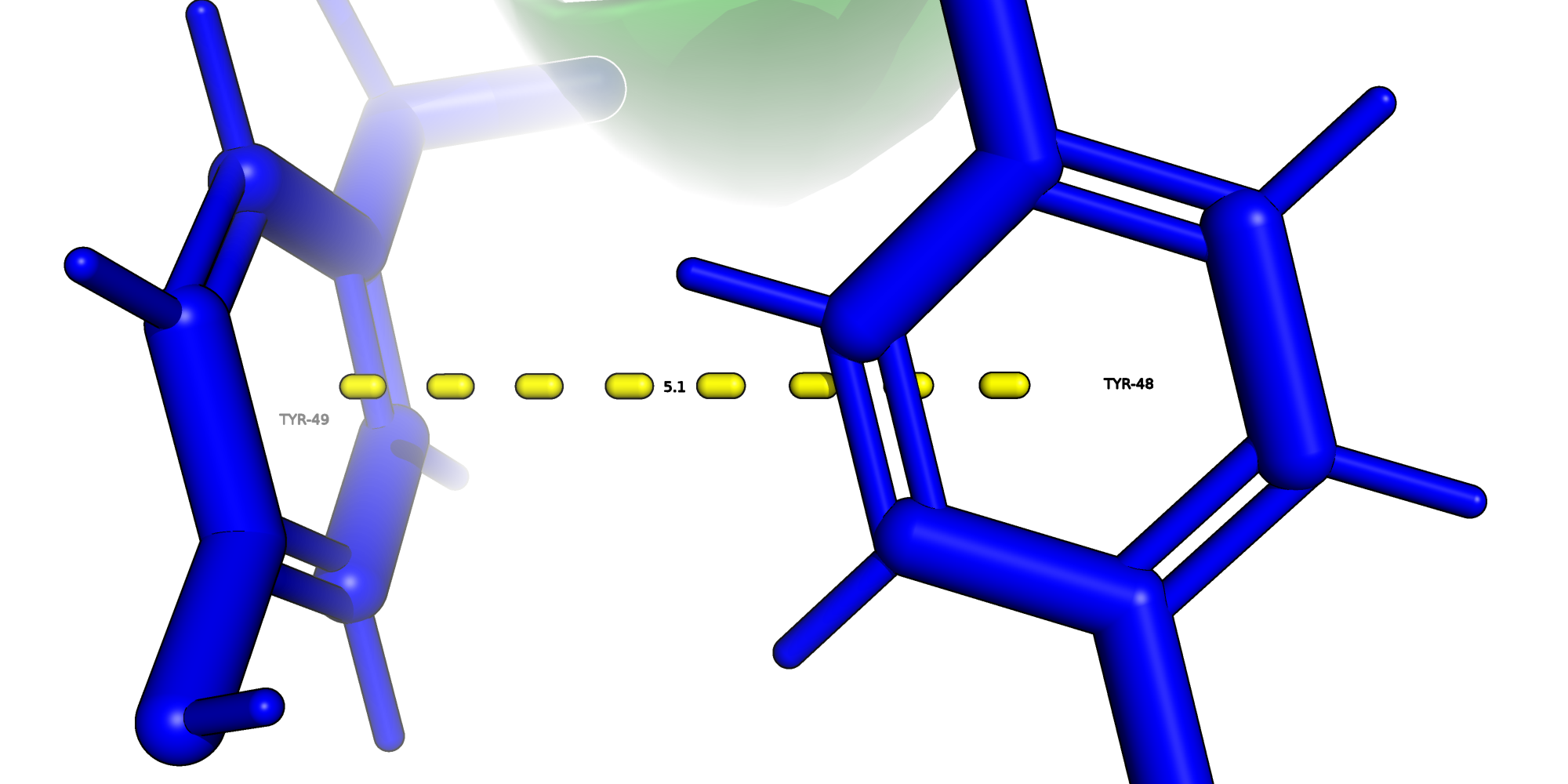
Стекинг
Стекинг - π-π-взаимодействие между ароматических молекул, напоминющее монеты в стопке (stack - стопка) и способствующее стабилизации структуры белка. Характерно расстояние в 4-6 Å. В 3S5R T-стекинг можно наблюдать между TYR-48 и TYR-49.