Навигация по сайту: |
Практикум 1. Визуализация молекул в JMol.
Cреднее значение угла N-O-C (вычислено по данным из вышепредставленной таблицы) для α-спирали составило 152.44°, 147.02° для β-тяжей и 149.73° в среднем. Принимая за идеальное значение 180°, отклонение от идеала составило 27.56°, 32.98° и 30.27° соответственно. Принимая за оптимальную длину водородной связи в α-спирали 2.8 Å[1], получаем среднюю длину 3.24 Å. Не найдя аналогичной идеальной длины для β-тяжей, будем считать ее той же, что и в α-спирали. Средняя длина составила 2.94 Å. В общем, приведенные значения углов и длин согласуются с тем, что обсуждалось на лекции (максимум 3.5 Å, в среднем около 2.8 Å, угол N-O-C = 180 ± 30°). 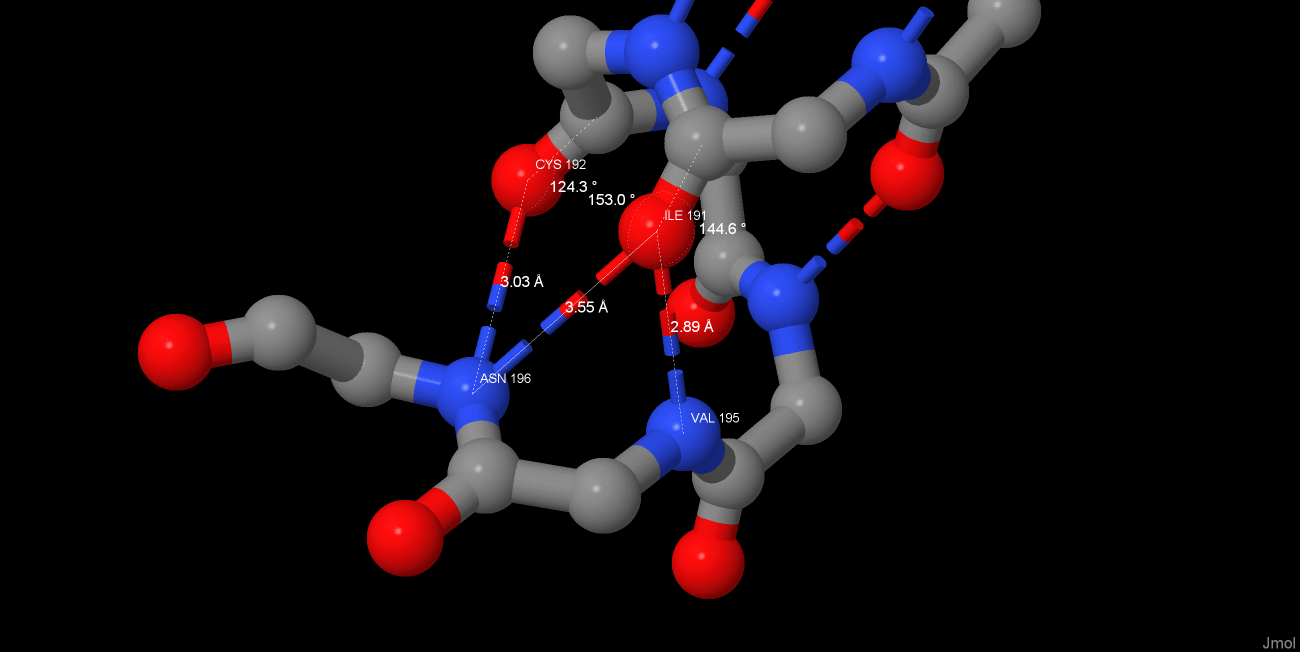
Интересные водородные связи на одном из концов спирали. (Согласно Protein feature view спираль кончается на 194 остатке, а не на 196, хотя из вида cartoons JMol 195 и 196 остатки выглядят как часть спирали). Остовный азот ASN 196 и карбонильный кислород ILE 191 принимают участие сразу в двух водородных связях. Для кислорода это можно объяснить наличием двух неподеленных электронных пар(похожую картину можно увидеть, например, у ARG 81 в β-тяжах на изображении 6. скрипта). Для азота же не совсем понятно, как он может являться донором сразу для двух акцепторов. Возможно, в молекуле белка он делает это поочередно. Литература: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||