Навигация по сайту: |
Альтернативные положения, B-фактор, кристаллЗадание 1. Альтернативные положенияВ этом задании нужно было проанализировать взаимную ориентацию альтернативных положений (альтлоков) остатков Cys162 и Cys175 в структуре 4AF8 (усложненное задание). У каждого остатка имеется по два альтернативных положения, то есть суммарно возможных комбинаций четыре. Какие-то взаимные ориентации могут быть невозможны, какие-то, наоборот, очень выгодны. Попробуем разобраться в них. 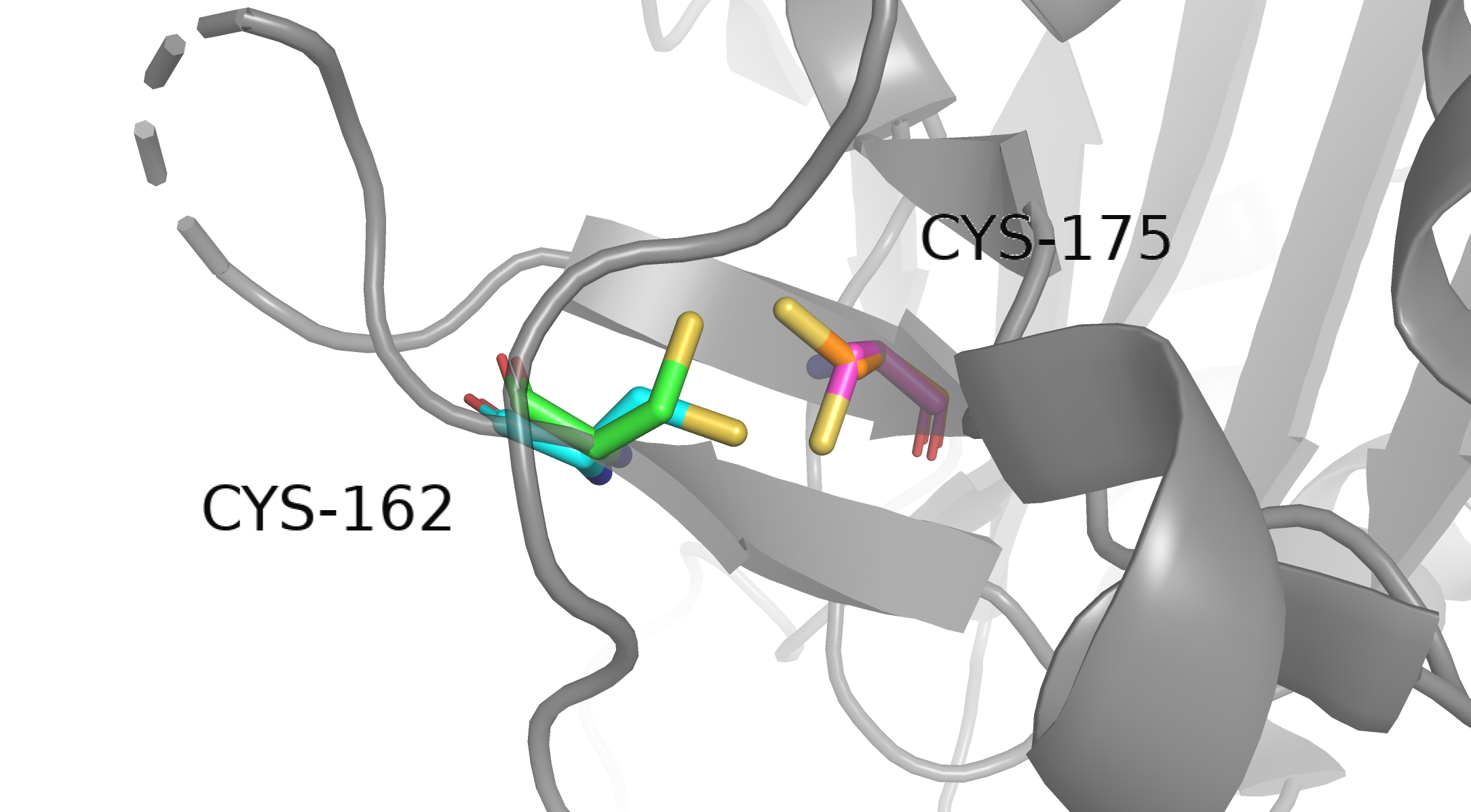
Вот они, голубчики. Разные положения я покрасил в разные цвета, чтобы было удобнее:
Близость двух цистеинов сразу наводит на мысль о возможных дисульфидных связях. Что мы о них знаем из нашей программы? Что они есть. Немного. Обратимся к литературе. Список литературы делать очень запарно, поэтому буду просто давать гиперссылки на статьи и использовать сквозную нумерацию для них. [1]. Древняя статья про связи между атомами серы. Из нее мы узнаем, что отталкивание между соседними 3p орбиталями на атомах серы приводит к тому, что наиболее выгодное значение торсионного угла X-S-S-X (Х — какой-то заместитель) около 90 градусов. Похожую картину мы наблюдаем в пероксиде водорода и гидразине. Звучит логично. Также из статьи мы можем извлечь, что длина связи S-S составляет около 2.05 ангстрем, а Ван дер Ваальсов радиус для пары атомов серы составляет 1.6-1.8 ангстрема. Отлично. Теперь мы знаем, как выглядят дисульфидные связи в простых молекулах (в [1] анализировалась молекула H2S2). А как они выглядят в белках? [2]. В введении обзора по инженерии дисульфидных связей в белках сообщается, что наиболее частые значения торсионного угла СН2-S-S-CH2 это −87° и +97°. Значения отличаются от [1], но на мой взгляд не сильно. Кстати в этом обзоре пишут, что введение новой S-S связи в белок может привести к его дестабилизации, что необычно. Посмотрим на хрестоматийный пример дисульфидных связей в инсулине (PDBID: 1PID). В структуре инсулина они удерживают две полипептидные цепи вместе и потому очень важны для целостности белка. 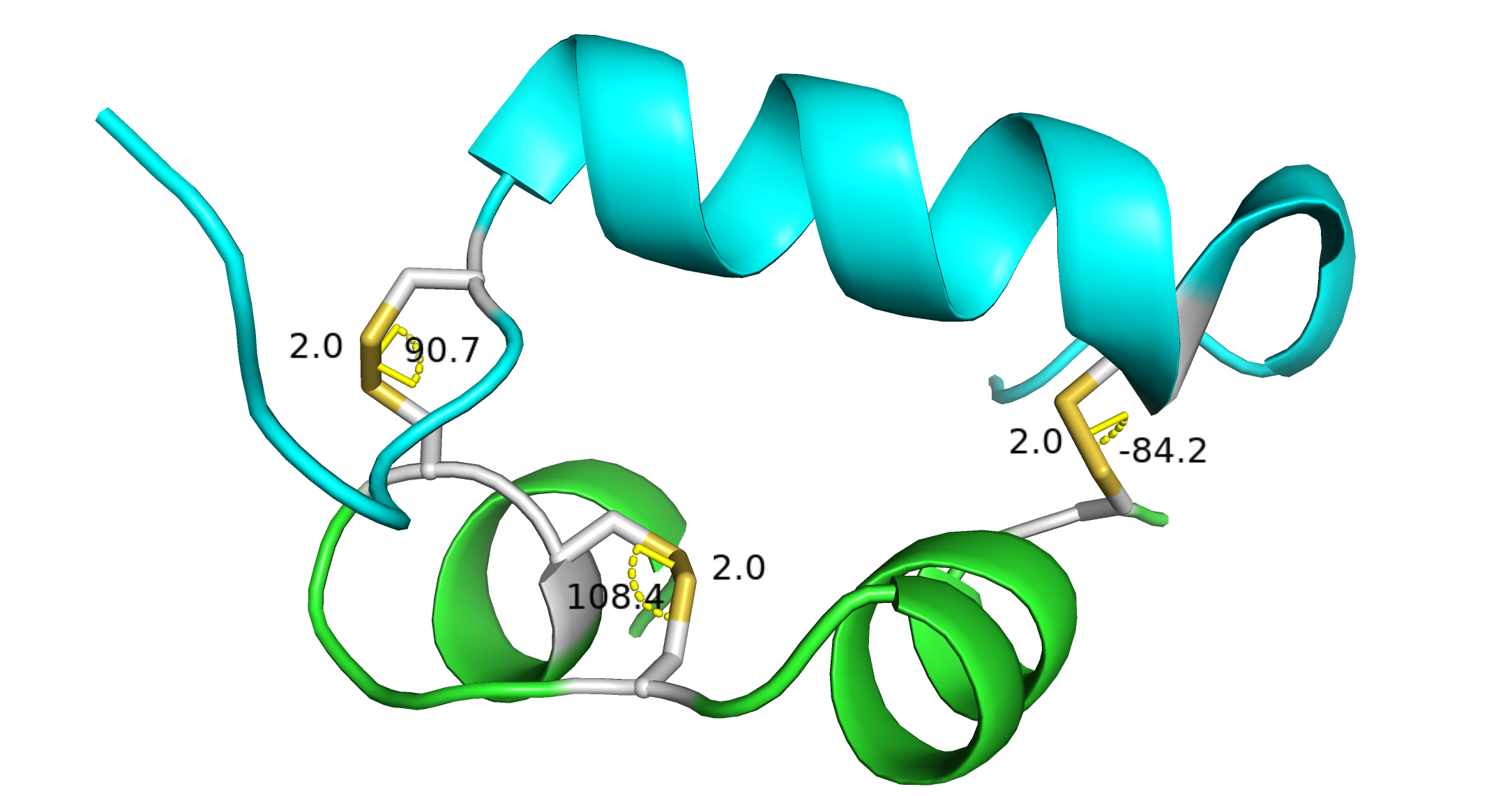
Дисульфидные связи в инсулине. Вот такие они квадратненькие. Длина связи S-S составляет 2 ангстрема. В двух случаях угол близок к 90 градусам, в одном случае довольно существенно отклоняется (108 градусов). Вернемся к нашему белку. Какая у нас геометрия потенциальных дисульфидных связей? 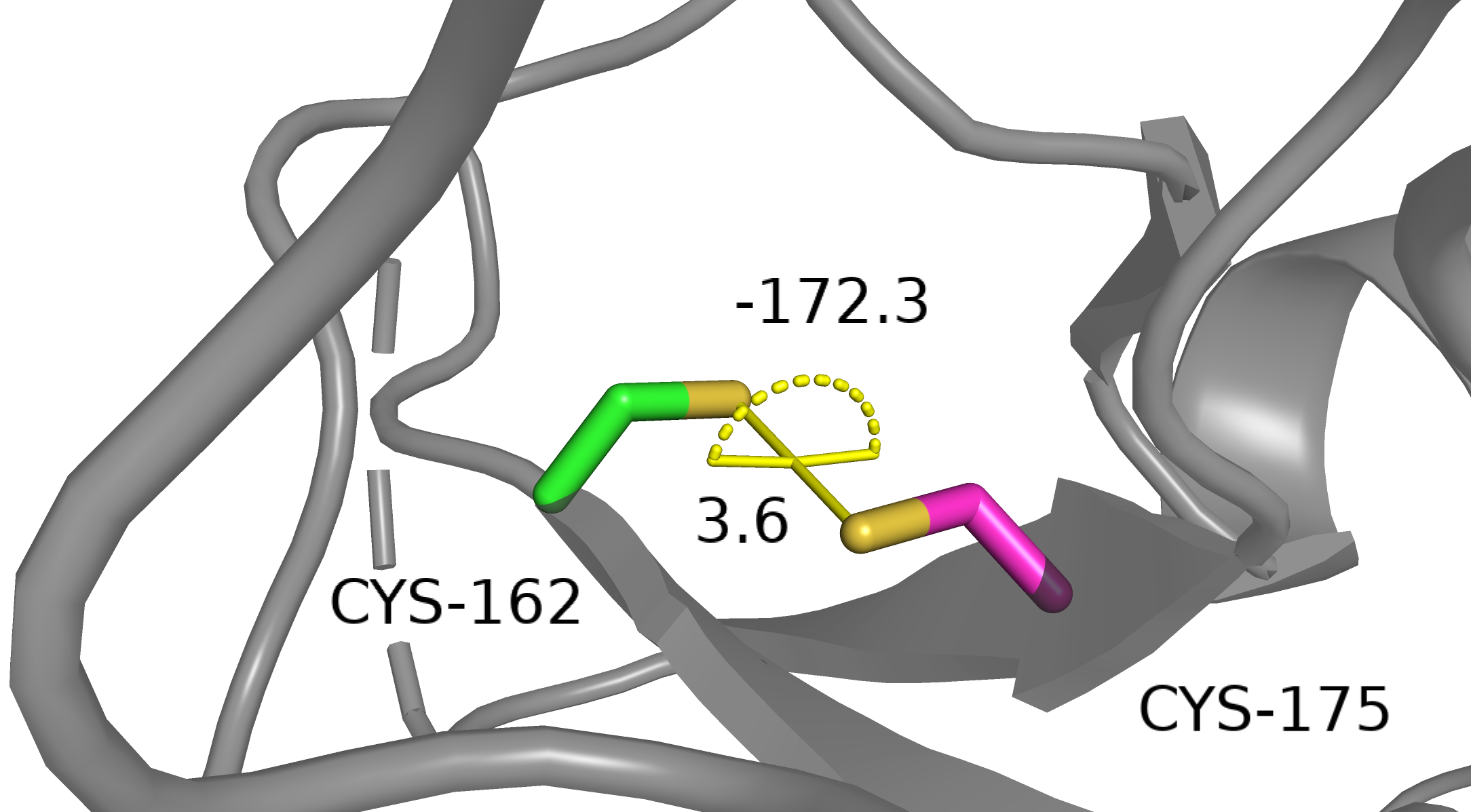
Cys162-A и Cys175-A. По расстоянию между серами — VdW контакт и не более, по торсионному углу — полный фейл: при 180 градусах большая энергия в H2S2 [1]. 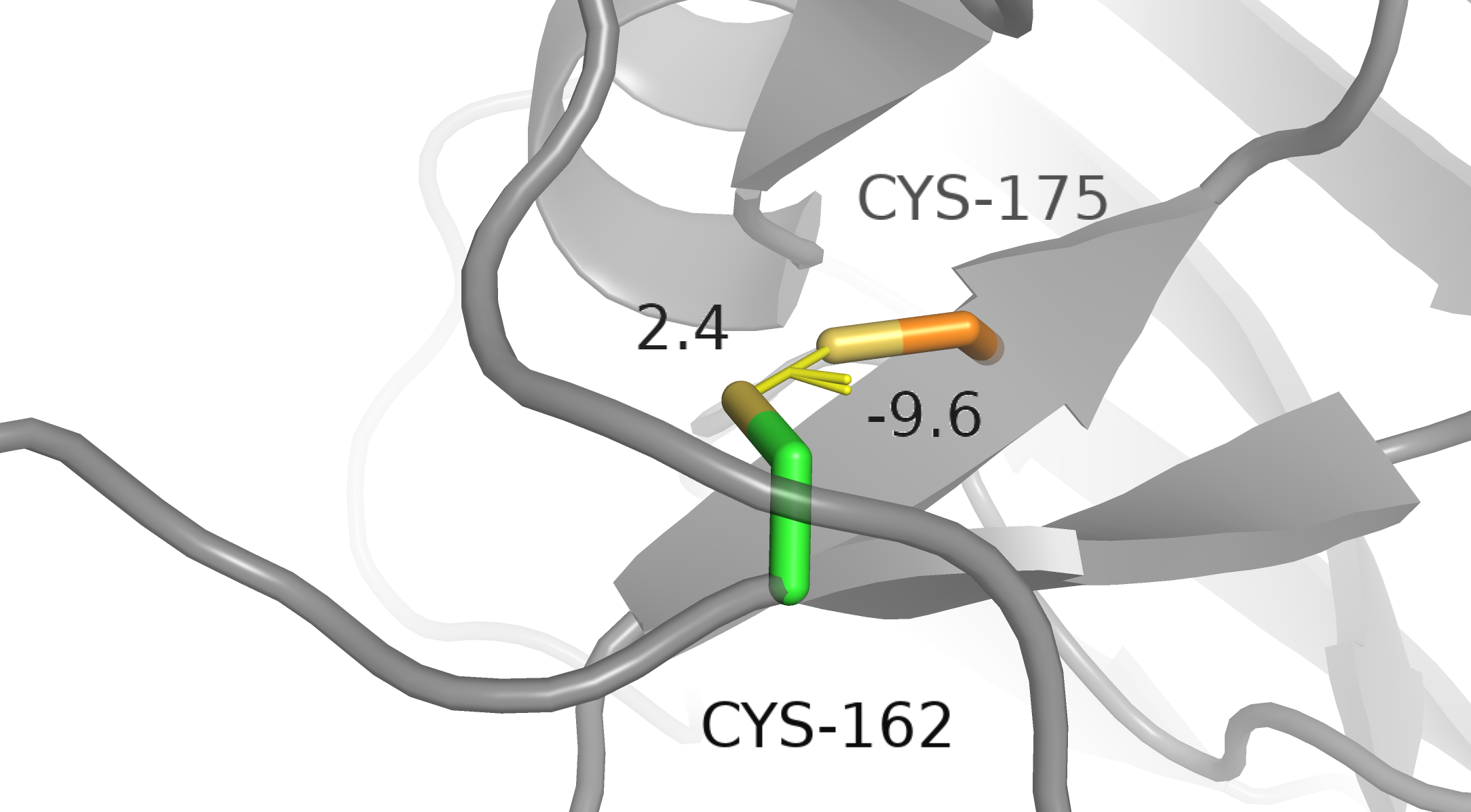
Cys162-A и Cys175-B. По расстоянию между серами — что-то непонятное, но не ковалентная связь, по торсионному углу — еще хуже: при 0 градусов энергия в H2S2 еще больше, чем при 180 градусах, потому что добавляется отталкивание заместителей (в нашем случае метиленовых групп) [1]. 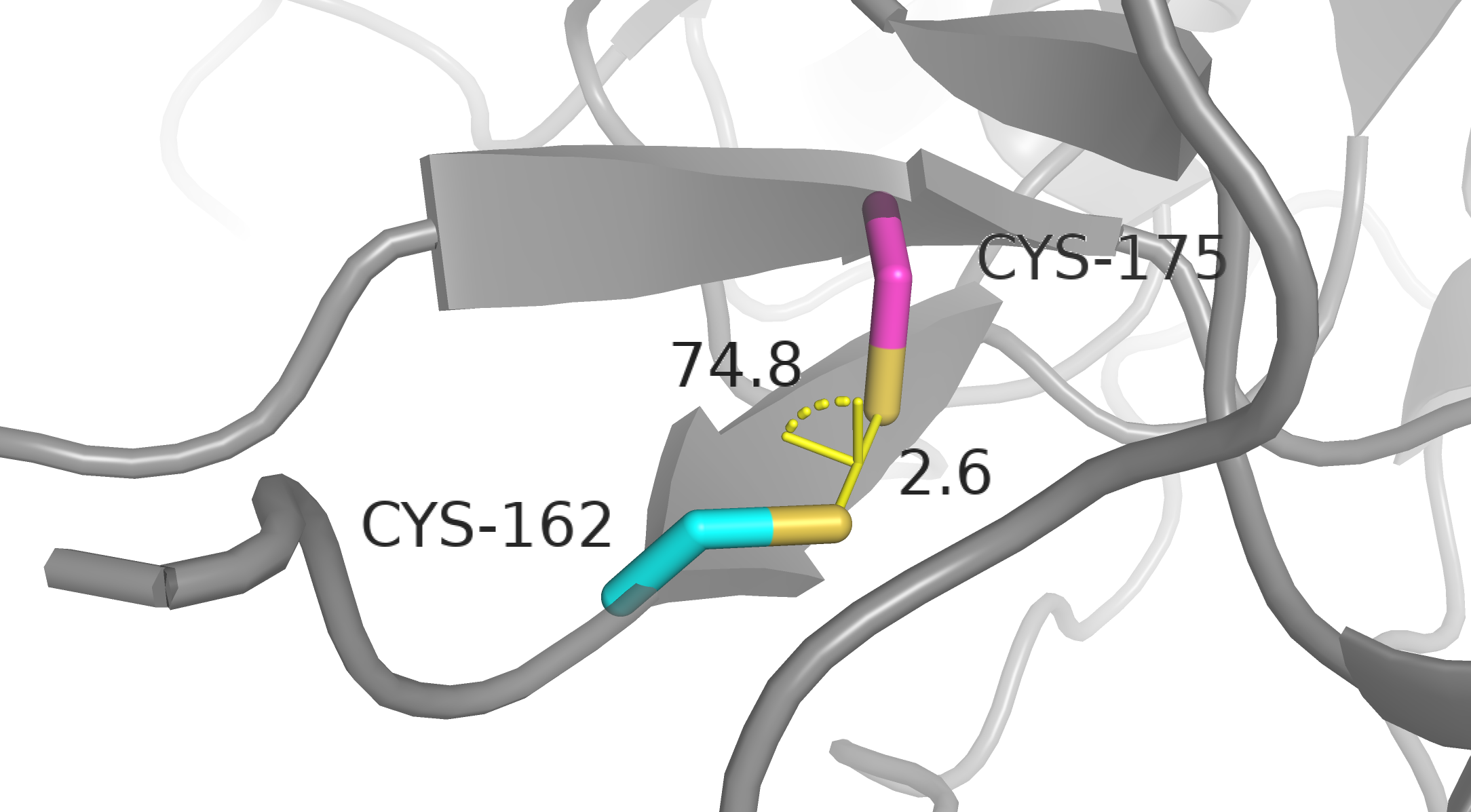
Cys162-B и Cys175-A. По расстоянию между серами — не ковалентная связь, торсионный угол отдаленно напоминает заветные 90 градусов. 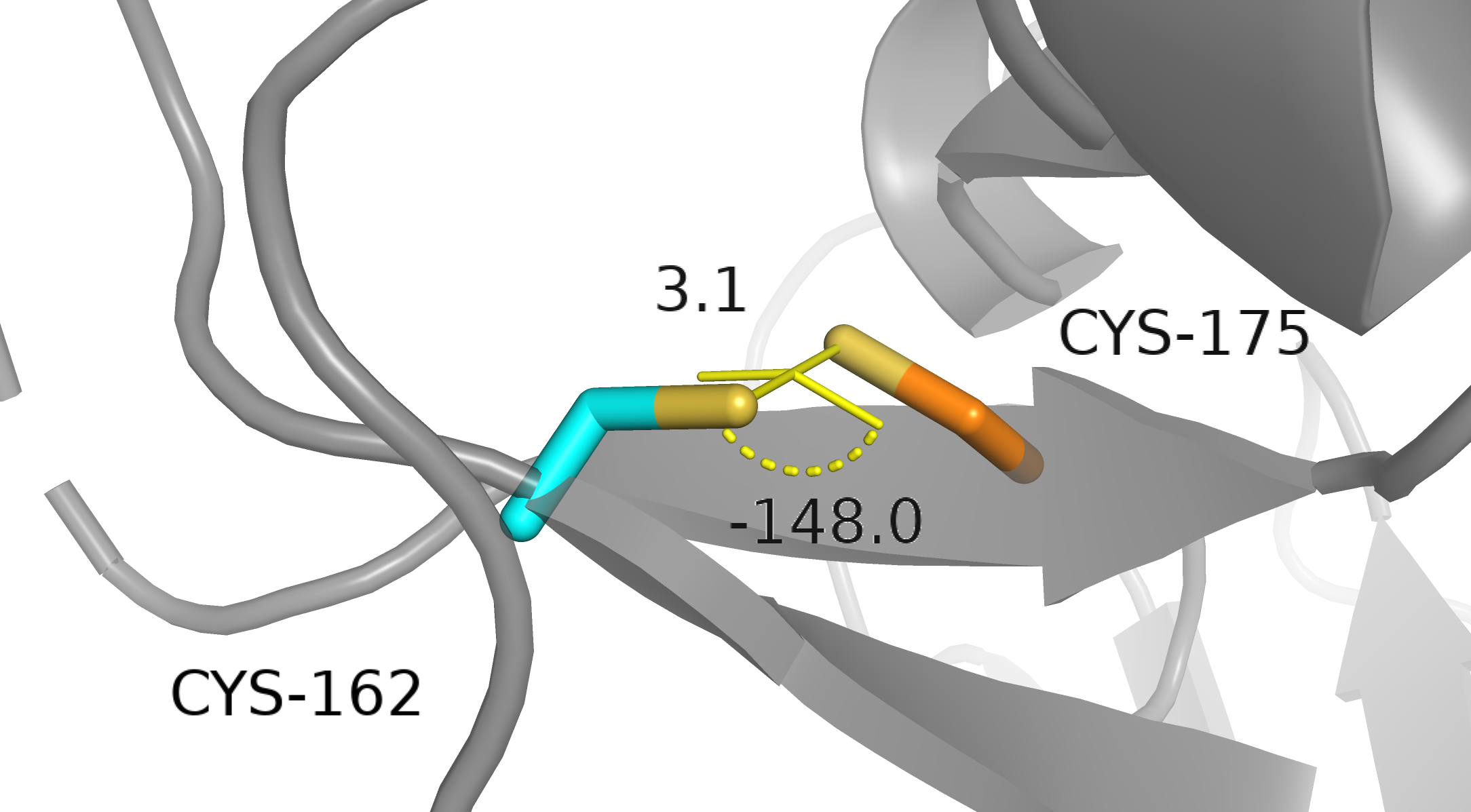
Cys162-B и Cys175-B. По расстоянию между серами — не ковалентная связь, торсионный угол плохой. Из геометрических соображений можно уверенно сказать, что дисульфидной связи мы нигде не наблюдаем. Вообще, проверить наличие ковалентной связи можно, элементарно посмотрев на электронную плотность. Сравним плотность дисульфидной связи из инсулина (структура 2A3G, потому что для 1PID плотность потерялась) и то, что есть у нас. Будем смотреть на уровене подрезки 2 и carve = 2.5. 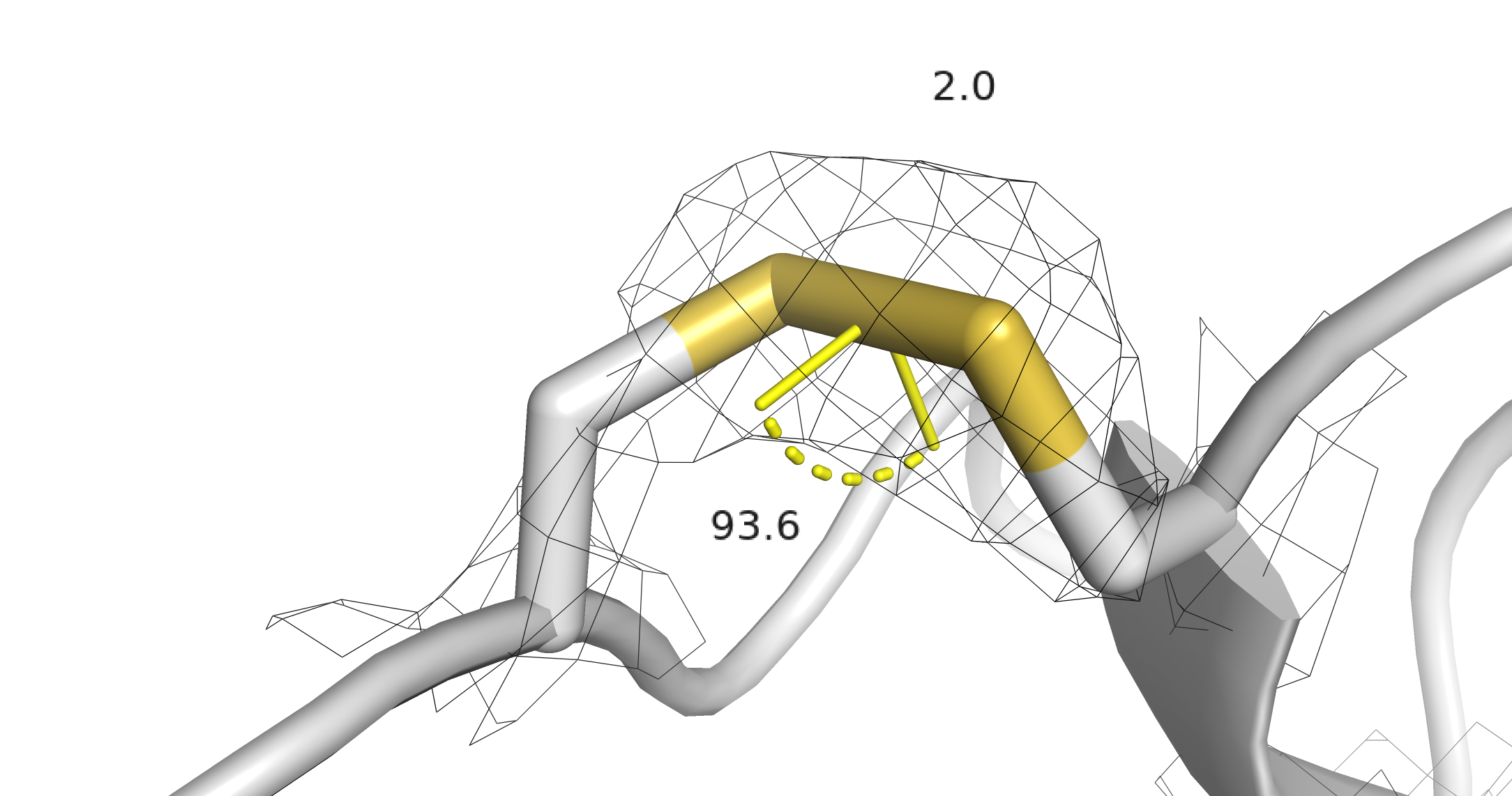
Электронная плотность и геометрия дисульфидной связи в структуре 2A3G. 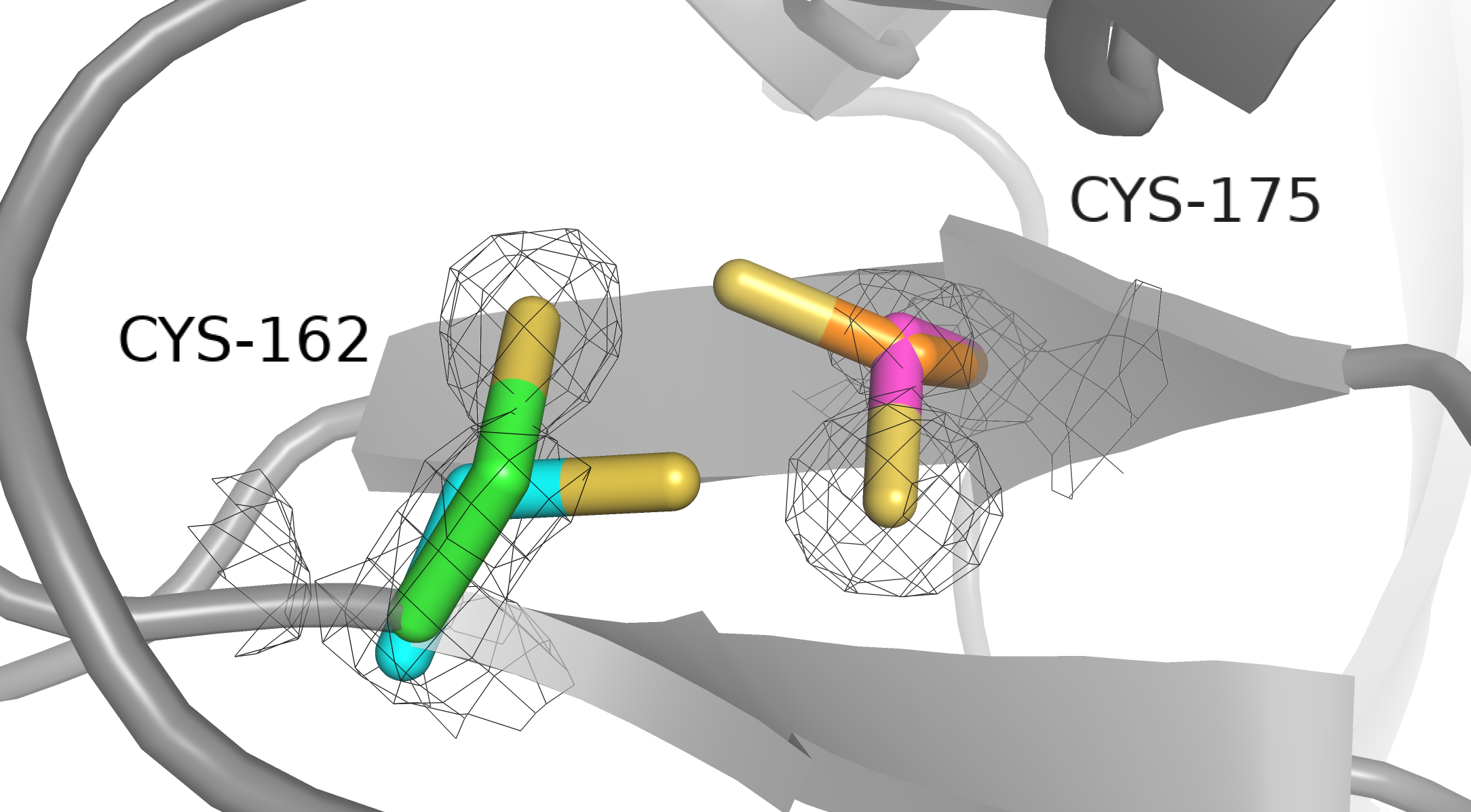
Электронная плотность в районе наших цистеинов в 4AF8. Как мы видим, в нашей структуре (которая, к слову, имеет более лучшее разрешение, чем 2A3G) электронной плотности, которую можно было бы отнести к дисульфидной связи, мы не видим. А про себя замечаем, что комбинация Cys162-A и Cys175-A покрыта плотностью намного лучше всех остальных. Можно ли сделать из наблюдаемого окончательный вывод, что дисульфидной связи между цистеинами точно нет? Наверное, можно, но есть одна вещь, которую надо учитывать при спорных ситуациях с дисульфидными связями: возможность радиационного повреждения. Дело в том, что помимо рассеяния ренгеновское излучение выбивает электроны с атомов в кристалле (фотоэффект) [3]. Классная книжка по белковой кристаллографии, глава 20. В результате образуется высокоэнергетический электрон, летящий внутри кристалла. Этот электрон способен вызвать вторичную ионизацию у атомов, рядом с которыми он проходит. 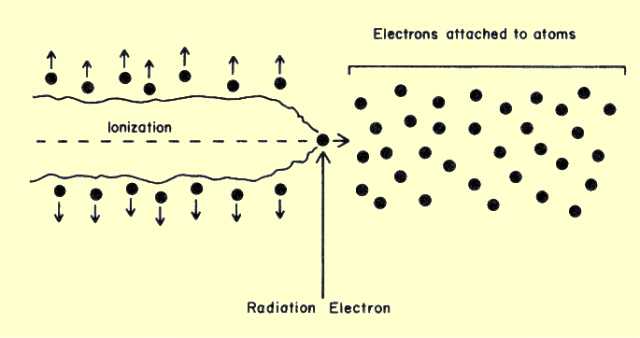
Вторичная ионизация атомов фотоэлектроном в кристалле. Источник. Таким образом, в кристалле появлется множество свободных электронов, которые могут поглощаться в том числе дисульфидными связями (подчеркну: не только ими [3]). В результате образуется анион-радикал [RSSR]•-, расстояние S-S увеличивается [4]. Статья, в которой с одного кристалла строили много структур и наблюдали удлинение связи S-S, наблюдения сравнивали с квантовыми расчетами. Дальнейший захват водорода из окружающего растворителя приводит к разрыву связи S-S, возможному появлению альтернативных конформаций [5]. Более поздняя статья, в которой отмечают появление альтлоков. Интересно, что склонность дисульфидной связи к повреждению положительно коррелирует с её доступностью растворителю. Авторы связывают это с тем, что водород переносится с воды [4,5]. Наша пара цистеинов как раз расположена близко к поверхности белка. В [4,5] речь идет о синхротронном излучении, конкретно о неких "синхротронах третьего поколения". Синхротрон, который использовался для получения структуры 4AF8 как раз из таких. Примечательно, что в [5] появление альтлока описано только в случае одного цистеина дисульфидного мостика, второй цистеин остается на месте. Не разобрался с чем это связано. Может быть, это может указать на то, что дисульфидного мостика у нас тут не было, потому что у нас второй цистеин тоже образует альтлок. Короче говоря, по геометрическим критериям настоящего мостика нигде не видно. Электронной плотности связи S-S тоже не наблюдаем. Больше всего на дисульфидный мостик похожа комбинация Cys162-B и Cys175-A, но она не поддерживается по электронной плотности: альтлок Cys162-B плохо покрыт плотностью. Длина связи в этом случае больше длины ковалентной связи S-S, что похоже на описываемое в [5] увеличение расстояния. Причем, оно, скорее всего, не связано с поглощением электронов, а связано с какими-то движениями белка. Честно говоря, мне не очень понятна релевантность использованных в [4,5] уровней излучения к нашему случаю. Поэтому рассматривать гипотезу дисульфидной связи я больше тут не буду, слишком много к ней вопросов и слишком сложно :D. Ковалентная связь — сильное взаимодействие. Если мы исключаем его из рассмотрения, то стабильность той или иной конформации определяют взаимодействия цистеинов с окружением: [6]. водородные связи с участием цистеина и [7]. сера-дисульфидное взимодействие, которое могло бы дополнительно стабилизировать дисульфидную связь Cys162-B и Cys175-A, но мы уже решили, что дисульфидную связь мы не рассматриваем. Посмотрим на окружение каждой комбинации. На лекции было сказано, что полярные протоны паймол добавляет плохо, хотя в случае аргинина, глутамина, аспарагина и остовного азота добавить протоны "не туда" нельзя: там азоты все имеют sp2 гибризидацию, никакие связи не крутятся и все понятно. Если протон не сидел на "хороших" местах, куда паймол бы его правильно добавил, а на картинке он есть, то это значит, что я его добавил и двигал руками. Ван дер Ваальсовы радиусы показаны в виде сфер, прозрачных или не очень. Согласно [6], когда цистеин участвует в водородной связи в качестве акцептора водородной связи(то есть участвует своей неподеленной парой), расстояние S•••H составляет 2.80±0.26 ангстрем(таблица 4 из [6]). Когда цистеин участвует в качестве донора (предоставляет свой водород), расстояние составляет 2.51±0.3 ангстрем(таблица 3 из [6]). Водородная связь S-H•••S имеет длину 2.55±0.47 ангстрем(таблица 6 из [6]). Будем ориентироваться на эти значения. 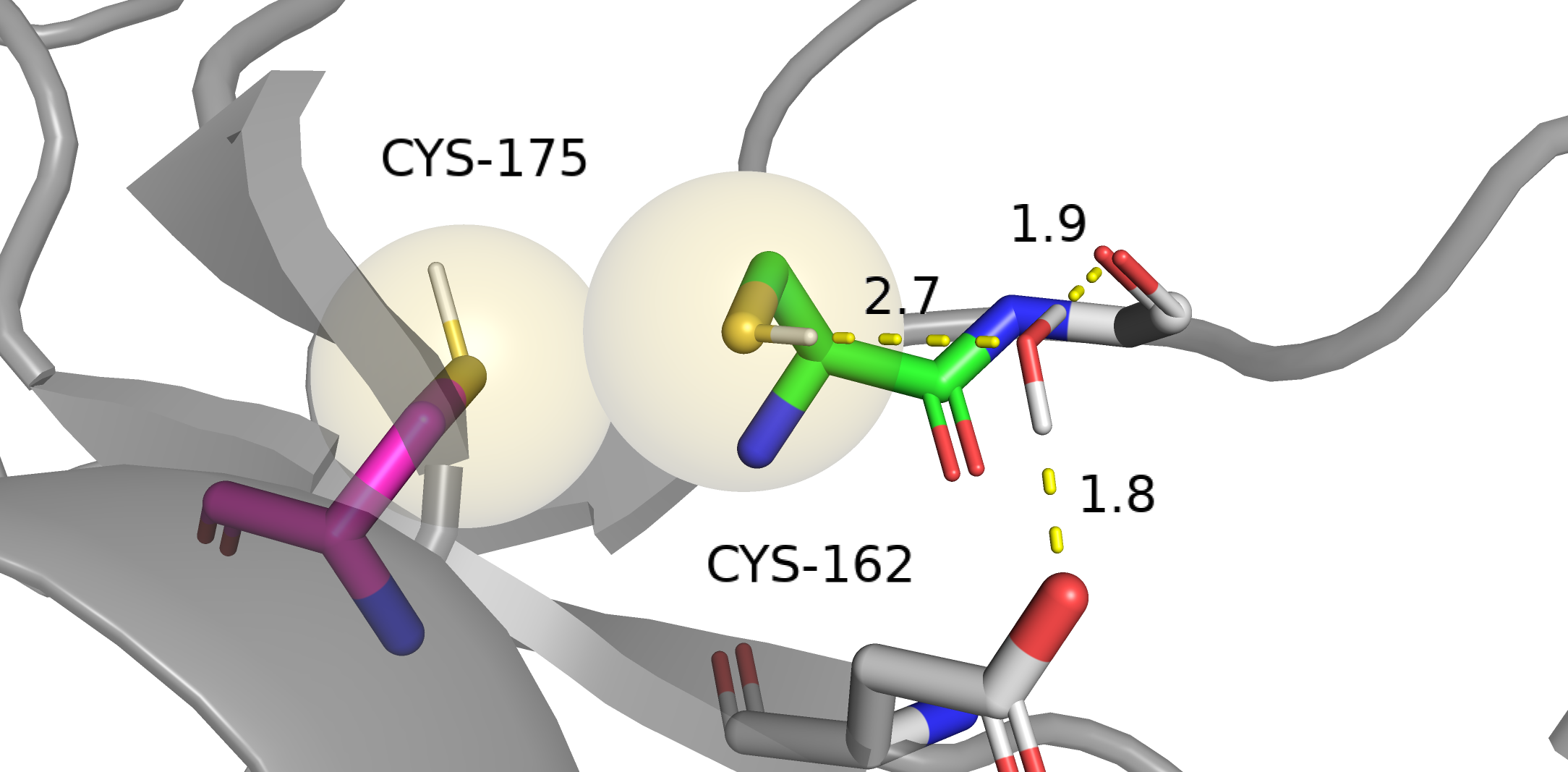
Cys162-A и Cys175-A. Как приметили ранее, расстояние между серами примерно соответствует двум VdW радиусам серы. Следовательно, имеем VdW контакт. На этой картинке фокус на водородной связи Cys162-A и воды. Вода удерживается двумя водородными связями с остовом и радикалом аспарагиновой кислоты. Расстояние между протоном цистеина и кислородом воды лежит в диапазоне 2.51±0.3, считаем, что тут есть водородная связь. 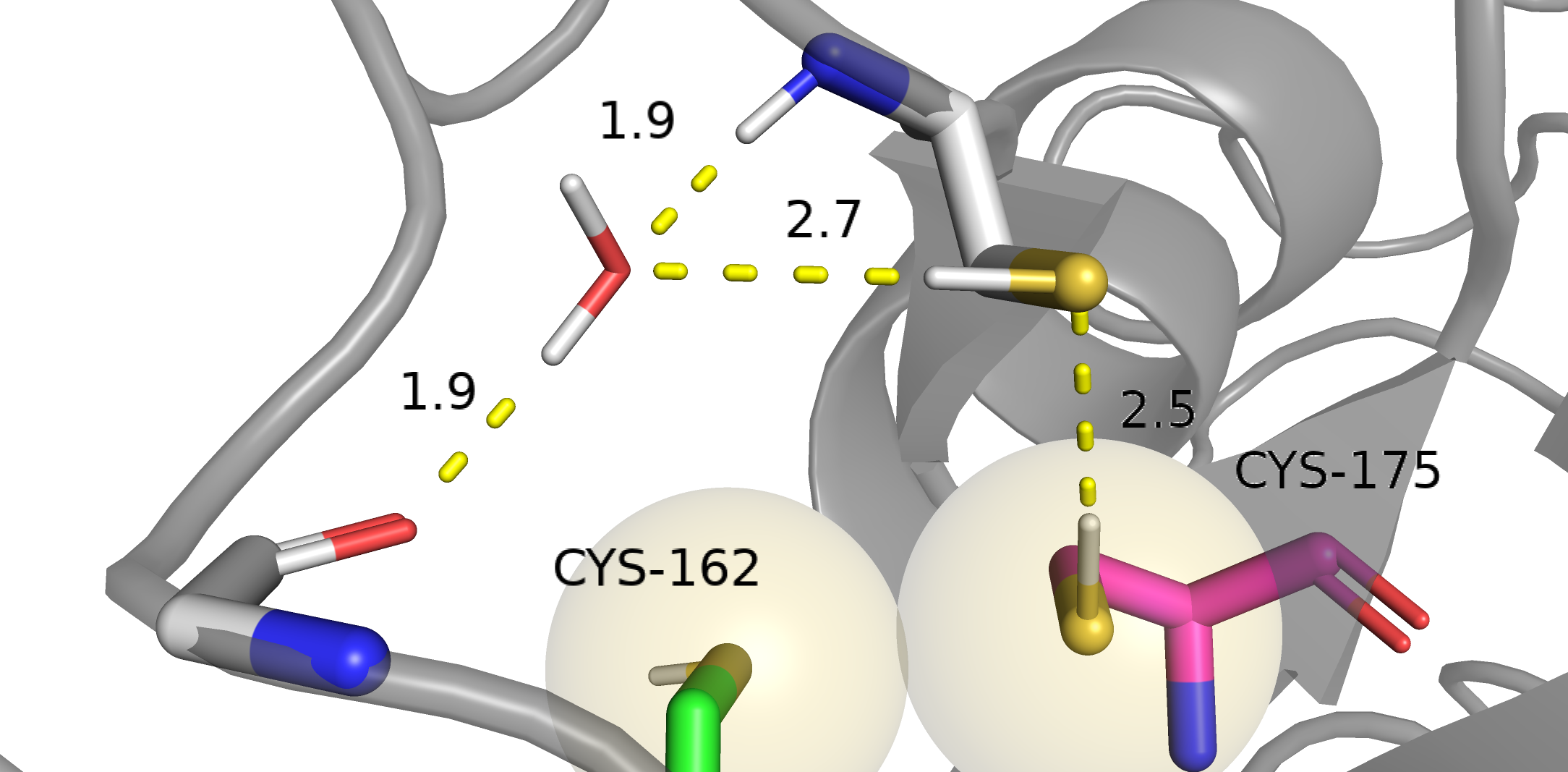
Cys162-A и Cys175-A. На этой картинке фокус на водородной связи Cys175-A и соседнего цистеина. Предполагаю, что этот соседний цистеин в свою очередь смотрит на воду, которая вновь удерживается водородными связями с остовом. Водородные связи цистеинов в норме. 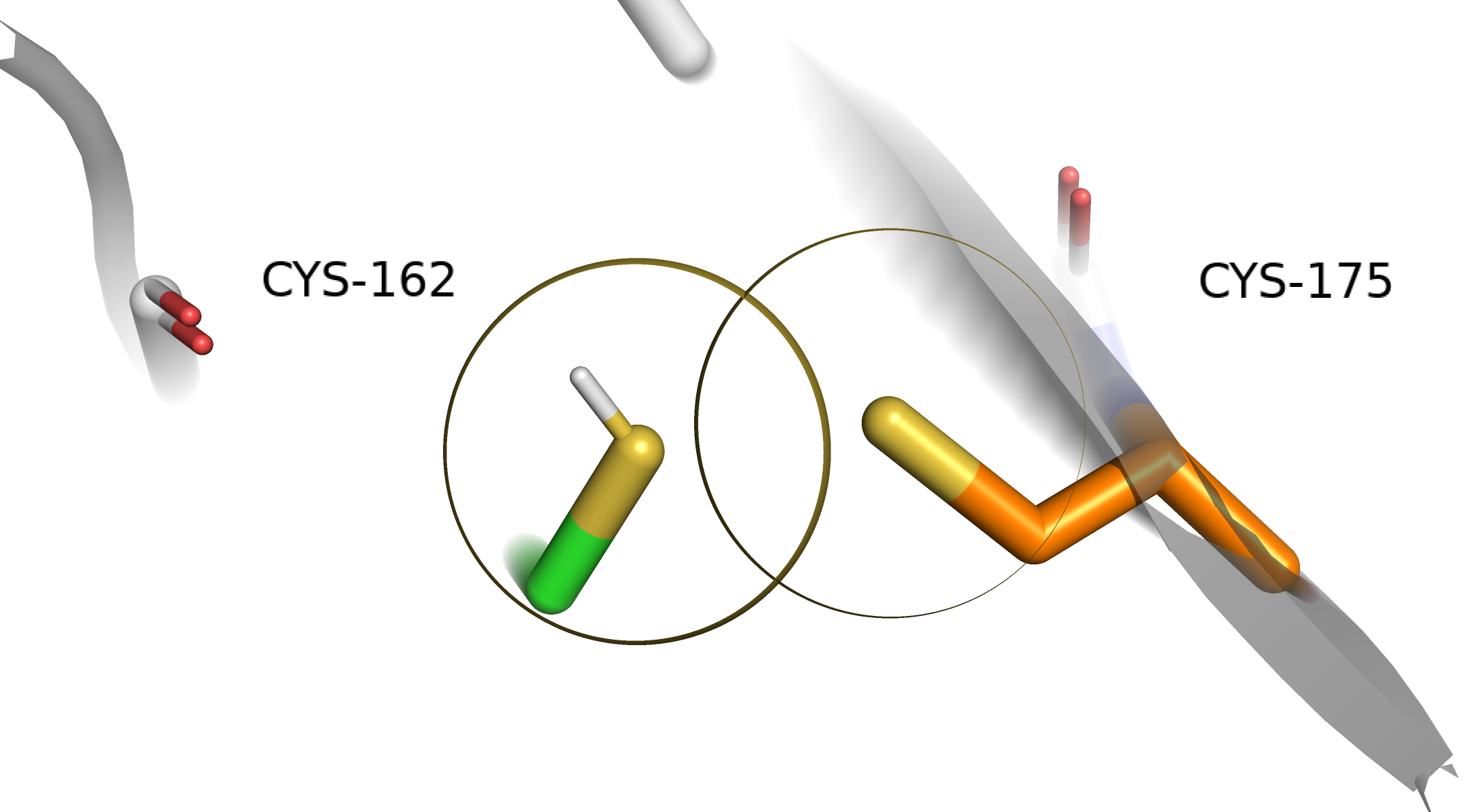
Cys162-A и Cys175-B. Видим перекрывание VdW радиусов. Поскольку от гипотезы дисульфидной связи мы отказались, больше нечем объяснить такое близкое расстояние. Если попробовать объяснить такое расстояние водородной связью, то окажется, что расстояние между протоном и атомом серы акцептора меньше, чем 2.55±0.47 ангстрем. Следовательно, такая комбинация невозможна. 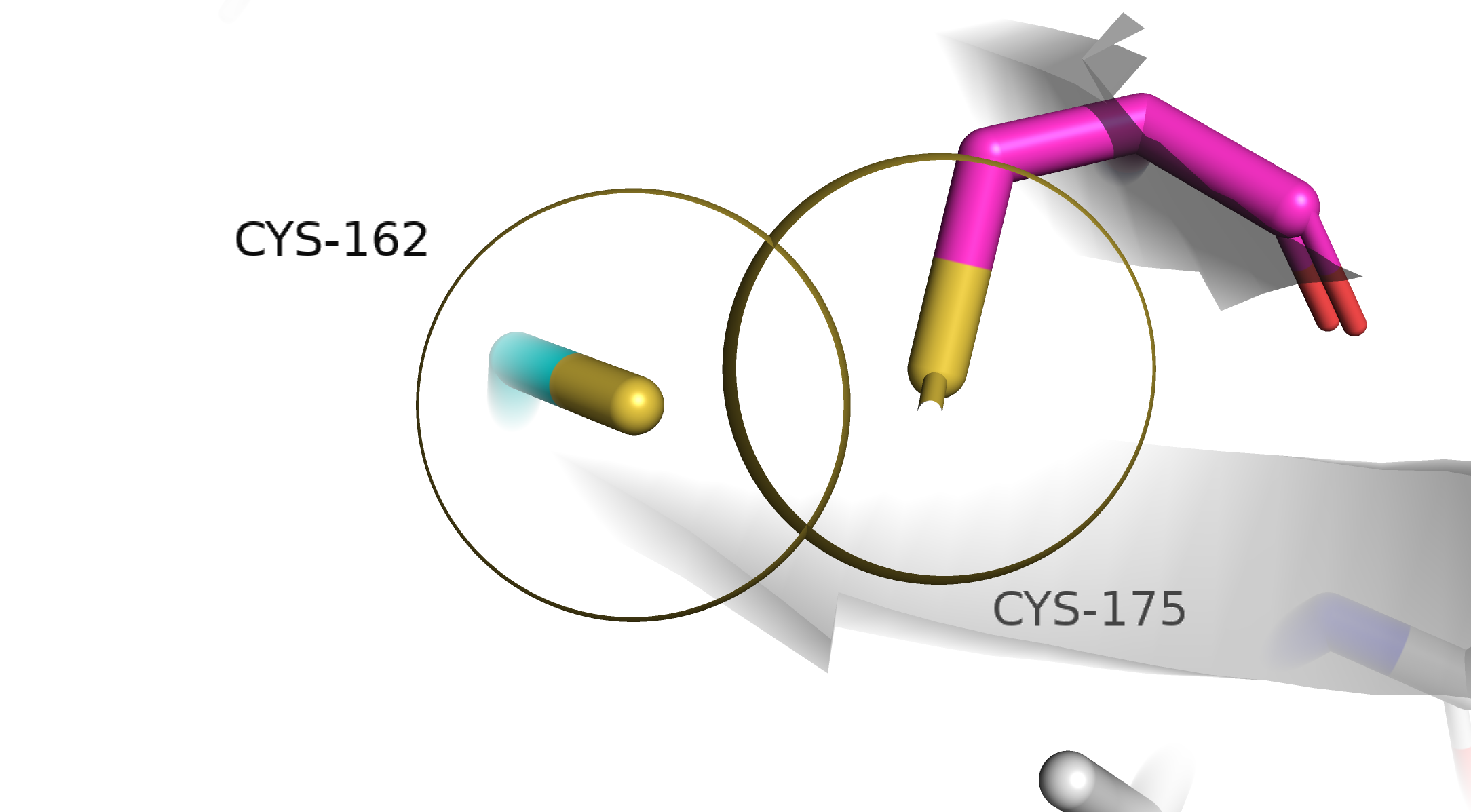
Cys162-В и Cys175-А. Ситуация аналогичная Cys162-A и Cys175-B. Считаю такую комбинацию невозможной. 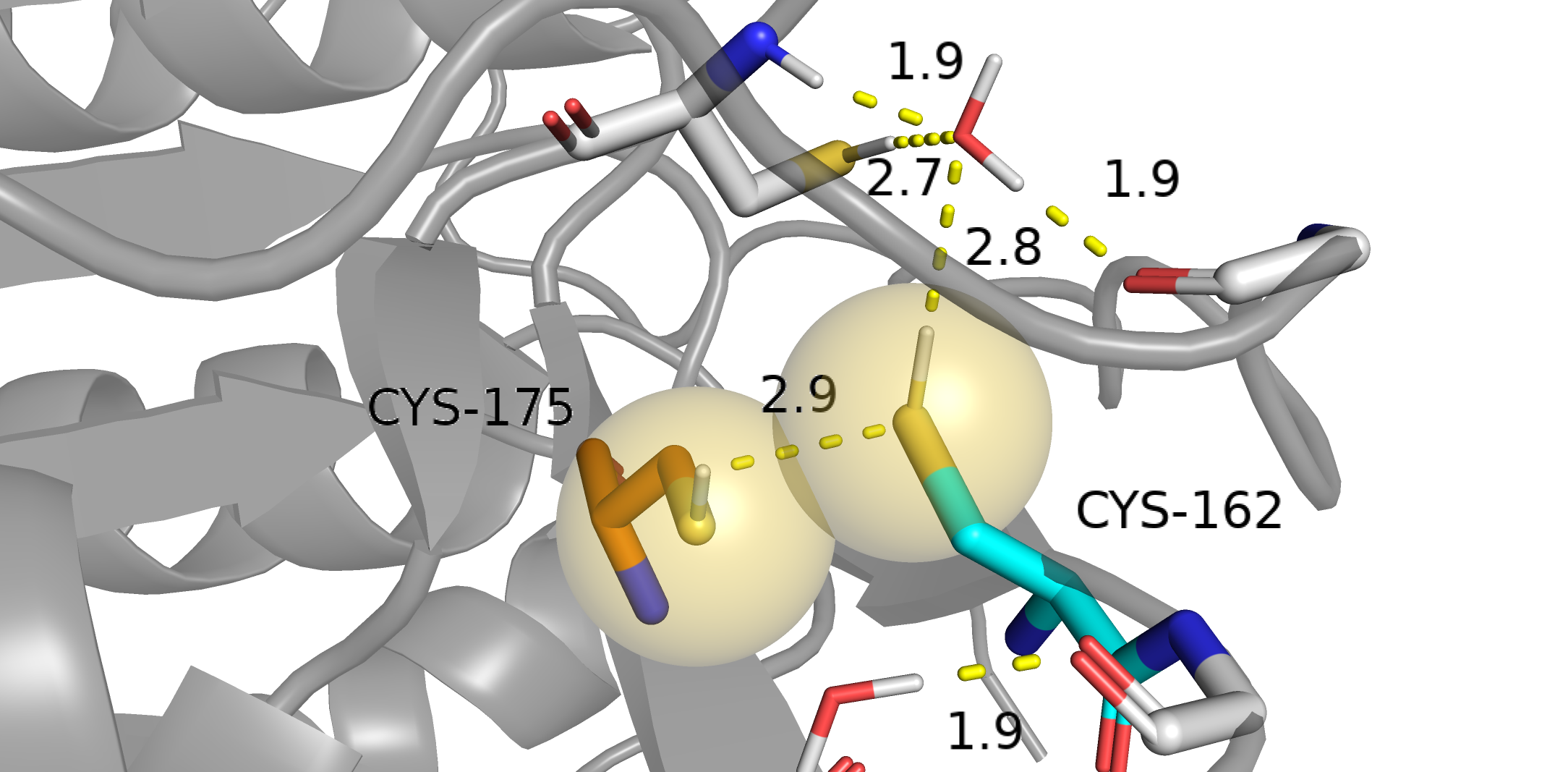
Cys162-В и Cys175-В. Видим небольшое перекрывание VdW радиусов. Наверное, как раз такое перекрывание можно объяснить образованием водородной связи между цистеинами Cys162 и Cys175. Водородные связи цистеинов правдоподобны. А вот расстояние между водой и протоном Cys162, если его максимально сместить навстречу воде составляет около 4 ангстрем. Так что водородной связи подобно случаю Cys162-A тут точно не может быть. Вердикт: комбинации Cys162-A и Cys175-A и Cys162-В и Cys175-В я считаю возможными. Комбинации Cys162-A и Cys175-B и Cys162-В и Cys175-А считаю невозможными. Из двух возможных конформаций тот факт, что Cys162-A и Cys175-A лучше покрыта плотностью, свидетельствует, что эта комбинация более стабильная. Действительно: в случае каждой комбинации есть водородная связи между цистеинами и водородная связь между цистеином и водой. В случае Cys162-A и Cys175-A оба этих расстояния меньше, что можно трактовать как более сильное взаимодействие. d(Cys162-A•••HOH) = 2.7Å < d(Cys175-B•••HOH) = 2.8Å, d(Cys175-A•••Cys_из_окружения) = 2.5Å < d(Cys162-B•••Cys175-B) = 2.9Å. Вообще говоря, в рассуждении выше следует говорить не о том, какое расстояние меньше или больше какого, а какое из расстояний ближе к среднему, то есть наиболее часто наблюдаемому (то есть наиболее вероятному = более энергетически выгодному). Но в нашем случае меньшее расстояние соответствует большей близости к данным из [6]: d(S-H•••H) = 2.55±0.47 ангстрем, d(S-H•••O) = 2.51±0.3, так что все в порядке. Задание 2. B-факторВ этом задании нужно было посмотреть, как в глобуле белка распределены B-факторы атомов остова. Также нужно было найти боковой радикал с большими значениями B-факторов и посмотреть как B-фактор связан с покрытием атома электронной плотностью. PDBID белка: 3CUZ. Покраска blue_white_red мне показалась малоинформативной. Я выбрал покраску rainbow. 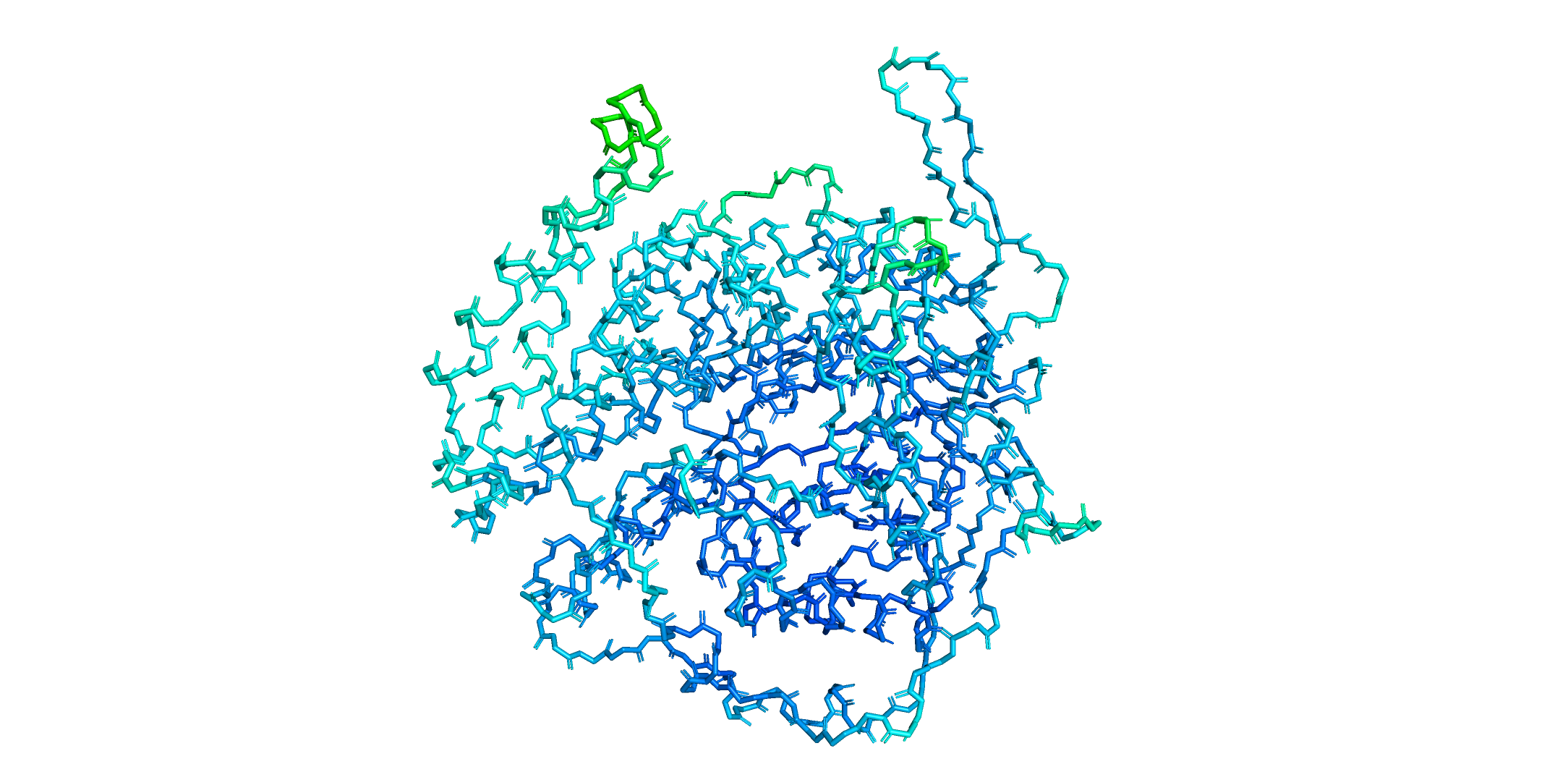
Чем больше цветов в покраске, тем меньшие отличия в b-факторе можно различить. Поскольку b-фактор является мерой неопределенности координат атома, пользуясь лекционным материалом, можно ожидать две причины увеличения b-фактора: статическая неопределенность (пребывание атома в составе различных конформаций. Актуально для петель, у которых может быть много конформаций) и динамическая неопределенность, связанная с термической подвижностью атомов. Предполагаю, что термическая подвижность тоже зависит от положения в белке: у атомов в петлях может быть больше места для "телодвижений", чем у плотно упакованных атомов гидрофобного ядра. Собственно, это мы и видим на картинке выше: остов в петлях намного подвижнее. Порассуждаем теперь про электронную плотность и b-фактор на примере Gln-481. 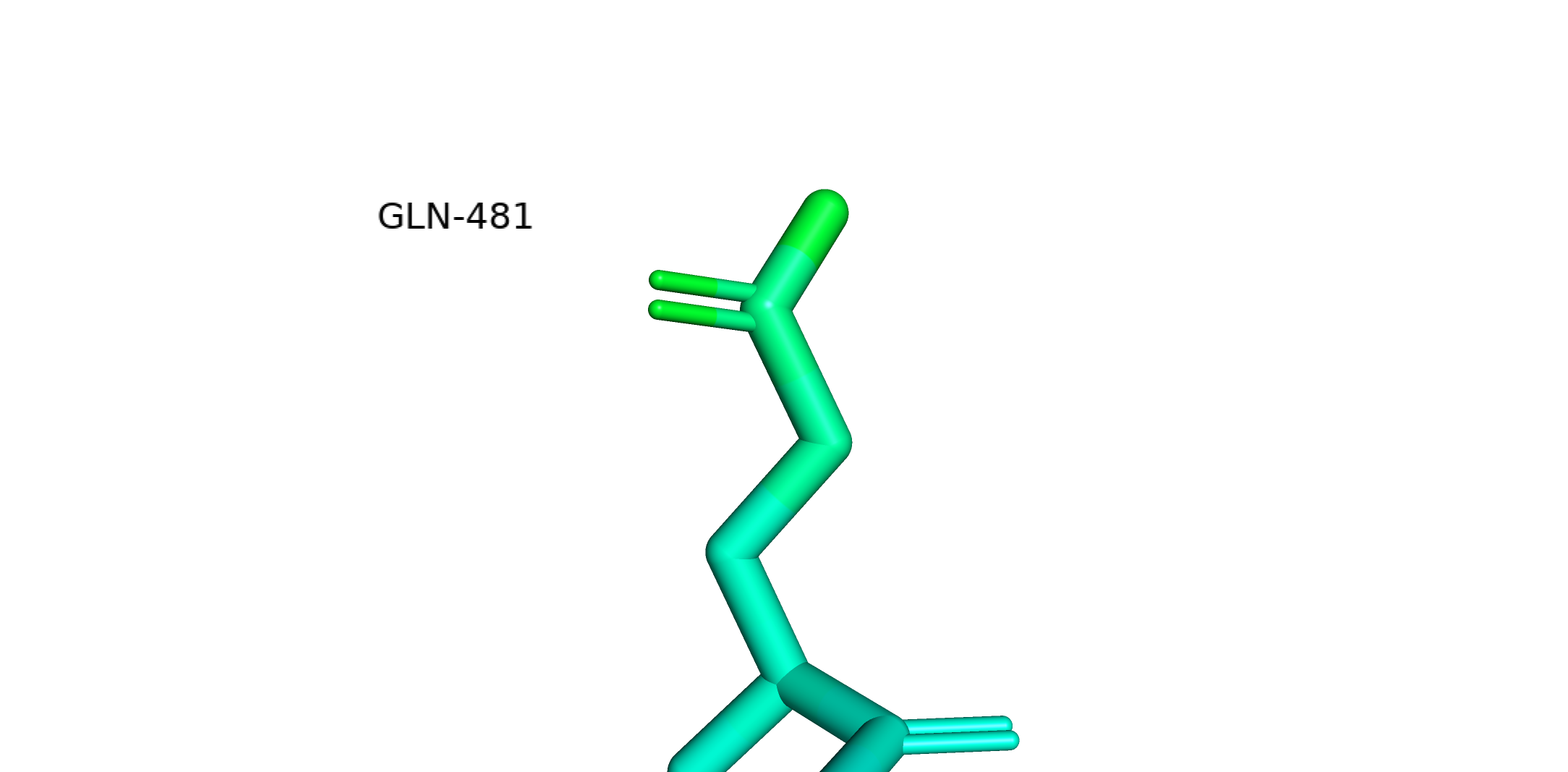
Gln-481. Видно неоднородность покраски: чем ближе к остову, тем "холоднее" атомы. Можно это объяснить тем, что гидратная оболочка белка не имеет фиксированной структуры и молекулы воды время от времени двигаются. Соответственно, глутамину нужно пребывать в разных конформациях, чтобы поспевать за водой. Видимо, это "поспевание" характеризуется во многом вращением вокруг связи Сγ-Сδ, из-за которого кислород и азот амидной группы крутятся туда-сюда. Поэтому они и самые подвижные. 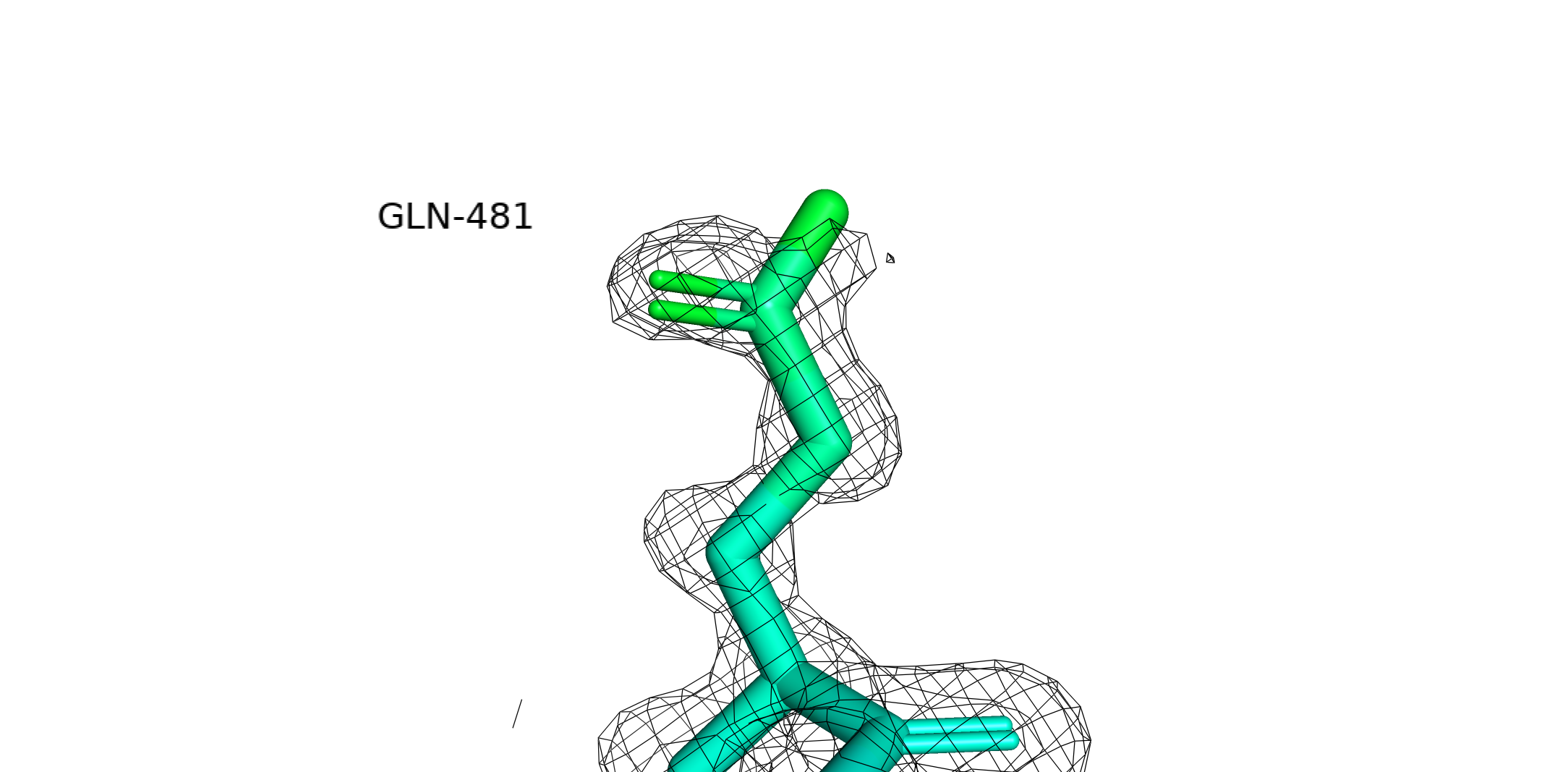
Уровень подрезки = 1, carve = 2. 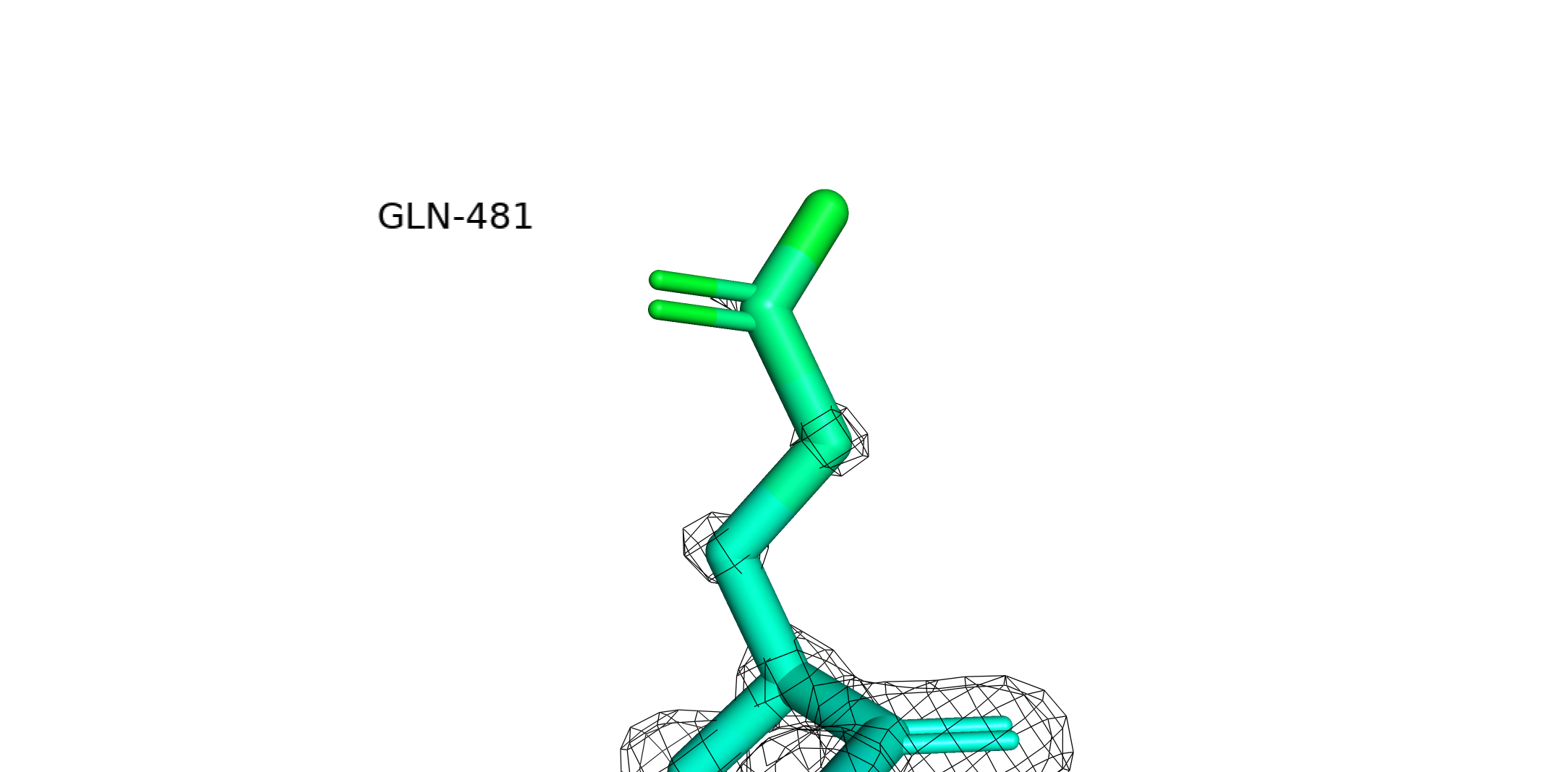
Уровень подрезки = 2, carve = 2. 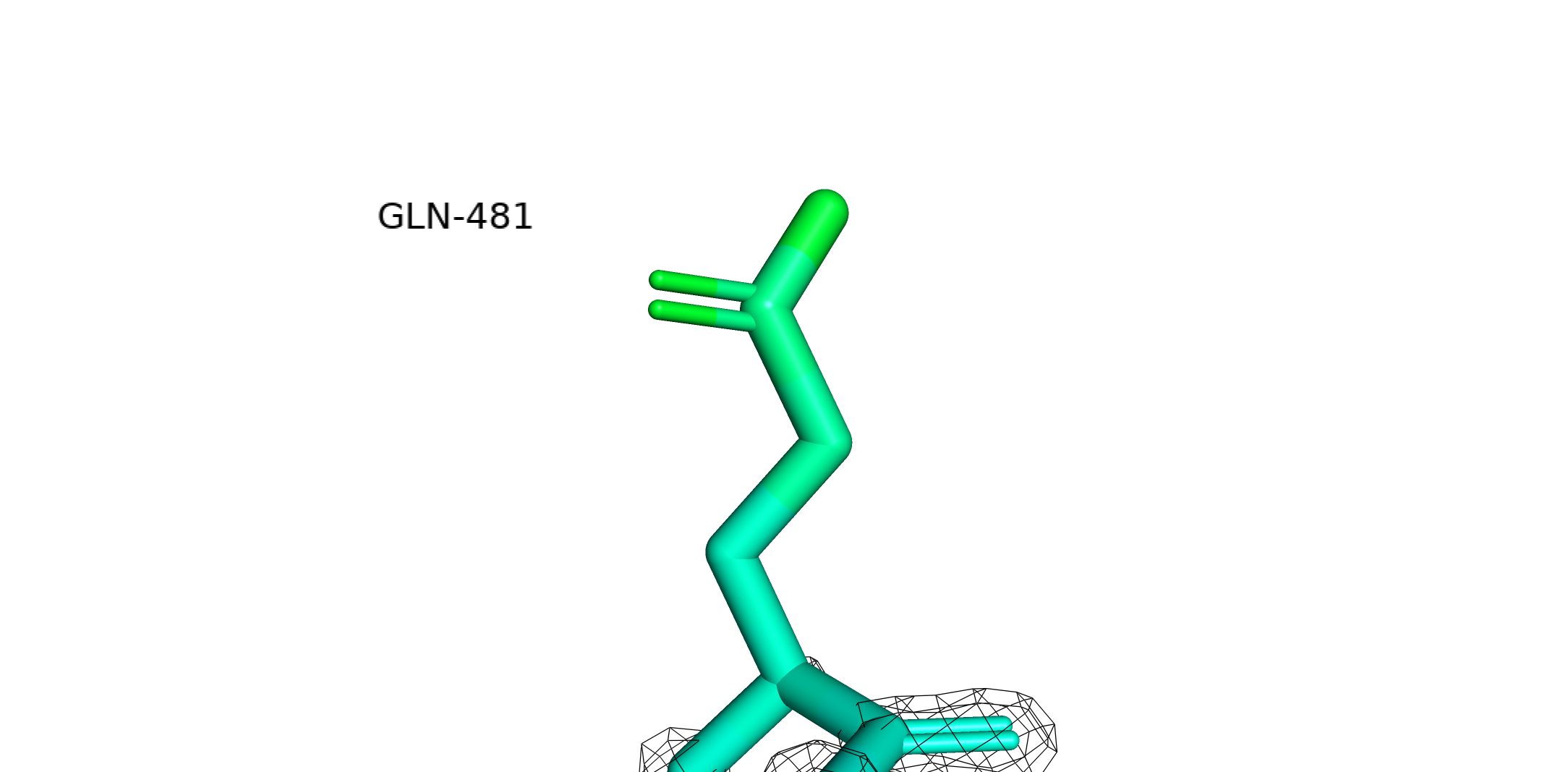
Уровень подрезки = 3, carve = 2. Видим, что при повышении уровня подрезки плотность остается только на наиболее локализованных атомах, потому как для подвижных атомов плотность "размазывается" по пространству. Другими словами, в каждой точке пространства ее становится меньше. Задание 3. СоседиЦелью задания являлось посмотреть сколько соседей у каждой молекулы белка в кристалле (ну, за исключением молекул белка, расположенных на границах кристалла), а также как соседи контактируют друг с другом. Структура та же, что и в предыдущем задании. Непосредственных соседей я насчитал 10 штук. Если смотреть по последней картинке, то их можно обозначить так: 4 "снизу", 4 "сверху", 1 "слева" и 1 "справа". 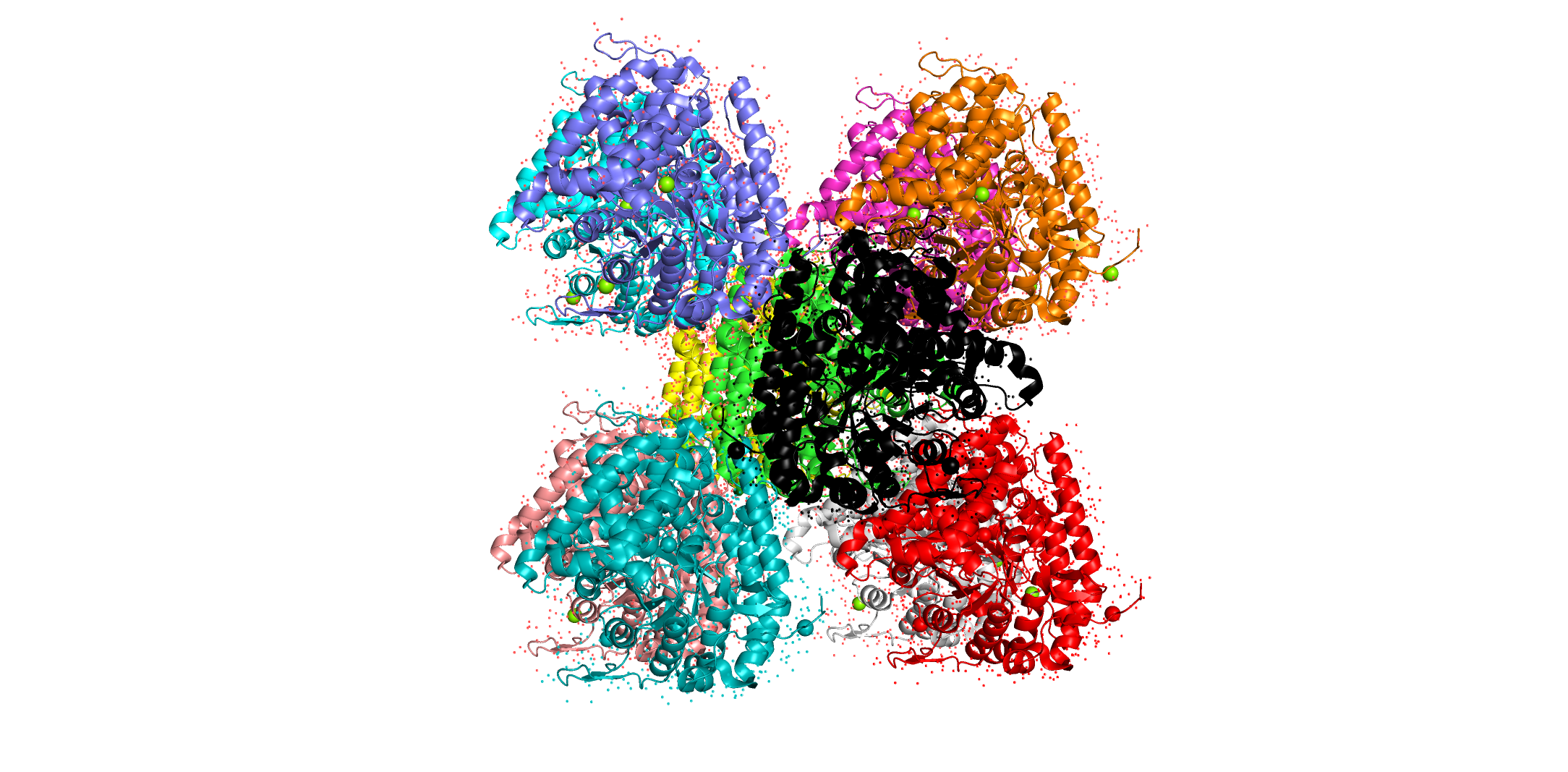

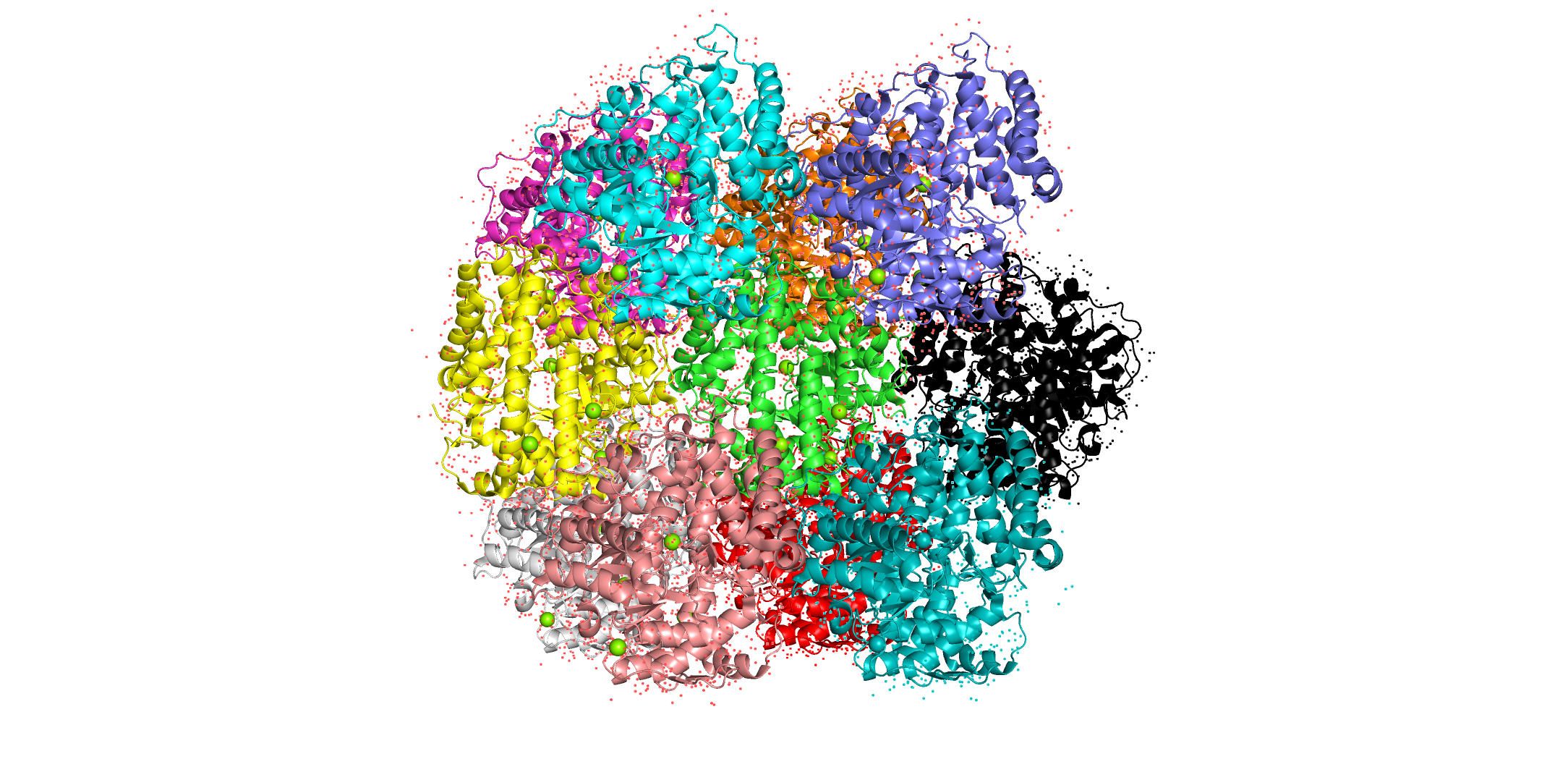
Центральный белок покрашен зеленым. Попробовал изобразить контакты на схеме. Соседние молекулы белка обозначены черными кружками, наличие контакта голубой линией. Если внимательно посмотреть и учесть, что наш белок асимметричен, то можно понять, что уникальных контактов 9. Честно говоря, понять это может быть не так уж и просто, прикрепляю файл сессии паймол в помощь. 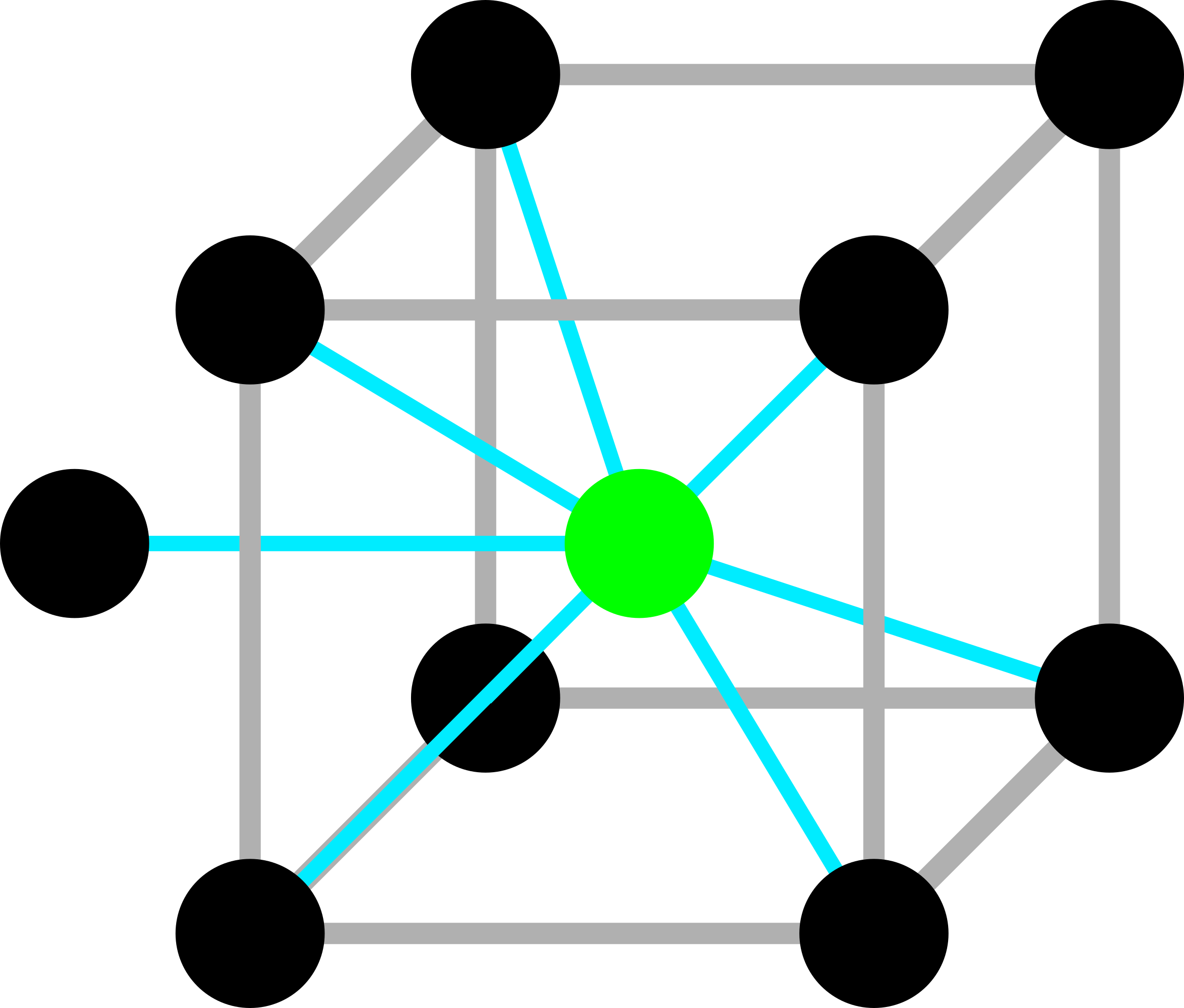
Схема кристалла. 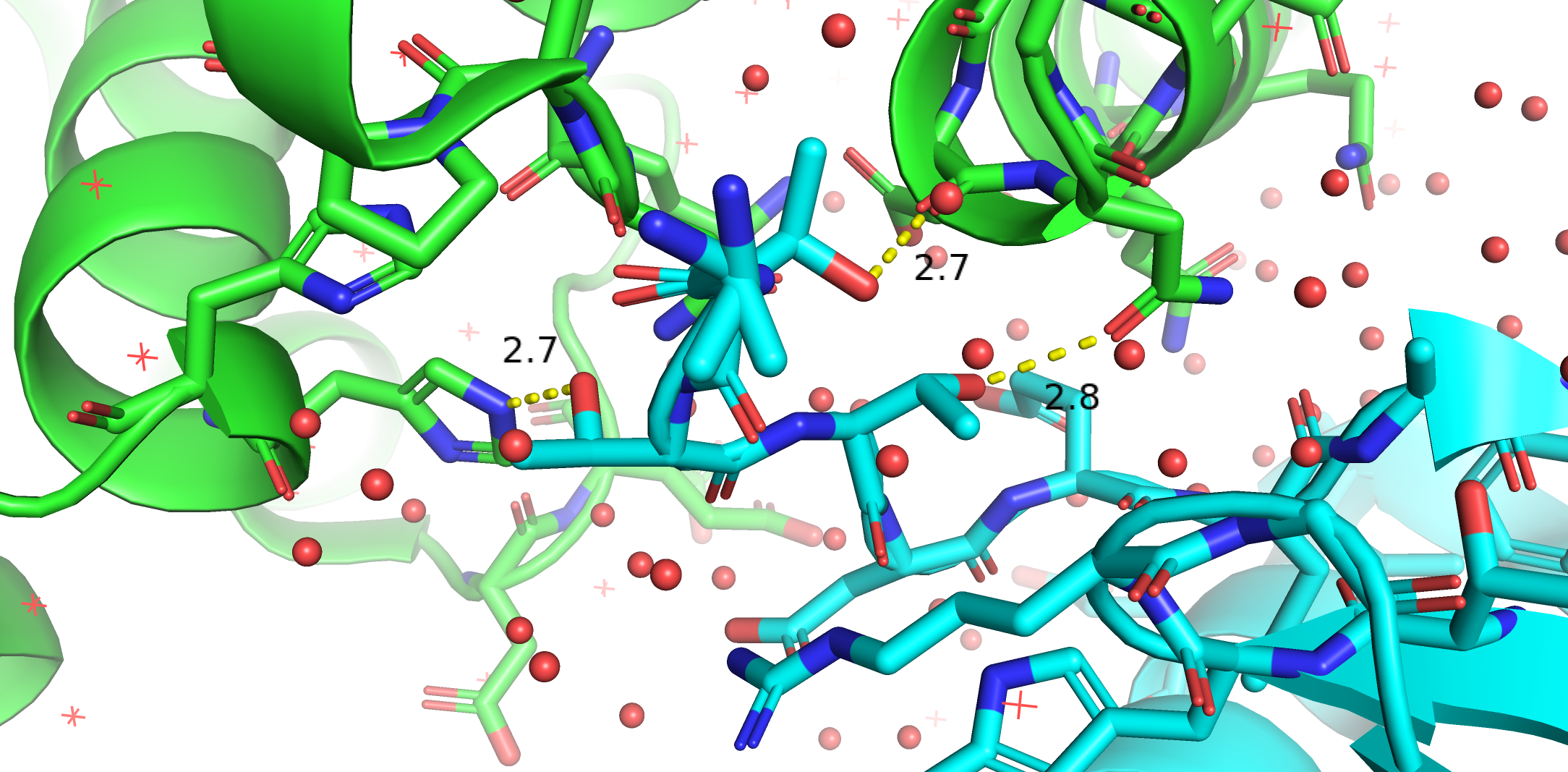
В виду такого большого числа интерфейсов, я опишу только один: между 3CUZ и 3CUZ_01-1-100. Разглядел три водородные связи. Понятно, что помимо них еще есть гидрофобные взаимодействия так как из места контакта вытесняется вода. Отражают ли эти контакты что-то физиологическое? Кто знает. Скорее всего нет, так как при кристаллизации используются буферы, которых нет в клетке, часто любят добавлять PEG (полиэтиленгликоль) — здоровый такой полимер, которого в клетке, конечно, нет. Ну и самое главное, наверное, большинство белков в клетке не существуют в таких огромных концентрациях. Когда белка очень много, вполне вероятно проявление каких-то неспецифичных взаимодействий. |