Введение
Домен PHD6 гистон-лизин N-метилтрансферазы 2С в комплексе с гистоном H4
PDB ID -- 6MLC
Uniprot ID
- биомолекула 1 -- гистон-лизин N-метилтрансфераза 2С -- Q8NEZ4
- биомолекула 2 -- гистон Н4 -- P62805
Гистон-лизин N-метилтранферазa 2C (KMT2C) входит в большой класс ферментов, контролирующих сайт-специфическое метилирование лизиновых остатков на гистонах и других белках. Метилирует лизин-4 гистона Н3. Данный процесс представляет определенный тег для активации эпигенетической транскрипции[3]. Играет решающую роль в контроле транскрипции, хроматиновой архитектуры и клеточной дифференцировки[1].
Гистон Н4 - ядерный компонент нуклеосомы. Нуклеосомы оборачивают и компактируют ДНК в хроматин, ограничивая доступность ДНК для клеточных механизмов, которые требуют ДНК в качестве шаблона. Доступность ДНК регулируется с помощью сложного набора посттрансляционных модификаций гистонов, также называемых гистоновым кодом, и ремоделирования нуклеосом[4]. Таким образом, гистоны играют центральную роль в регуляции транскрипции, репарации ДНК, репликации ДНК и хромосомной стабильности.
В комплексе с гистоном Н4 KMT2C участвует в промотировании транскрипции специфических генов и формировании гетерохроматина[2].
В данном комплексе представлены следующие лиганды:
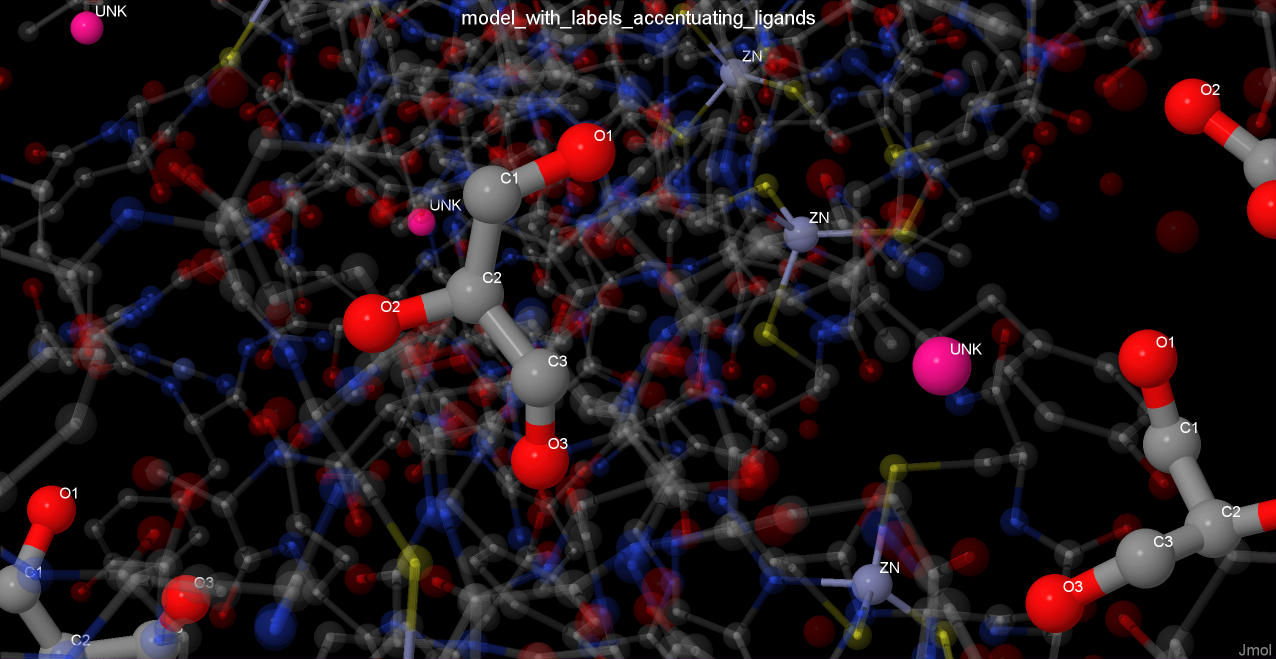
| Лиганд | Схема | Изображение |
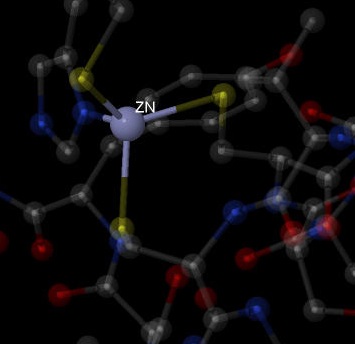
| Цинк |  |
 |
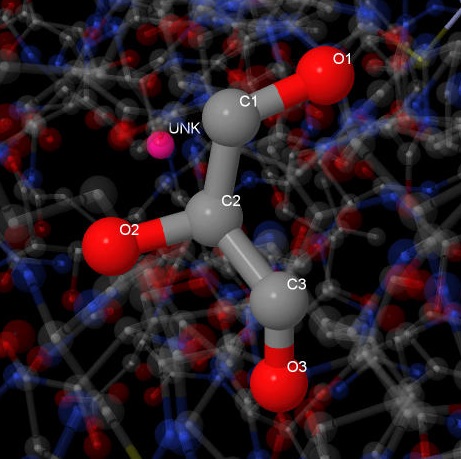
| Глицерол |  |
 |
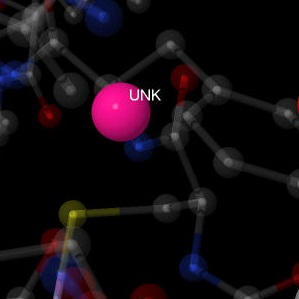
| Неизвестный атом/ион |  |
 |
| Физико-химические свойства лигандов[6],[7] | |||
|---|---|---|---|
| Лиганд | Цинк | Глицерол | Х-лиганд (неизвестный) |
| Название по IUPAC | цинк/zinc | пропан-1,2,3-триол | X | Химическая формула | Zn | CH2OH-CHOH-CH2OH | X |
| Брутто-формула | Zn | C3H8O3 | X |
| Молярная масса | 65.38 | 92.094 | ? |
| Идентификатор в PubChem | 23994 | 753 | ? |
Информация о белок-белковых контактах
Ковалентные связи - пептидные
Этот тип связей формирует первичную структуру белка - цепочки аминокислот. Углерод остова предыдущей аминокислоты соединен с азотом остова следующей, и вращение вокруг этой связи затруднено. Увидеть примеры пептидных связей в трансферазе можно с помощью этого cкрипта.
Водородные связи
Такие связи формируют вторичные структуры белка, поддерживают третичные. Типичный угол - от 110 до 180 градусов ([8]). Длина - до 3.5 Å. Скрипт с отображением нескольких водородных связей в данном белке здесь.
Солевые мостики
Ионные взаимодействия можно обнаружить между разноименно заряженными радикалами таких остатков, как аргинин, лизин (положительный заряд, N) и аспарагиновая и глутаминовая кислоты (отрицательный заряд, O). Согласно [5], длина солевых мостиков не превышает 4 Å.
На основании этих данных был написан cкрипт для поиска и визуализации контактов такого типа.
С помощью него были выявлены 34 возможных ионных взаимодействия на 3011 связей в белке.
Несмотря на своё небольшое количество, солевые мостики довольно важны для поддержания третичной структуры, так как их существование обусловлено достаточно сильным электростатическим взаимодействием. Однако, наличие ионных мостиков сильно зависит от pH растворителя.
Гидрофобные взаимодействия
1. Минимальное расстояние от остатка, на котором атомы окружения полностью покрывают триптофан, - 5.0 Å.
2. На расстоянии от 2.0 до 3.0 Å появляются первые атомы остатков, не связанных с триптофаном ковалентно.
3. Поскольку диаметр атома кислорода равен 2.8 Å, между соседними атомами не может поместиться ни молекула воды, ни другие атомы (углерод, азот, сера имеют бОльшие Ван-дер-Ваальсовы радиусы).
Поиск гидрофобного взаимодействия осуществлялся следующим образом: был случайно выбран гидрофобный остаток триптофана и написан cкрипт для визуализациии его окружения (команды подбирались с помощью ресурса https://chemapps.stolaf.edu/jmol/docs/index.htm?ver=14.29).
Роль гидрофобных контактов заключается в минимизации нарушений структуры воды (разрывов водородных связей между её молекулами), в которой растворен белок. Третичная структура белка во многом зависит от этого типа взаимодействий: так, в данном белке (по подсчетам на сайте http://mouse.belozersky.msu.ru) присутствует 21 гидрофобное ядро с общим количеством атомов = 612 (всего в молекуле 3059 атомов).
Информация о лиганд-биомолекулярных контактах
Глицерол (GOL2005:A) связан с белком двумя водородными связями: GOL2005:A.O3 - CYS1081:A.SG (3.06 Å) и GOL2005:A.O3 - HIS1059:B.O (3.38 Å).
Ион цинка образует четыре связи: три из них - с цистеинами (1081, 1069, 1078:A), одна - с гистидином (1059:B.ND1).
Типы взаимодействий неизвестного лиганда с белком не установлены.
Личный вклад
Введение написано Барсуковой А. Белок-белковые контакты описаны Барсуковой А. (ковалентная пептидная и водородная связи + изображения в апплете) и Сидоровой В. (солевой мостик и гидрофобное взаимодействие + изображения в апплете). Лиганд-белковые контакты описаны и изображены в апплете Сидоровой В. Совместными усилиями оформлена html-страница (Сидорова В. работала над апплетом и ссылками, Барсукова А. выполнила дизайн страницы).
Ссылки на источники:
- [1] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4385864/
- [2] http://medbiol.ru/medbiol/epigenetica/001a1b27.htm
- [3] https://www.uniprot.org/uniprot/Q8NEZ4
- [4] https://www.uniprot.org/uniprot/P62805
- [5] Kumar, Nussinov(2002)."Close-range electrostatic interactions in proteins". Chembiochem. 3(7):604–17.
- [6] https://pubchem.ncbi.nlm.nih.gov/compound/23994#section=Top
- [7] https://pubchem.ncbi.nlm.nih.gov/compound/753#section=Top
- [8] E. Arunan, G. R. Desiraju, R. A. Klein and others, Pure Appl. Chem., Vol. 83, No. 8, pp. 1637–1641, 2011.
