С помощью PDBeFold было найдено 2 структурных гомолога для 2V6O (STRUCTURE OF SCHISTOSOMA MANSONI THIOREDOXIN-GLUTATHIONE REDUCTASE) с RMSD между 0,8 и 2,5 и длиной выравнивания более 50% от длины 26VO:

Далее с помощью PDBeFold было получено множественное выравнивание.
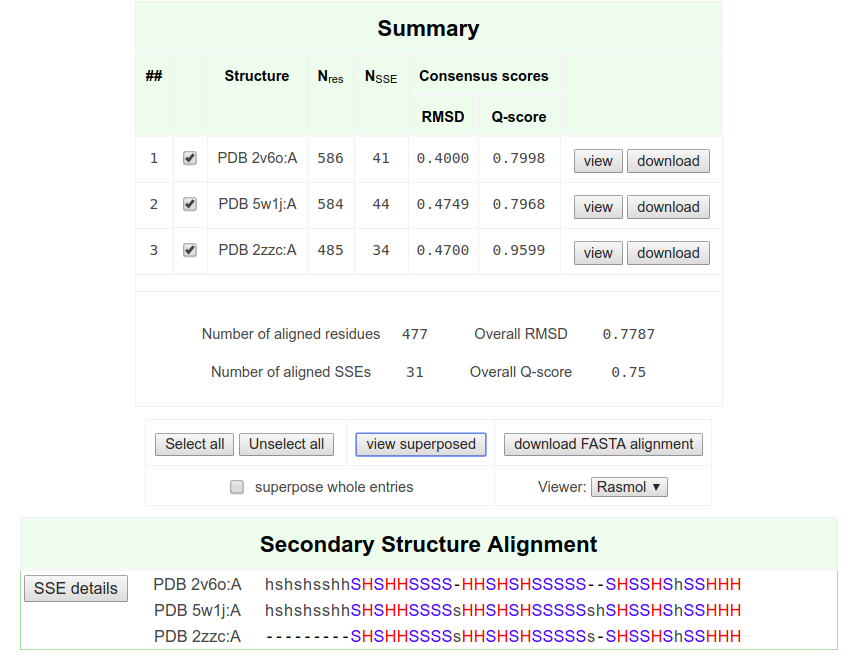
Были скачаны выравнивание последовательностей и выравнивание структур
Выравнивание структур с pdbefold (Jmol):
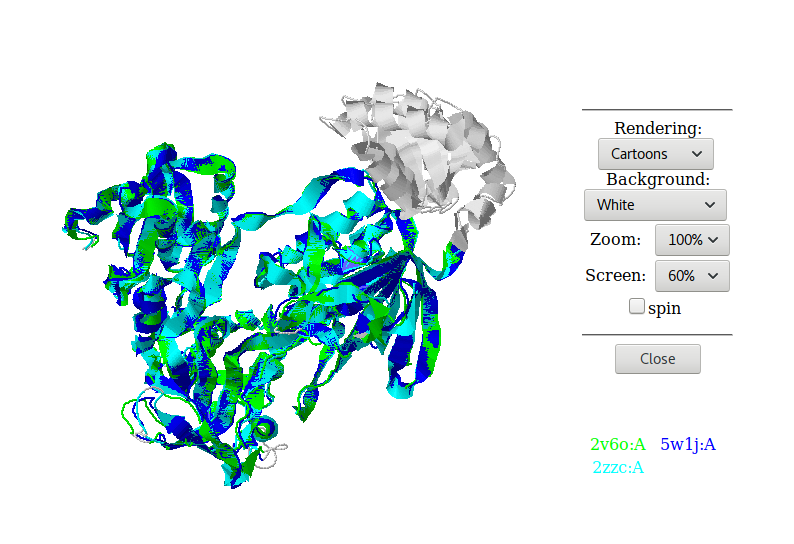
Рис. 1. Выравнивание структур, скачанное с pdbefold (Jmol applet)
Далее структурное выравнивание было открыто в pymol:
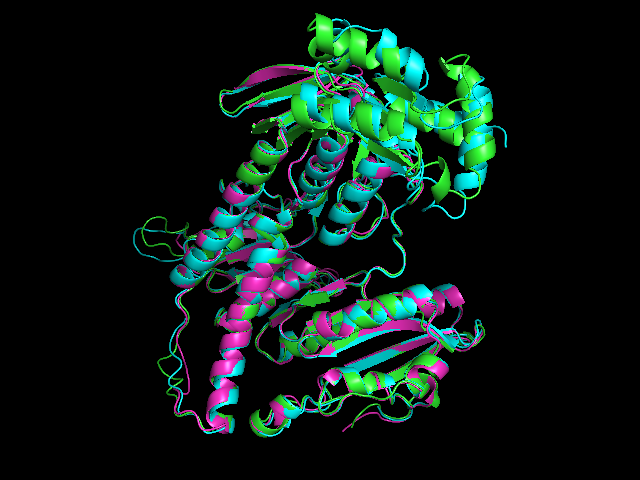
Рис. 2. Выравнивание структур, скачанное с pdbefold (Pymol). Гомологи показаны цветами.
Структуры совмещаются хорошо.
Далее было построено выравнивание последовательностей c помощью muscle.
Отличий в выравниваниях почти нет, из значимых можно выделить это - (см 350-360) глутамат в 2zzc выравнивается либо с лизином и глутаматом (структурное), либо с двумя другими глутаматами (muscle):

При рассмотрении структурного выравнивания (рис. 3) получается, что лизин 2v6o (зеленый) действительно выравнивается с глутаматами 5w1j и 2zzc (голубой и фиолетовый) (колонка 352 сверху). В то же время глутамата 2zzc в необходимой позиции нет (колонка 358 снизу, рис 4). Значит структурное выравнивание в данном случае дает более правильную информацию о гомологии, чем выравнивание muscle.
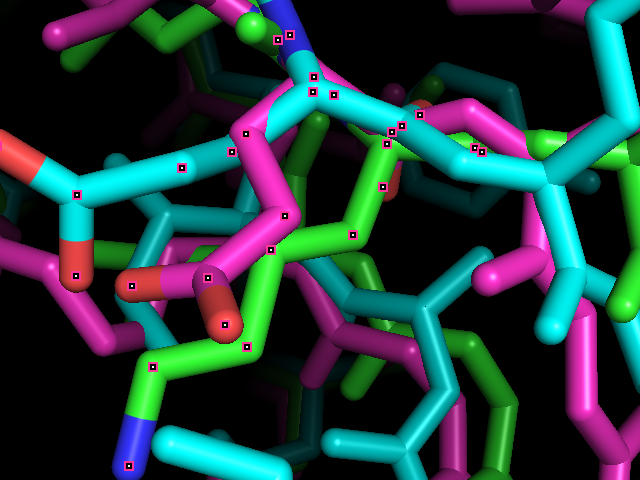
Рис. 3. Фрагмент выравнивания структур.
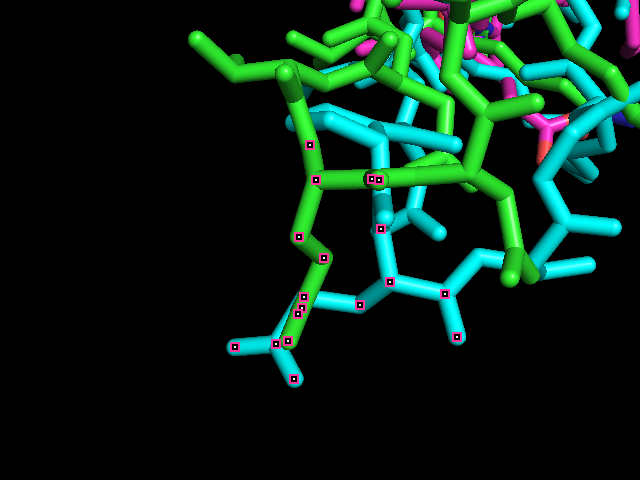
Рис. 4. Фрагмент выравнивания структур.
Вывод: выравнивание с помощью pdbefold более достоверное.
Была выбрана структура (2NBQ region d:115-204) константного домена T-клеточного рецептора из цепи альфа и (1QSE region e:119-246) из цепи бета.
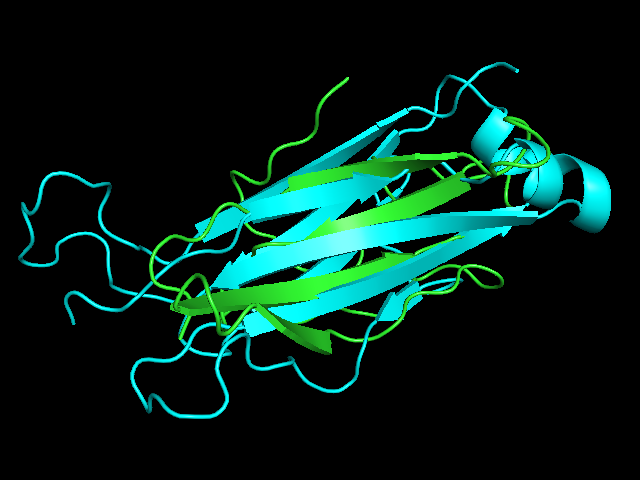
Рис. 5. Выравнивание структур в pymol (align).
Далее были построены карты бета-листов при помощи сервиса SheeP.
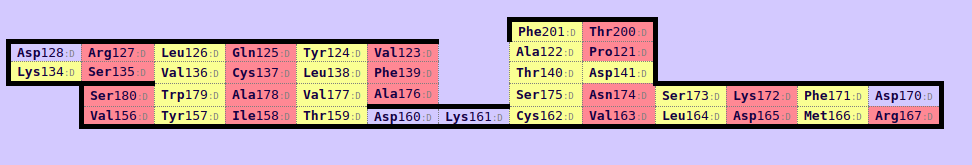
Рис. 6. Карта β-листов для α-цепи Т-клеточного рецептора (2NBQ region d:115-204).
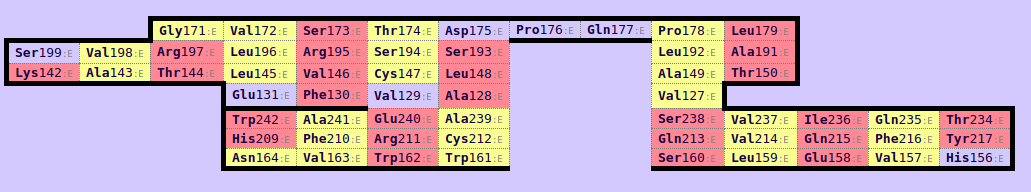
Рис. 7. Карта β-листов для β-цепи Т-клеточного рецептора (1QSE region e:119-246).
В каждой карте был найден консервативный остаток цистеина, образующий дисульфидную связь. В 2NBQ - Cys 137, в 1QSE - Cys 147
Совмещение структур производилось по β-листу, содержащему консервативный цистеин - pymol session . Выравнивание производилось с помощью команд
select alpha, 2bnq_d_115_204 and resi 124-126+136-138+177-179 and name CA
select beta, 1qse_e_119_246 and resi 128+130+146-148+193-195 and name CA
pair_fit alpha, beta
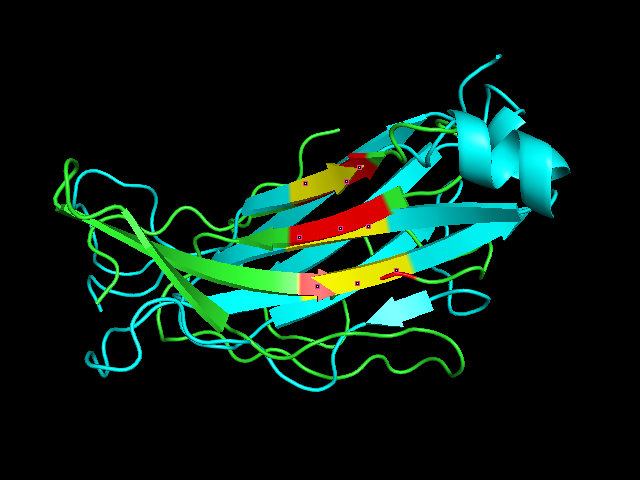
Рис. 8. Полученное совмещение структур α-цепи (зеленый цвет) и β-цепи (голубой цвет). Участки β-листов, использовавшиеся в качестве затравки выравнивания, выделены красным и желтым (RMS = 0.569).
Выравнивание неплохое, хотя нельзя сделать вывод, что оно лучше первоначального (рис. 5), не совпадает ход одного из бета-тяжей. Направление цепей в пространстве в целом совпадает, но ход петель сильно отличается.