
 |
Учебный сайт Юдиной А.С. |
Главная |
Обо мне |
Семестры |
Поиск по сходству. Поиск по сходству.Для выполнения этого задания я взяла последовательность белка Chitin-binding protein, который предположительно вырабатывается штаммом бактерии Streptoyces globisporus C-1027. [1] С помощью программы BLAST я нашла 9 белковых последовательностей, которые дальше исследовала на гомологию с исходным белком. В Таблице 1 собрана информация о найденных последовательностях. Таблица 1. Характеристики находок BLAST.
Чтобы установить гомологию я провела множественное выравнивание найденных белковых последовательностей и нашла блоки достоверного выравнивания. Основные признаки блока: отсутсвие гэпов; концевые позиции абсолютно или абсолютно функционально консервативны; присутствуют в достаточном количестве абсолютно консервативные позиции (примерное соотношение 3 к 5). На рисунке 1 представлена часть последовательности с найденными блоками (для удобства блоки выделены и вырезаны части выравнивания, их не содержащие).
 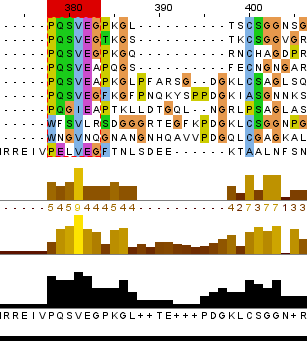 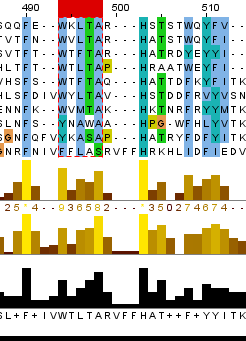 
Рис.1 На основании полученных данных я предполагаю, что последовательности моего белка гомологичны все из найденных кроме последовательностей с ID WP_084901498.1, OSC95314.1, EGT46470.1(т.е. три последние). Так как в найденных блоках эти три последоваетльности больше всего отличаются от остальных: в первом блоке для указанных мной последовательностей не сохраняются консервативные позиции с P, Q и E, а в функционально консервативной позиции, где у белков блока присутствуют A и G, у белков WP_084901498.1, OSC95314.1 стоят остатки заряженных аминокислот; второй блок охватывает только 4 позиции и в нем происходит замена в позиции c W и T для указанных последоваетельностей; в третьем блоке менее очевидны отличия последних трех последовательностей - в функционально консервативной позиции с I и V у последних трех последовательностей стоит остаток заряженной аминокислоты R. Пересторойки в парах белков.Для выполнения этого задания я взяла белок Epidermal growth factor receptor, встречающийся у человека. Это трансмембранный белок, он является рецептором для внеклеточных белковых лигандов из семейства фактора эпидермального роста - белков, отвечающих за рост, пролиферацию и дифференциацию клеток. [2] В пару к белку-рецептору я взяла белок Homo sapiens v-erb-b2 erythroblastic leukemia viral oncogene homolog 3, который по сути является синтетической конструкцией.[3] Выравнивание я строила с порогом E-value = 1.0e-6 и длинной слова 2. Для выбранной пары последоваетельностей значение E-value = 1e-92, идентичность 43%, покрытие 48%. На рисунке ниже локальное выранивание последовательностей представлено графически.
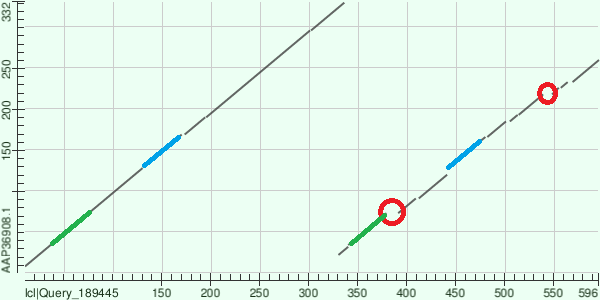
Рис.2 По горизонтальной оси отложена последовательность белка-рецептора, по вертикальной - второго выбранного белка. Красным выделены области, указывающие на делеции, потеря участка последовательности происходит в цепи белка-рецептора, синим и зеленым отмечены дупликации участков, для этих двух случаев - двум разным участкам первой последовательности соответствует один и тот же участок второй. Источники:1. Банк данных Uniprot.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© Юдина Анастасия, 2016