
 |
Учебный сайт Юдиной А.С. |
Главная |
Обо мне |
Семестры |
Алгоритмы множественного выравнивания. Различия во множественных выравниванияхДля выполнения задания по сравнениюмножественных выравниваний в разных программах я взяла последоваетльности белков, чью гомологию я выяснила при выполнении задания практикума 12. Я взялась рассматривать выранивания следующих белков из таблицы и белка chitin-binding protein из штамма Streptomyces globisporus C-1027.
Я выполнила выравнивания в трех программах: T-coffee, MAFFT и Muscle.Ссылка на проект со всеми выравниваниями. Во всех своих предыдущих работах, где требовалось строить выравнивания, я пользовалась программой
MAFFT. Эта программа подходит для выравнивания как аминокислотных последоваттельностей, так и нуклеотидных.
На рисунке 1 и 2 представлены выравнивания (далее al1 и al2) сделанные в программах T-coffee и Muscle соответственно.
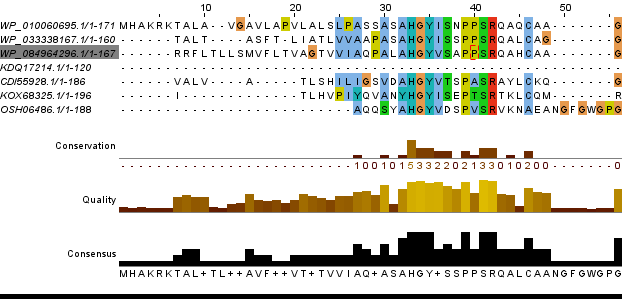
Рис.1

Рис.1 Различия в выравниваниях:
Кроме того приведу сравнение двух выравниваний по следующим пунктам, собранным в таблицу 1. Таблица 1. Сравнение выравниваний.
Из данных таблицы видно, что процент абсолютно консервативных и функционально консервативных позиций выше для al2, причем это достигается за счет уменьшения максимальной длины выравнивания и увеличением количества кончервативных позиций. Доменная архитектура.Для выполнения этого задания я использовала белок Epidermal growth factor receptor (ID:EGFR_HUMAN). Я уже работала с ним в предыдущих практикумах.Это трансмембранный белок, он является рецептором для внеклеточных белковых лигандов из семейства фактора эпидермального роста - белков, отвечающих за рост, пролиферацию и дифференциацию клеток.[1] В базе данных о семействах доменов Pfam я нашла домены этого рецептора. Они показаны на рисунке 3 и называются соответственно: Recep L domain(два зеленых блока), Furin-like, GF recep IV и Pkinase_Tyr.

Рис.3 Обратим внимание на домен Pkinase Tyr (PF07714). Это Тирозин киназа - подкласс класса протеиновых киназ. Данных фермент переносит фосфатную группу с молекулы АТФ на белки клетки. Он функционирует как регулятор множества внутриклеточных реакций. Основное отличие от других киназ заключается в присоединении фосфатной группы при переносе к остатку тирозина. [2] Я рассмотрела три наиболее часто встречающиеся доменные архитектуры, в которые входит рассмотренный домен.
Источники1. Epidermal growth factor receptor - wikipedia.org
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© Юдина Анастасия, 2016