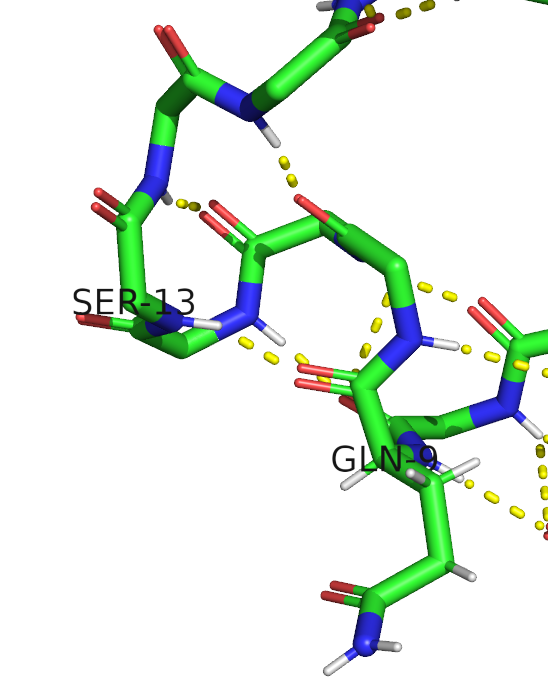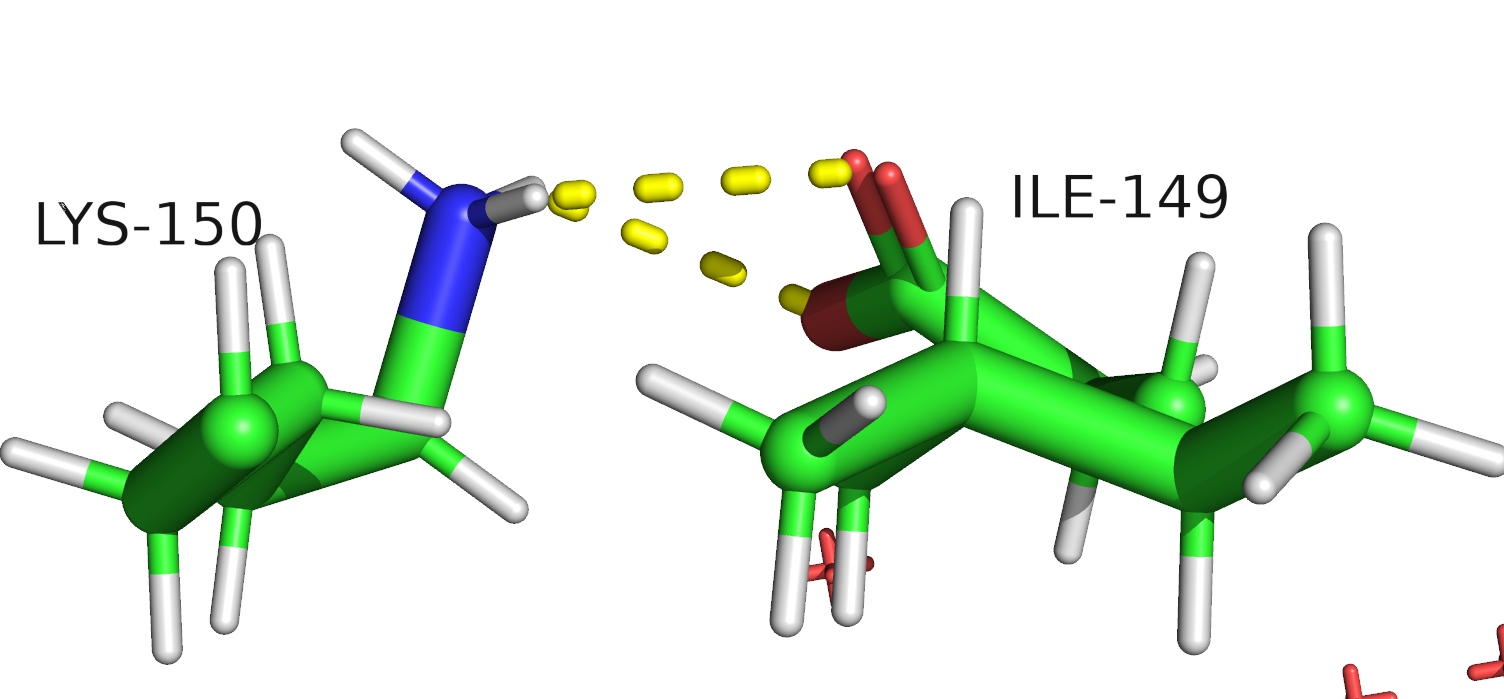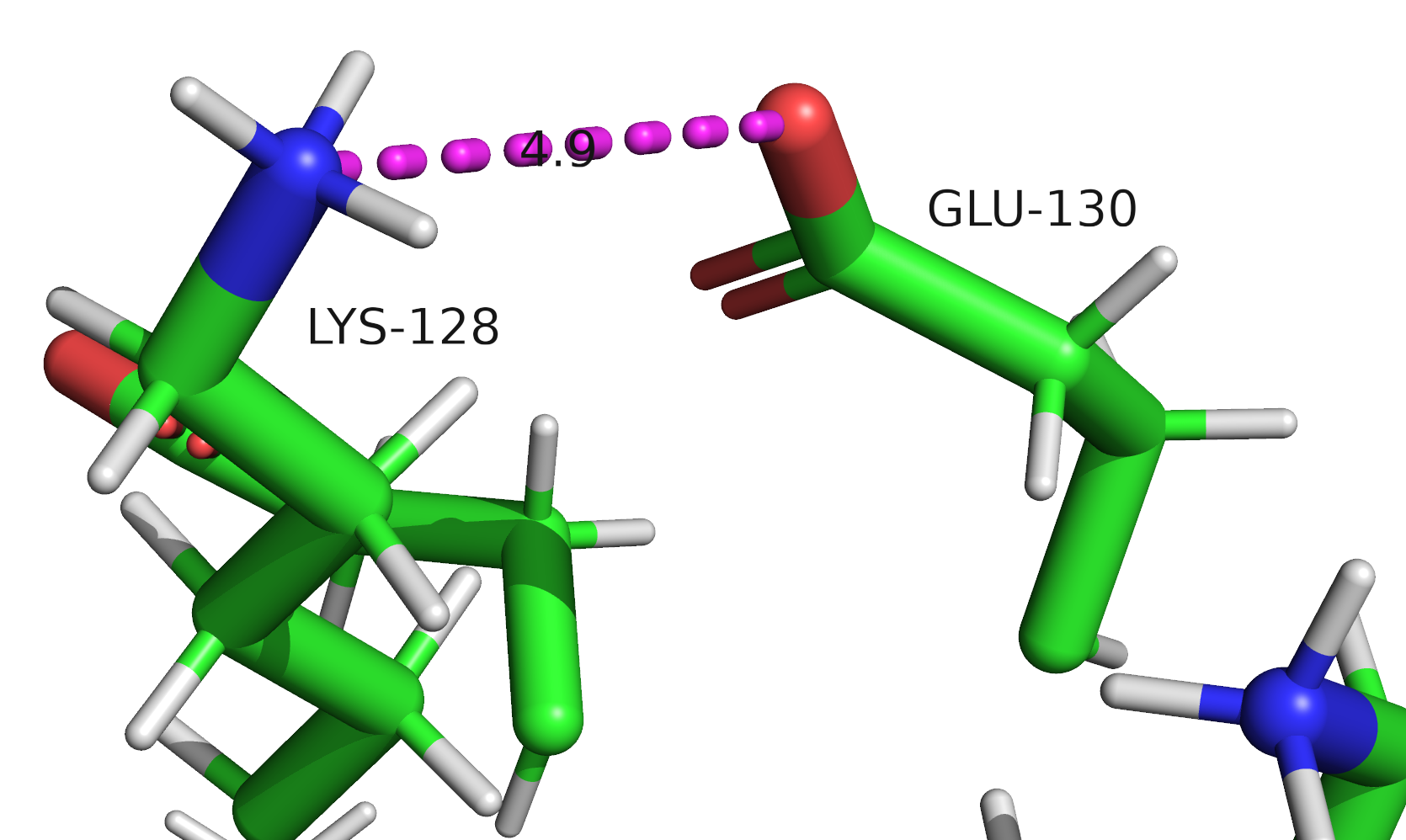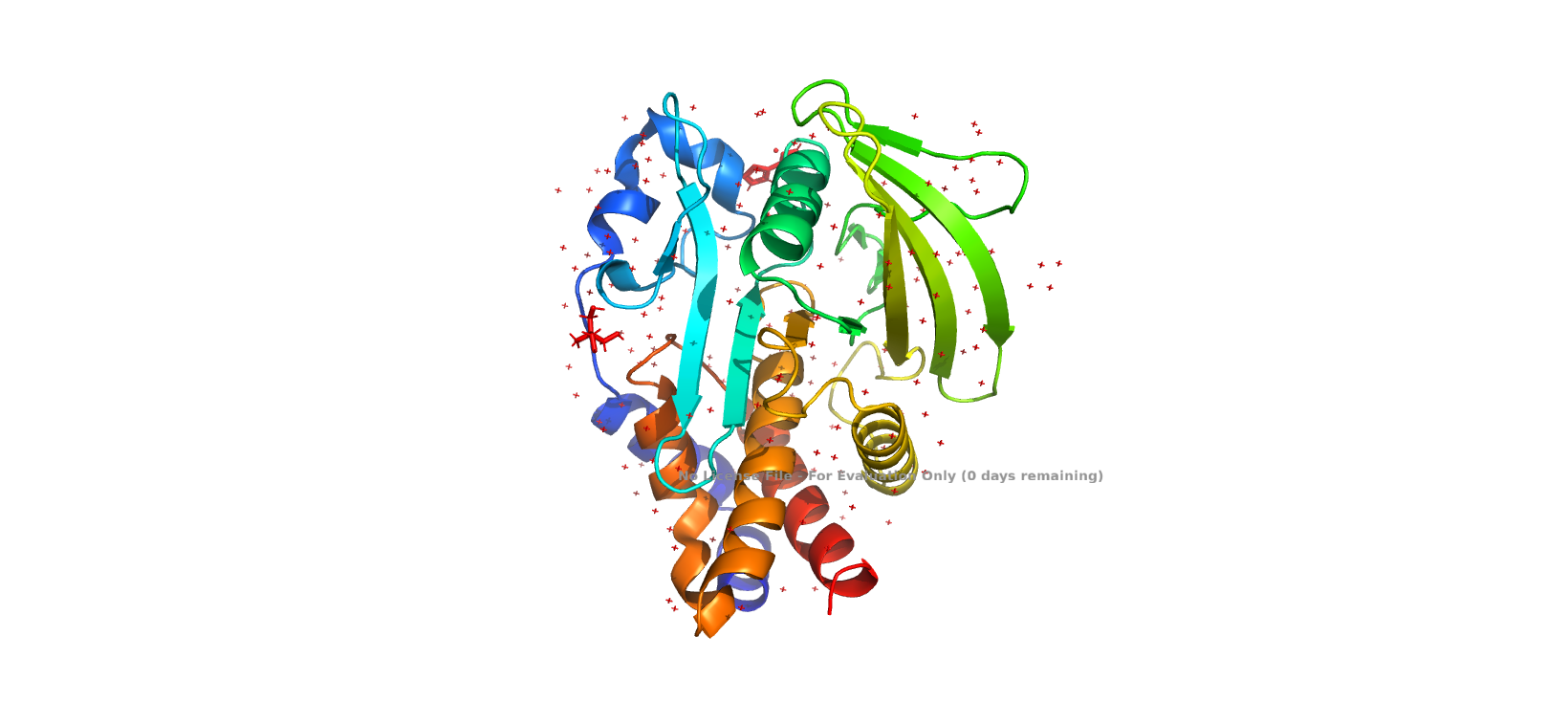
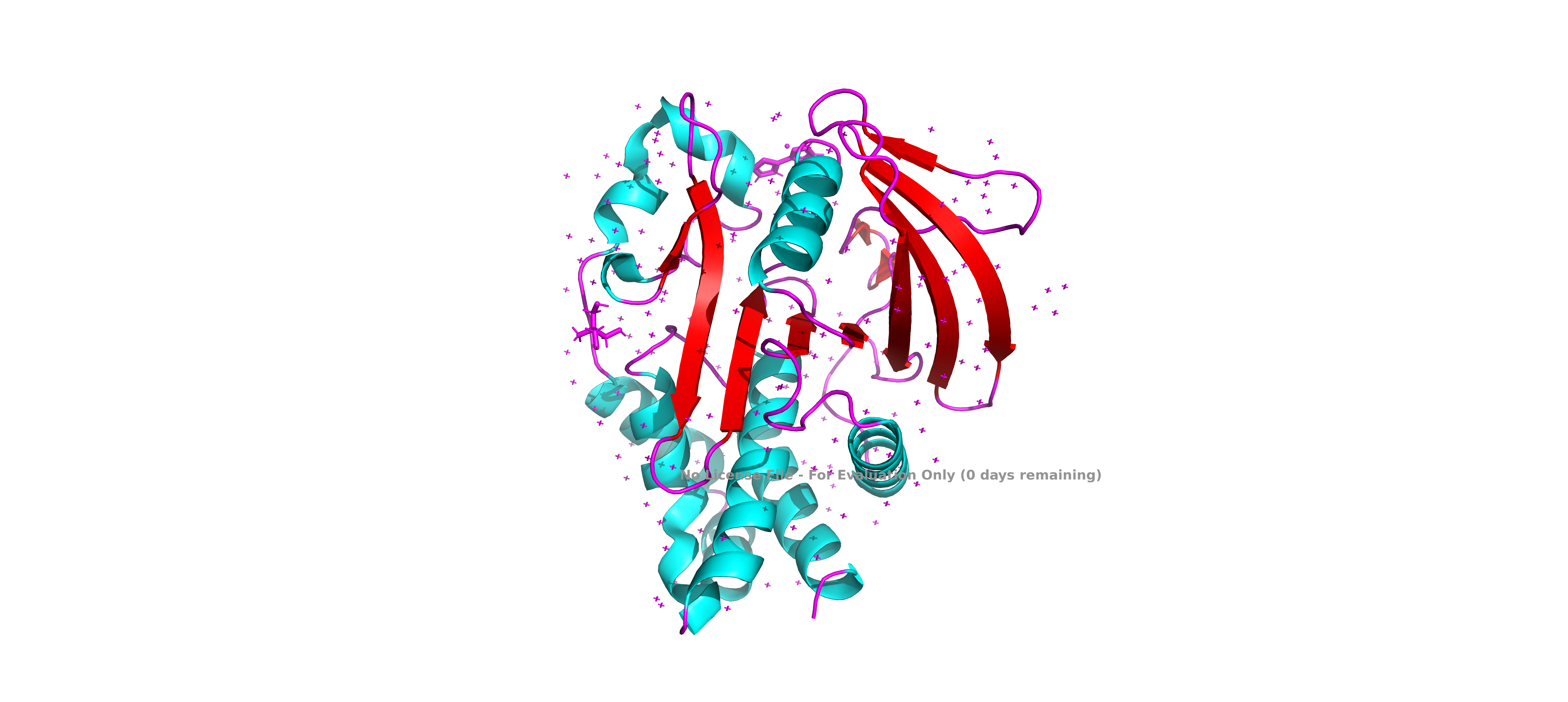
Исследуемый белок относится является нерецепторной тирозин-протеинфосфатазой 1 типа (Tyrosine-protein phosphatase non-receptor type 1), может играть важную роль в каскадах передачи сигнала. Встречается в организме человека. В полимерной структуре белка присутствует 1 идентичная полипептидная цепь. В одну биологическую единицу входит 1 идентичная полимерна цепь, биологическая структура идентична ассиметрической.

1. Единственная макромолекула относится к человеку (Homo Sapiens).
2. Uniprot id - P18031, название - белок тирозинфосфатазы 1B. Согласно описанию в Uniprot играет роль в регуляции сигнальных путей: опосредует дефосфорилирование EIF2AK3/PERK, может играть важную роль в каскадах передачи сигнала, индуцированных CKII и p60c-src, может регулировать сигнальный путь EFNA5-EPHA3, модулирующий реорганизацию клеток, влияет на сигнальный путь рецептора фактора роста гепатоцитов через дефосфорилирование метионина.
3. Относительно референса в Uniprot есть 2 мутации (на 32 и 92 аминокислотных остатках).
4. В исследуемом белке присутствуют модифицированные аминокислотные остатки:
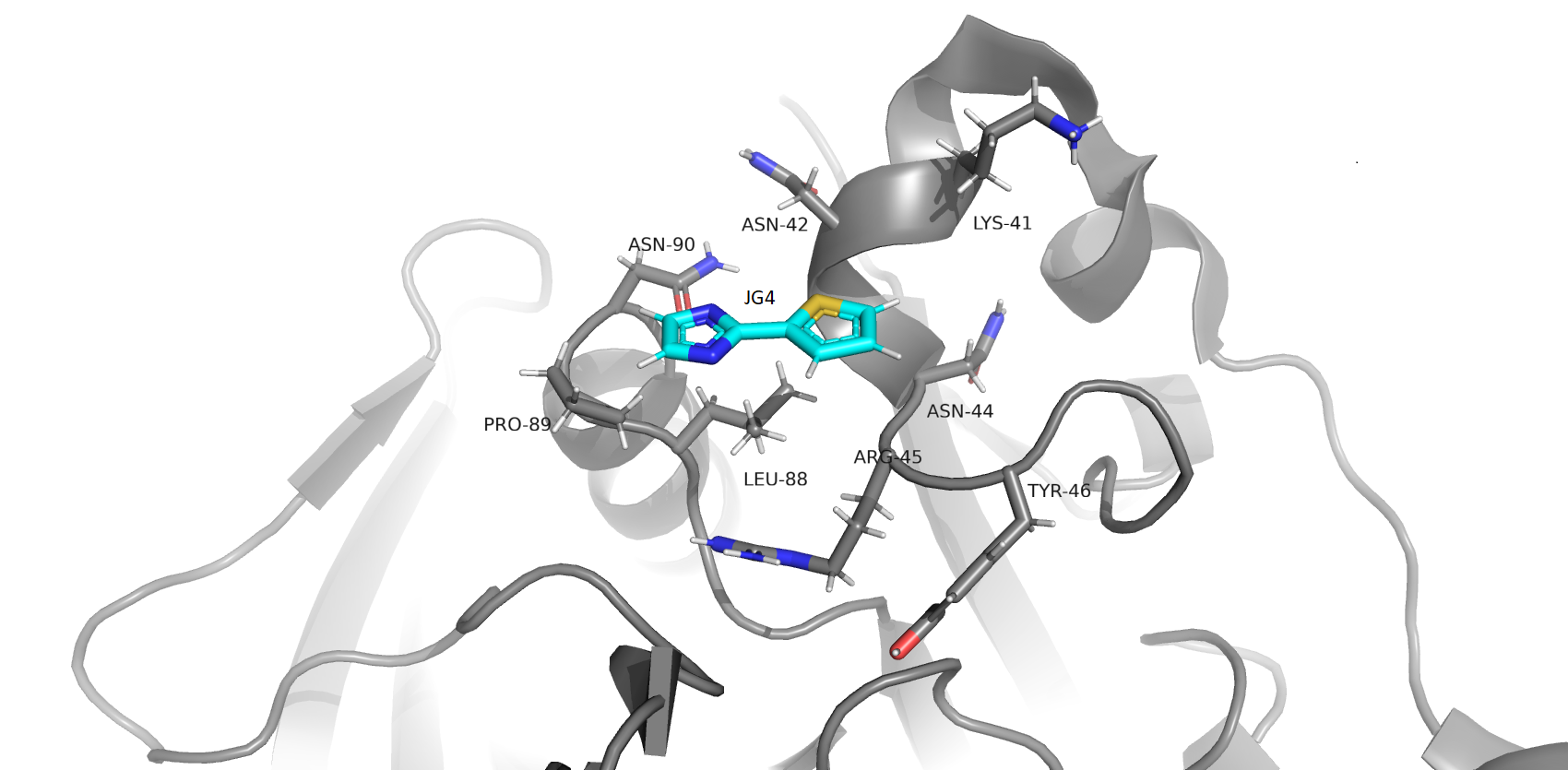
В записи присутствуют 2 малые молекулы:
1) 2-(thiophen-2-yl)-1H-imidazole (JG4)
2) 2-AMINO-2-HYDROXYMETHYL-PROPANE-1,3-DIOL (TRS)