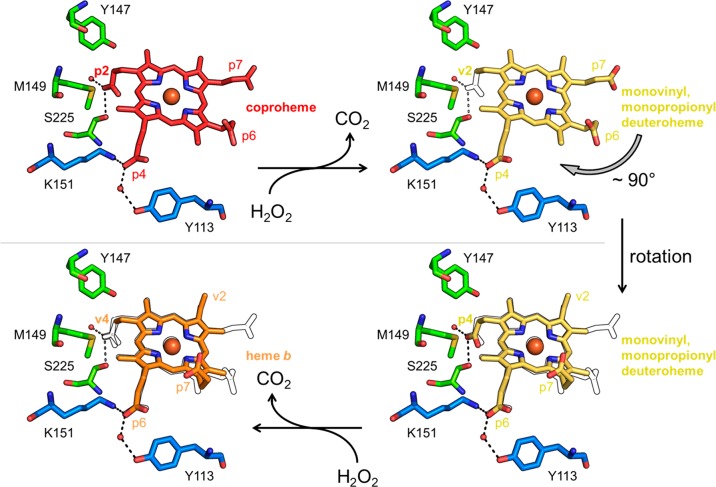
Декарбоксилаза копрогема - гомопентамерный (Hofbauer et al., 2015) белок, катализирующий финальную стадию биосинтеза гема B у ряда бактерий (Michlits et al., 2020). Окисление происходит с участием пероксида водорода; в качестве и субстрата, и кофактора, необходимого для окисления, используется Fe-копропорфирин III (Milazzo et al., 2019).
На рисунке ниже показана схема реакции, катализируемой этой декарбоксилазой:

Бактерия, из которой выделен данный белок - Listeria monocytogenes - внутриклеточный паразит млекопитающих, модельный объект при изучении иммунного ответа у млекопитающих (E. Pamer, 2004).
Длина полипептидной цепи декарбоксилазы копрогема (AC-дентификатор белка Q8Y5F1) составляет 251 аминокислотный остаток, а молекулярная масса белка - 28852 Da. Существование белка подтверждено на уровне белкового продукта, для которого построено 4 пространственных структуры в базе PDB (идентификаторы 4WWC, 5LOQ, 6FXJ, 6FXQ (с лучшим разрешением в 1.69 Å)). В базе UniRef для кластеров UniRef100 UniRef90 и UniRef50 для данного белка содержится соответственно 9, 116 и 3056 записей; в каждом кластере рассматриваемая запись была репрезентативной.
В качестве протеома для сравнения я выбрал протеом Listeria fleischmannii как непатогенного близкого родственника.
Протеом L. monocytogenes помечен как "Близкий к стандартному", а L. fleischmannii как "стандартный", при этом оба протеома референсные.
В таблице ниже указана информация о количестве белков в протеомах (аннотированных и нет):
| L. monocytogenes (up000000817) |
L. fleischmannii (up000250257) | |
|---|---|---|
| Reviewed | 621 | 0 |
| Unreviewed | 2223 | 2943 |
| Total | 2844 | 2943 |
Все белки в обоих протеомах начинаются с метионина (проверено программой в Python, см. ниже)
А в таблице2 указана информация о функциональных группах белков:
| Белки | L. monocytogenes (up000000817) |
L. fleischmannii (up000250257) |
|---|---|---|
| Трансмембранные | 678 (23.8%) | 717 (24.4%) |
| Ферменты | 610 (21.4%) |
1046 (35.5%) |
| Токсические для других организмов (GO:0090729) |
1 | 0 |
Как и ожидалось, у L. fleischmannii не обнаружилось главного белка, обуславливающего патогенность L. monocytogenes - листериолизина О, нужного для проникновения из фагосомы моноцитов в цитоплазму (Scnupf, Portnoy, 2007). Однако в геноме L. fleischmannii присутствует листериолизин-регулирующий белок (найденный при поиске листериолизина). При этом его длина составляет 218 аминокислотных остатков, в то время как листериолизин-регулирующий белок L. monocytogenes длиннее на 19 остатков (237). По моему предположению, это может свидетельствовать о вторичной непатогенности L. fleischmannii.
Для скачивания протеомов использовались команды типа:
wget 'https://www.uniprot.org/uniprot/?query=organism:1671902+AND+proteome:up000250257&format=txt&compress=yes' -O Listeria_fleischmannii.swiss.gz (пример для протеома L. fleischmannii)
Для поиска токсичных для других организмов белков использовали запрос в UniprotKB:
goa:("toxin activity [90729]") AND organism:"Listeria monocytogenes serovar 1/2a (strain ATCC BAA-679 / EGD-e) [169963]" AND proteome:up000000817 (для L. monocytogenes)
Для проверки стартовой аминокислоты белков, количества белков в протеоме (аннотированных и нет) использовались программы в Python, доступные по ссылке:
Блокнот со скриптами в Google Colab1) Hofbauer S. et al. Structure and heme-binding properties of HemQ (chlorite dismutase-like protein) from Listeria monocytogenes //Archives of biochemistry and biophysics. – 2015. – Т. 574. – С. 36-48.
2) Michlits H. et al. Actinobacterial coproheme decarboxylases use histidine as a distal base to promote Compound I formation //ACS catalysis. – 2020. – Т. 10. – №. 10. – С. 5405-5418.
3) Milazzo L. et al. Redox cofactor rotates during its stepwise decarboxylation: molecular mechanism of conversion of coproheme to heme b //ACS catalysis. – 2019. – Т. 9. – №. 8. – С. 6766-6782.
4) Pamer E. G. Immune responses to Listeria monocytogenes //Nature Reviews Immunology. – 2004. – Т. 4. – №. 10. – С. 812-823.
5) Schnupf P., Portnoy D. A. Listeriolysin O: a phagosome-specific lysin //Microbes and infection. – 2007. – Т. 9. – №. 10. – С. 1176-1187.