| Главная | Семестры | Обо мне | Ссылки |
|---|
Остовные водородные связи и элементы вторичной структуры белка RadA (идентификатор PDB 3NTU)
Самым распространенным элементом вторичной структуры белков является α-спираль, или спираль 3,613.
Она стабилизирована за счет водородных связей между NH-группой и СО-группой четвертого по счету аминокислотного остатка.
Таким образом, в протяженных спиральных участках каждый аминокислотный остаток принимает участие в формировании двух водородных связей, при этом на 1 виток приходится 3,6 а.о.
Если пронумеровать атомы с N-конца, то получается, что связь образуется между первым и тринадцатым атомами.
Схема образования α-спирали показана на рис. 1.
На рис. 2 представлен остов (без боковых радикалов аминокислот) одной из α-спиралей белка RadA.
Типичная водородная связь образуется, например, между СО-группой 51-го а.о. (лизина) и NH-группой 55-го а.о. (глицина).
Условно донором протона (водородной связи) можно назвать NH-группу глицина, а акцептором - атом кислорода CO-группы лизина.
В действительности, конечно, атом водорода только смещается к атому кислорода за счет электростатического притяжения.
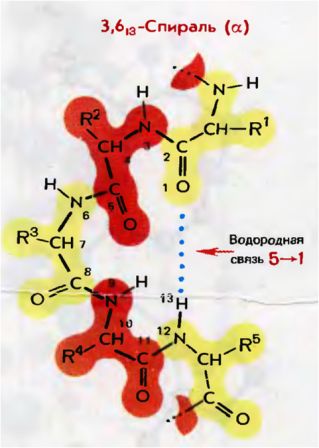
Рис. 1. Образование 3,613-спирали в полипептидной цепи.
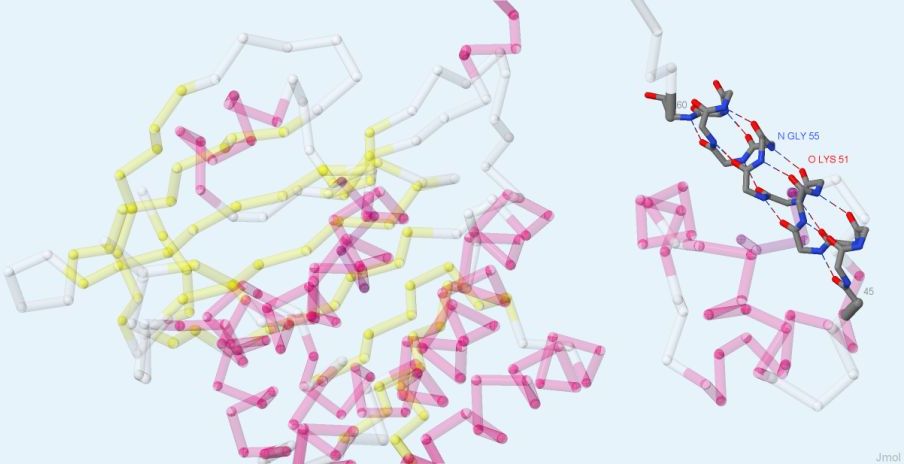
Рис. 2. Остов одной α-спирали белка RadA с водородными связями. Серым цветом показаны атомы углерода, красным - кислорода, синим - азота. Отмечены номерами первый и последний остатки спирали. Получено с помощью Jmol.
Также в белке RadA присутствуют β-листы. Их расположение и направление (от N-конца к C-концу) показано на рис. 3.
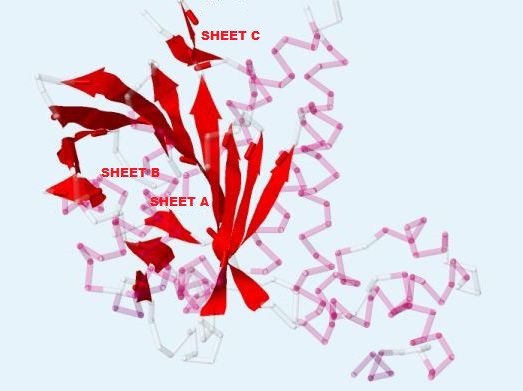
Рис. 3. Расположение и направление β-листов (выделены красным) в белке RadA. Получено с помощью Jmol.
Как видно из рис.3, всего в белке RadA 3 β-листа. Их нумерация соответствует таковой в PDB-файле. Листы А и С содержат антипараллельные соседние тяжи, а лист В представлен пятью параллельными друг другу и далее тремя антипараллельными им цепями. На рис. 4 можно посмотреть на остовные водородные связи между цепями в β-листах.
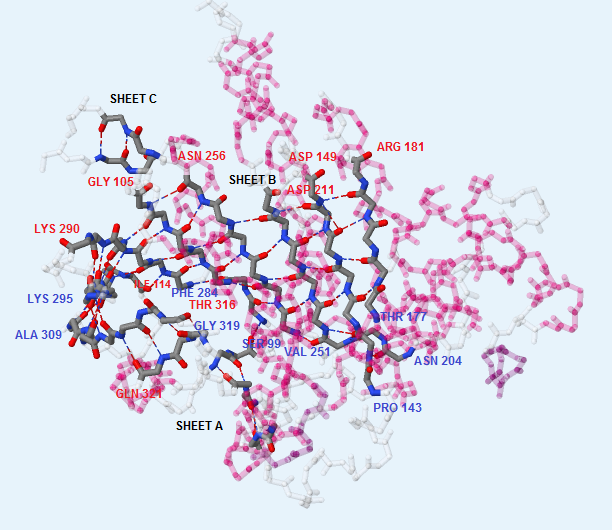
Рис. 4. Расположение и остовные водородные связи β-листов в белке RadA. Серым цветом показаны атомы углерода, красным - кислорода, синим - азота. Подписаны начало (синим) и конец (красным) каждого тяжа листа B. Получено с помощью Jmol.