| Главная | Семестры | Обо мне | Ссылки |
|---|
Внутримолекулярные взаимодействия боковых цепей: солевые мостики, водородные связи, дисульфидные связи
Солевые мостики - электростатические взаимодействия между положительно и отрицательно заряженными аминокислотами в белке. Длина связи не превышает 3,5 ангстрема.
В Jmol все солевые мостики можно выделить следующим образом:
- запустить скрипт atom-types.spt (загрузить)
- выполнить команду:
hbpositive - атомы азота боковых радикалов положительно заряженных аминокислот (Lys, Arg)
hbnegative - атомы кислорода боковых радикалов отрицательно заряженных аминокислот (Asp, Glu)
В белке RadA нашлось 16 солевых мостиков. Все солевые мостики показаны на рис. 1.
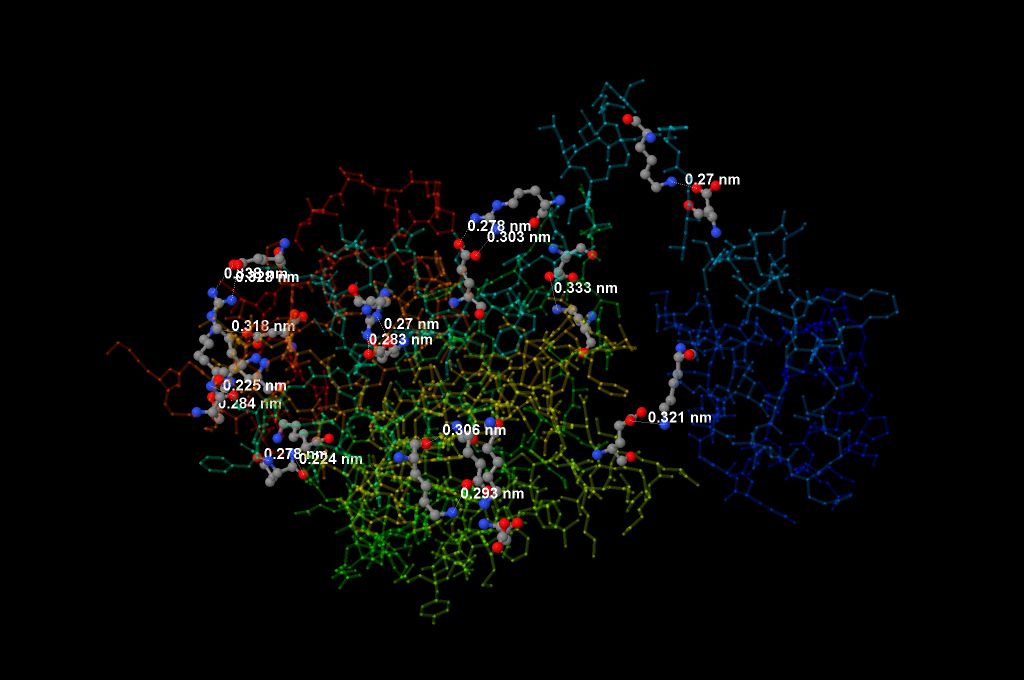
Рис. 1. Солевые мостики между аминокислотами белка RadA. Образующие их аминокислоты покрашены по типу атомов, указаны расстояния между атомами кислорода и азота. Получено с помощью Jmol.
Рассмотрим более детально один из солевых мостиков белка. На рис. 2 представлено изображение солевого мостика между атомом азота лизина и атомом кислорода аспарагиновой кислоты (атомы расположены в радикалах). Азот - донор водорода, кислород - акцептор.
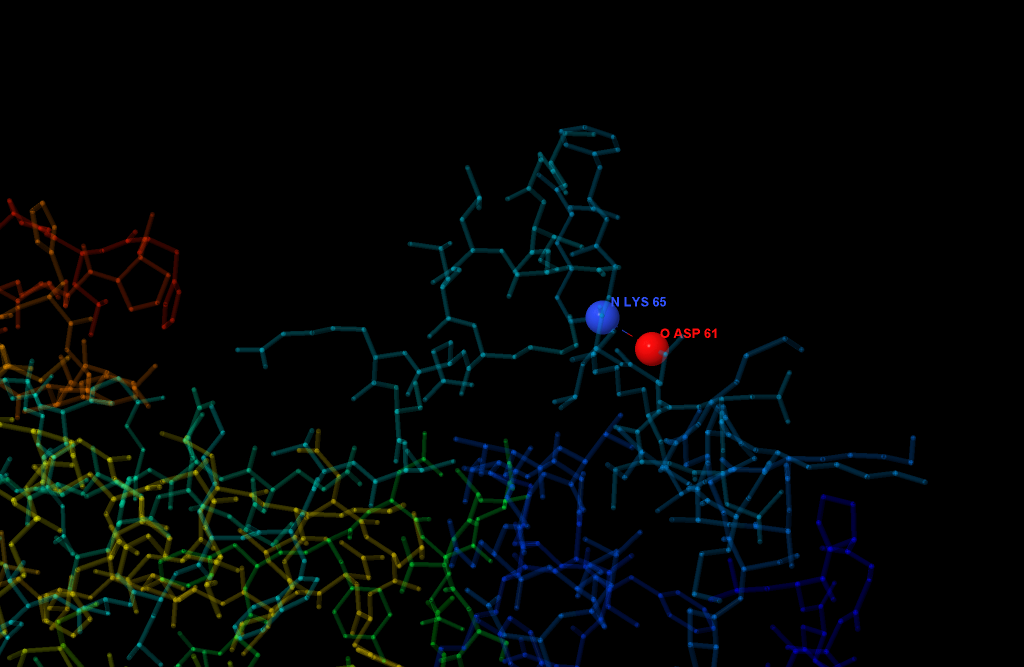
Рис. 2. Один из солевых мостиков белка RadA. Расстояние между атомами 2.7 ангстрема. Получено с помощью Jmol.
Между радикалами аминокислот существуют и водородные связи, не являющиеся солевыми мостиками. На рис. 3 можно увидеть атомы радикалов, образующие водородную связь. Атом азота аргинина - донор протона, атом кислорода глутамина - соответственно, акцептор.
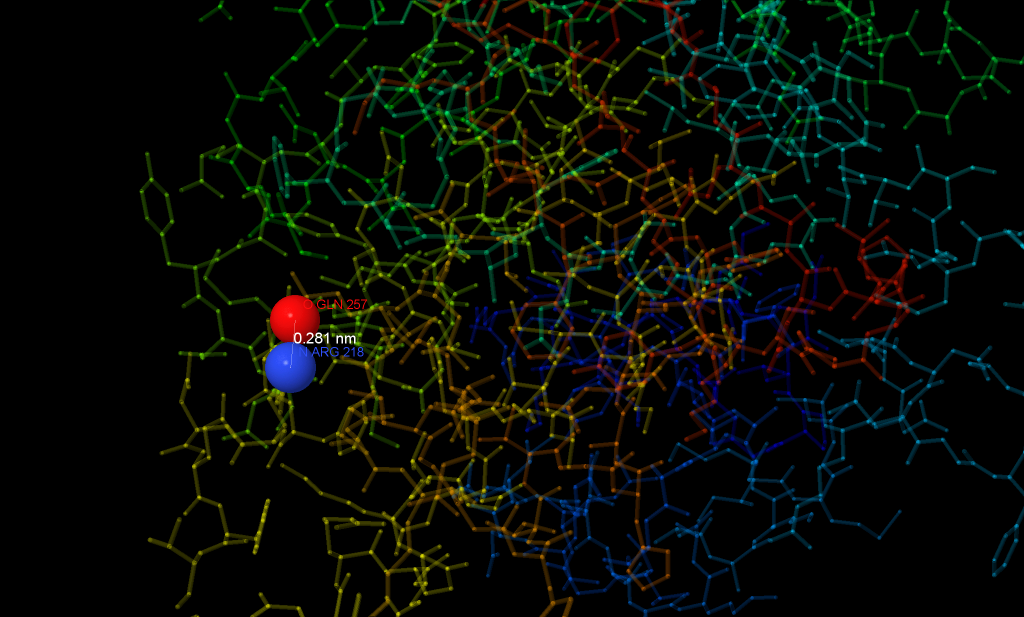
Рис. 3. Атомы, образующие водородную связь. Получено с помощью Jmol.
Третичная структура белка также часто поддерживается дисульфидными связями, образованными двумя остатками цистеина. В белке RadA таких связей нет, поэтому рассмотрим такие связи на примере инсулина (идентификатор PDB 1AI0). Дисульфидные связи как бы "сшивают" вместе 6 цепей этого белка. Все дисульфидные мостики инсулина показаны на рис. 4.
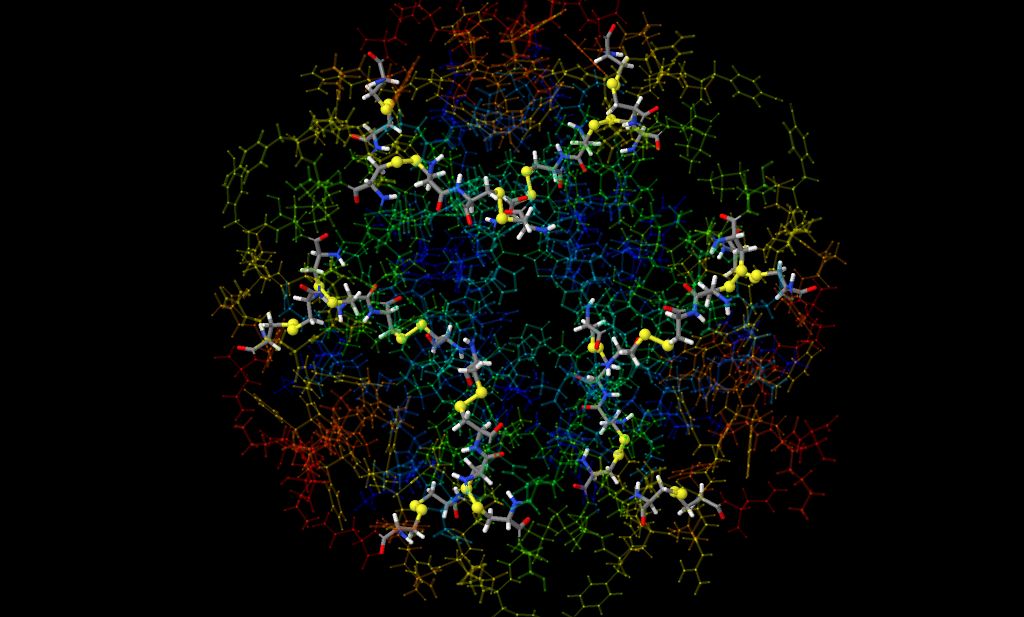
Рис. 4. Дисульфидные связи в составе инсулина. Остатки цистеина покрашены по типу атомов. Получено с помощью Jmol.
Детальное изображение дисульфидного мостика представлено на рис.5.
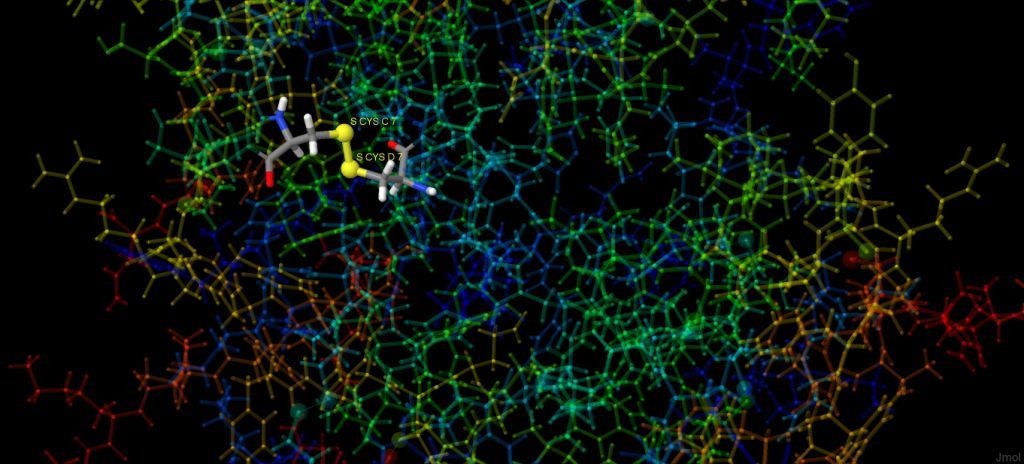
Рис. 5. Дисульфидный мостик между цепями C и D инсулина. Расстояние между атомами серы 2.02 ангстрема.