| Главная | Семестры | Обо мне | Ссылки |
|---|
Мембранные белки. Предсказание TMHMM
Данный мне трансмембранный белок - мускариновый ацетилхолиновый рецептор М3 из серой крысы Rattus norvegicus, идентификатор PDB 4U15.
Для составления репрезентативной выборки гомологов данного белка был проведен PSI-BLAST по базе Refseq с исключением типа Хордовые (Chordata).
После четырех итераций были выбраны 30 последовательностей из разных организмов, принадлежащих к разным таксонам.
У бактерий и архей нет достоверных гомологов данного белка, поэтому все 30 находок принадлежат эукариотам.
Полученные последовательности вместе с исходной были выровнены с помощью Muscle.
Выравнивание показано на рис. 1.
В проекте JalView отмечены участки, соответствующие трансмембранным спиралям данного мне белка (TM_REAL).
Также отмечены участки, предсказанные сервисом TMHMM (TM_PREDICTED).
Выравнивание: загрузить.
Проект JalView: загрузить.

Рис. 1. Выравнивание последовательности данного мне белка (верхняя последовательность) с его гомологами. Получено с помощью JalView. Цветовая схема ClustalX, с параметром "Above Identity Threshold" 30%
На рис. 2 представлена трехмерная структура данного мне белка. Цветовая схема ClustalX ("Above Identity Threshold" 30%) дает возможность визуально различить гидрофобные и гидрофильные остатки. Структура белка ориентирована так, что его часть, обращенная в n-сторону мембраны, находится сверху.
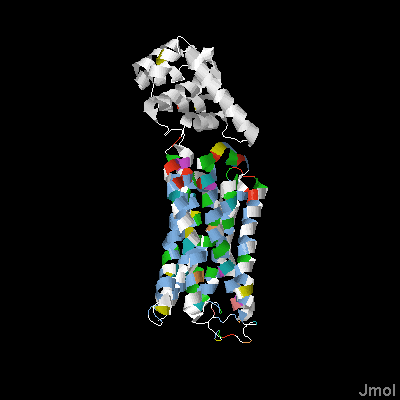
Рис. 2. Трехмерная структура ацетилхолиного рецептора (идентификатор PDB 4U15). Получено с помощью Jmol. Цветовая схема ClustalX, с параметром "Above Identity Threshold" 30%, вверх ориентирована та часть белка, что находится с n-стороны мембраны
Судя по выравниванию, участки, соответствующие трансмембранным спиралям, более консервативны, чем остальные позиции белка. Они образуют консервативные блоки, причем эти блоки содержат большое количество гидрофобных аминокислот (окрашены синим в ClustalX). Участки между спиралями очень небольшие, видимо, несут лишь структурную функцию, так как сильно различаются в последовательностях.
Внутри канала не наблюдается заряженных аминокислот. Они есть в небольшом количестве на краю трансмембранного комплекса: положительно заряженные аминокислотные остатки, которые, как и ожидалось, расположены на n-стороне мембраны.
Верхняя часть белка, обращенная к цитоплазме, очень различается у организмов (позиции в выравнивании 700-1400). Если обратиться к функции данного белка, то можно предположить, что верхняя часть играет роль "шара на цепи", то есть играет структурную роль, открывая и закрывая трансмембранный канал изнутри. Поэтому аминокислотные остатки в этой части не очень важны, и не сохраняются в ходе эволюции.
Предсказание TMHMM определило все протяженные трансмембранные альфа-спирали, хотя в большинстве случаев в каждой предсказанной спирали было меньше аминокислотных остатков, чем в реальной структуре, то есть не были предсказаны концы спиралей. Общая схема трансмембранных участков в белке показана верно. Таким образом, TMHMM можно использовать для приблизительной оценки трансмембранных областей в составе белка.