Внутримолекулярные взаимодействия в белке CRH из PDB-файла с идентификатором 1ZVV
Общая характеристика структур из PDB-файла с идентификатором 1ZVV.
В базе данных PDB (Protein Data Bank), идентификатору 1ZVV, отвечает файл,
описывающий структуру комплекса ДНК с двумя белками:
- DNA recognition strand CRE (цепи: O, R, T), или собственно цепь ДНК,
с которой белки образуют комплекс (см.рис.1,2).
- Glucose-resistance amylase regulator(синоним: CCPA - CATABOLITE CONTROL PROTEIN A; цепи: A, B, G),
или, контролирующий метаболизм, белок А (см.рис.1,2).
- HPr-like protein CRH(синоним: CRH - CATABOLITE REPRESSION HPR; цепи: J, P, W),
или, репрессирующий метаболизм, гистидинсодержащий белок (см.рис.1,2).
Однако, представленная в данном файле структура, биологически бессмыслена (рис. 1.). Она является лишь одним из вариантов
взаимного расположения нескольких сруктурных единиц, определенных рентгеноструктурным анализом.
Но, благодаря помощи Андрея Владимировича Алексеевского, которому удалось модифицировать PDB-файл
и переставить структурные единицы, была получена биологически-осмысленная структура. В этом варианте, тетрамер белка, состоящий из двух белков А и двух
гистидинсодержащих белков, связан с двухцепочечной ДНК (рис. 2.).
 |
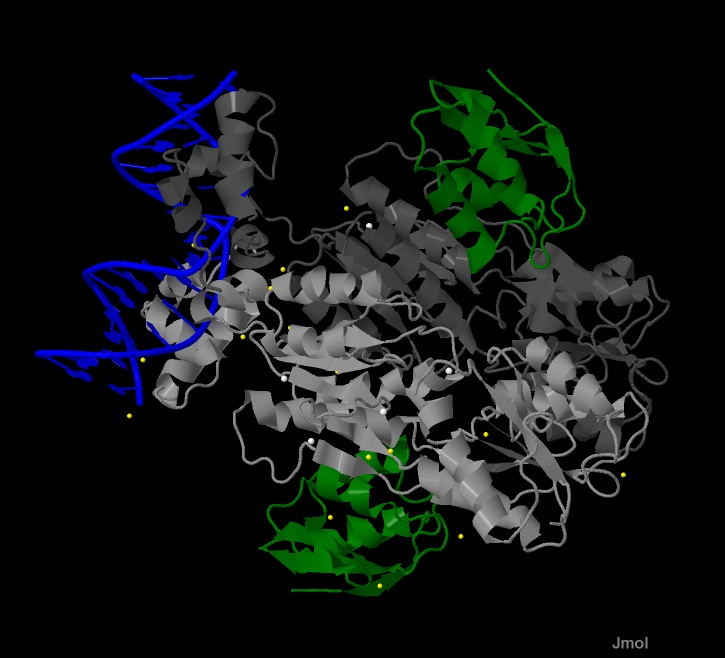 |
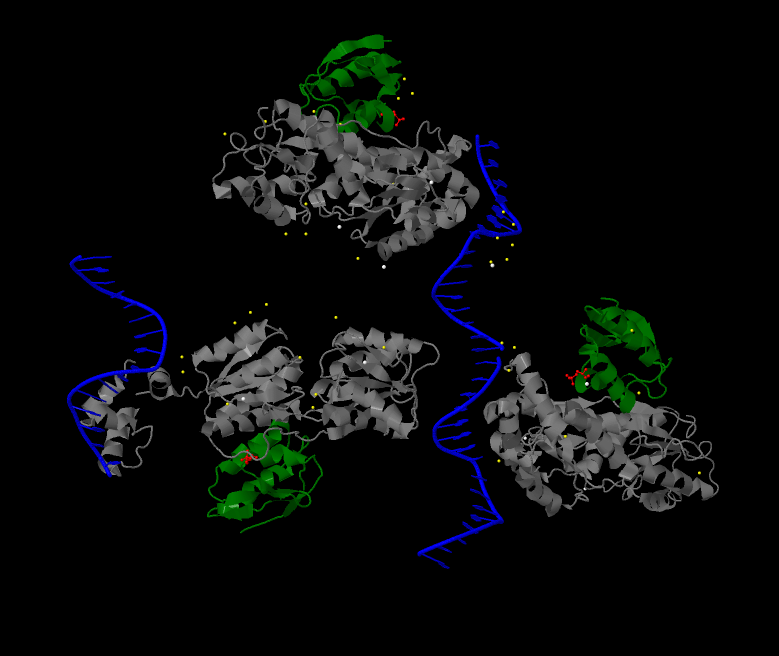
Рис.1 (справа). Структура комплекса ДНК с белком ССРА и белком CRH.
На рисунке показана структура комплекса белков с ДНК. ДНК выделена синим цветом. Белки
отображены с помощью cartoon. 3 цепи белка А (ССРА) выделены серым цветом. 3 цепи гистидинсодержащего белка
(CRH) выделены зеленым. В каждой цепи CRH, красным цветом и оформлением wireframe и cpk показаны фосфорилированные аминокислотные остатки 46х
серинов. Молекулы воды выделены желтым. Молекулы лиганда (IOD?) показаны белым.
|
Рис.2 (слева). Биологически-осмысленная структура комплекса ДНК с белком ССРА и белком CRH.
На рисунке показана структура биологической осмысленной единицы комплекса белков с двухцепочечной ДНК. ДНК выделена синим цветом. Белки
отображены с помощью cartoon. 2 цепи белка А (ССРА) выделены оттенками серого. 2 цепи гистидинсодержащего белка
(CRH) выделены зеленым. Молекулы воды выделены желтым. Молекулы лиганда (IOD?) показаны белым.
|
В дальнейшем, мы будем работать только с белком CRH (Uniprot_AC: O06976).
Информация о белке CRH, представлена в таблице 1:
| Параметр: |
Значение: |
| Идентификатор PDB |
1ZVV |
| Идентификатор Uniprot_AC |
O06976 |
| Название белка |
Английское: HPr-like protein CRH
Русское: гистидинсодержащий белок, репрессирующий метаболизм |
| Количество разных цепей |
J, P, W |
| Лиганды, субстраты (все что не белок и не вода) |
ДНК (3 цепи); иод (11 атомов);
фосфатная группа, присоединенная к 46 серину (3) |
Гистидинсодержащий белок состоит из 85 аминокислотных остатков.
Его последовательность в fasta-формате:
>O06976 catabolite repression HPr-like protein
MVQQKVEVRLKTGLQARPAALFVQEANRFTSDVFLEKDGKKVNAK
SIMGLMSLAVSTGTEVTLIAQGEDEQEALEKLAAYVQEEV
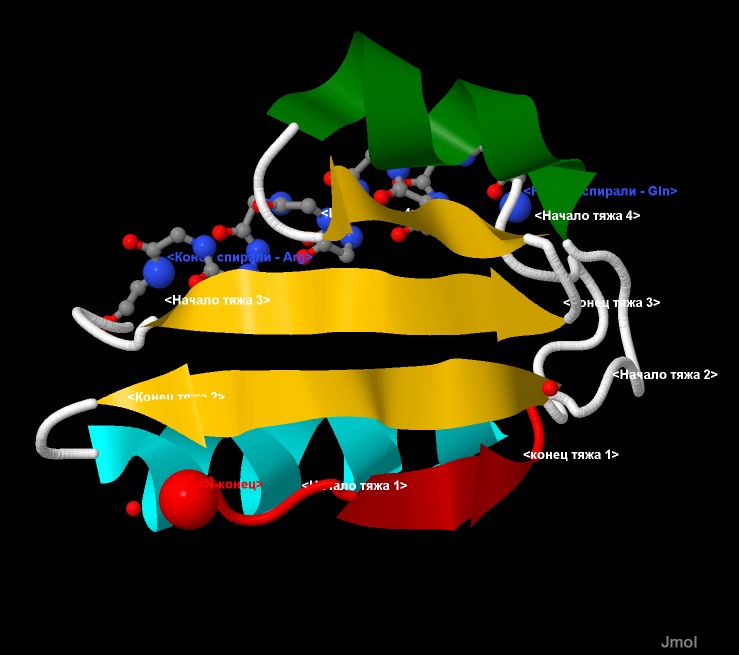
На рис.3 и 4, представлена 3D визуализация данного белка методами программы JMol. Отображение с помощью команды cartoon
позволяет показать элементы вторичной структуры: зеленым и светлоголубым выделены α-спиралные участки, а красным и желтым - β-лист.
Заметно, что направление β-тяжей (направление стрелок - от N-конца к С-концу) - антипараллельное. Для облегчения определения направления хода
цепи белка, ее начало (первый β-тяж) выделено красным, а конец (последняя α-спираль) - светлоголубым. Терминальные атомы выделены командой cpk
и подписаны как N- и С-конец соотоветственно.
 |
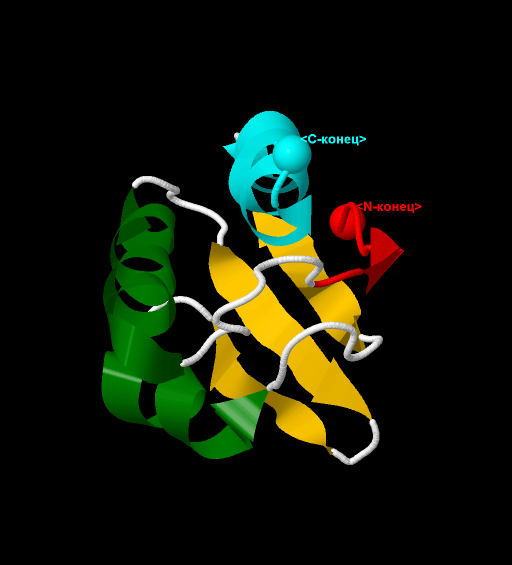 |
Рис.3, 4. Структура белка CRH.
Отображение с помощью команды cartoon. Элементы вторичной структуры: зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное. Терминальные атомы выделены командой cpk и подписаны как N- и С-конец соотоветственно.
|
Структура комплекса CRH с белком А, показана на рис.5. У белка А, красным цветом выделено начало цепи (первая α-спираль), а конец -
последний β-тяж - синим. Терминальные атомы выделены командой cpk и подписаны как N- и С-конец соотоветственно.
Фиолетовым цветом на белке А выделена часть структуры, наиболее плотно контактирующая с гистидинсодержащим белком.
Оранжевым, на белке А выделен крупный β-лист, состоящий из 6 тяжей. Заметно, что стрелки, маркирующие тяжи - соноправленны, следовательно,
направление тяжей - параллельное. Остальная часть белка А имеет серый цвет.
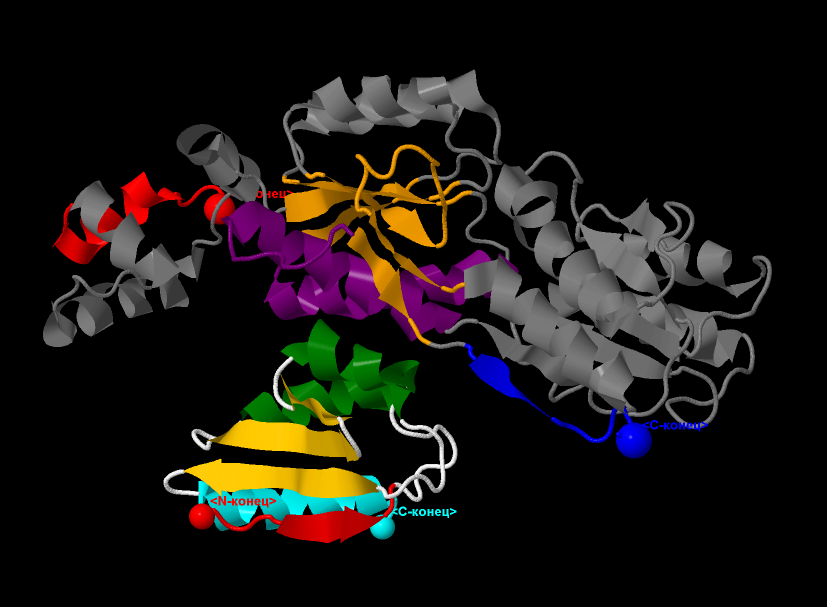 |
Рис.5. Структура комплекса CRH с белком А.
Белок А: красным цветом выделено начало цепи; конец цепи - синим.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно.Фиолетовым цветом на белке А выделена
часть структуры, наиболее плотно контактирующая с гистидинсодержащим белком.
Оранжевым выделен крупный β-лист, состоящий из 6 параллельных тяжей.
|
Структура белкового комплекса с ДНК, показана на рис.6. ДНК выделено розовым цветом.
Синезеленым цветом на белке А показан домен, состоящий из 4 α-спиралей, плотно контактирующий с цепью ДНК.
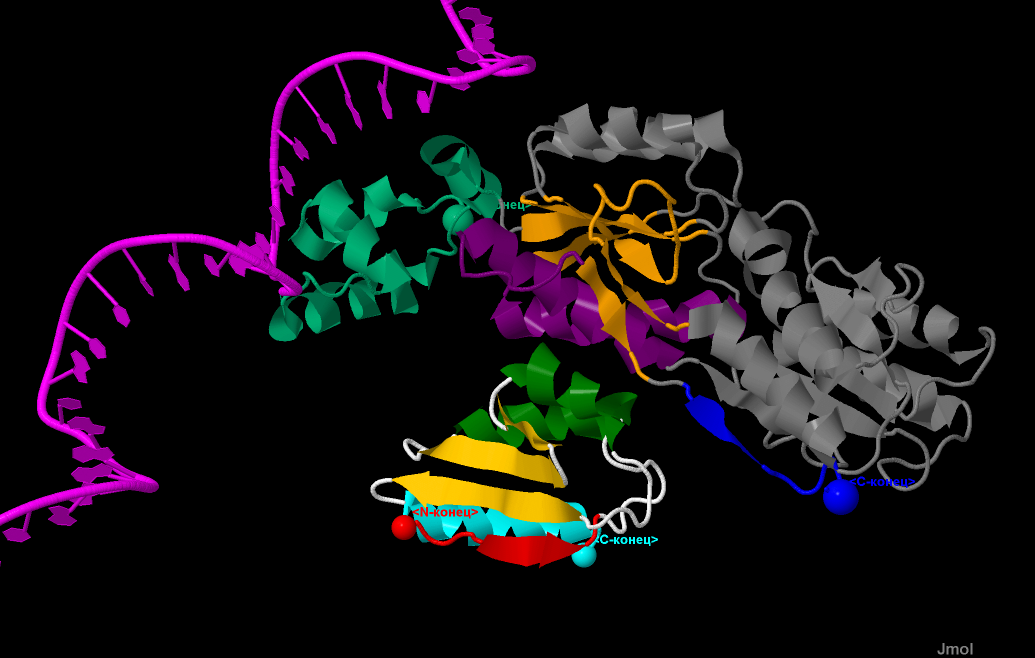 |
Рис.6. Структура комплекса CRH-белок А-ДНК.
ДНК показано розовым (одинарная цепь состоящая из 2хучастков).
Белок А: красным цветом выделено начало цепи; конец цепи - синим.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно.Фиолетовым цветом на белке А выделена
часть структуры, наиболее плотно контактирующая с гистидинсодержащим белком.
Оранжевым выделен крупный β-лист, состоящий из 6 параллельных тяжей.
Синезеленым на белке А показан домен, состоящий из 4 α-спиралей,
плотно контактирующий с цепью ДНК.
СRН: элементы вторичной структуры:
зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное.
Терминальные атомы выделены командой cpk и подписаны как N- и С-конец соотоветственно.
|
Анализ структуры альфа-спиралей и бета-листов в цепи P белка с кодом PDB 1ZVV
С помощью программы JMol был проведен анализ элементов вторичной структуры исследуемого белка - α-спиралей и β-листов.
Были изучены следующие качественные и количественные параметры:
- α-спираль
- Шаг витка α-спирали
- Количество аминокислотных остатков, приходящихся на 1 виток спирали
- Расположение водородных связей в α-спирали
- β-лист
- Параллельные и антипараллельные β-листы
- Плоские и выпуклые β-листы
α-спираль
Полученные результаты для α-спирали, следующей, начиная от 16, заканчивая 28 остатком (cм. рис.7.):
Шаг спирали определялся, как отношение общей длины спирали (18,98 Å) к числу ее витков (примерно 3,5): 5,42 Å.
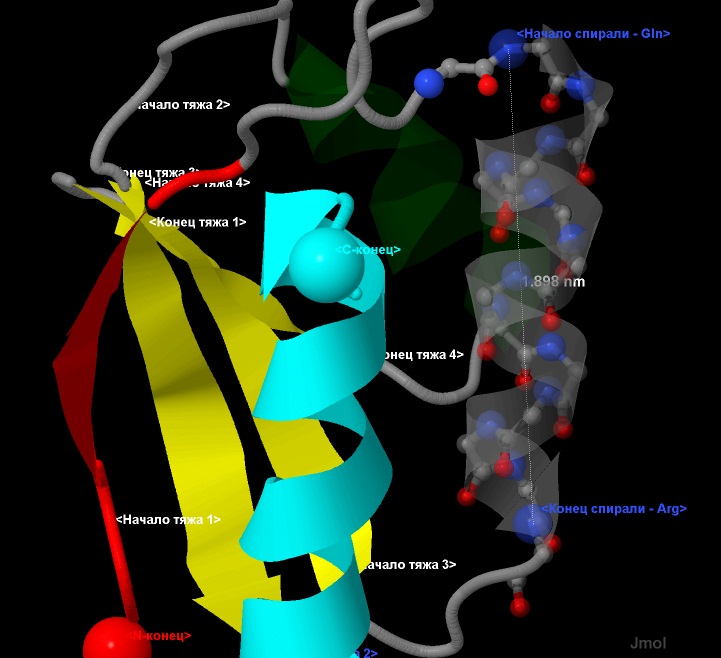 |
Рис.7. Геометрические параметры α-спирали - шаг спирали.
Исследуемая α-спираль показана в виде wireframe+cpk+cartoon, с прозрачностью 0,5.
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Отдельно выделены начало и конец спирали.
Элементы вторичной структуры:
зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно. Длины указаны в нанометрах (nm).
|
Количество аминокислотных остатков, приходящихся на один виток спирали, определялось двумя способами:
- Как отношение общего количества остатков в спирали к числу витков: 12 остатков/3,5 витка = 3,4 остатка на виток.
- Визуально, при рассмотрении одного витка спирали: между 3,5 и 4 остатками на виток, точнее определить нельзя. (рис.8.)
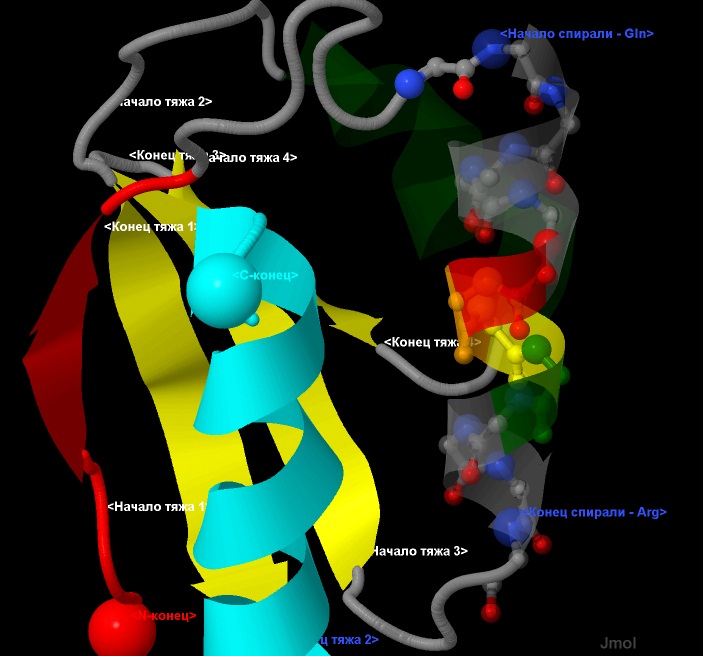 |
Рис.8. Геометрические параметры α-спирали - количество остатков на виток.
Исследуемая α-спираль показана в виде wireframe+cpk+cartoon, с прозрачностью 0,5.
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Отдельно выделены начало и конец спирали.
Элементы вторичной структуры:
зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно.
Расстояния показаны пунктирными линиями. Длины указаны в нанометрах (nm).
Для наглядности, остатки одиного из витков раскрашены в разные цвета.
|
В α-спирали образование водородных связей происходит между атомами азота (донор протона) и кислорода (акцептор протона) (см. рис.9)
Длина водородных связей (Å): 2.83, 3.00, 2.66, 2.49, 2.98, 3.61, 2.96.
Среднее значение (Å): 2,93.
 |
Рис.9. Геометрические параметры α-спирали - длина водородных связей.
Исследуемая α-спираль показана в виде wireframe+cpk+cartoon, с прозрачностью 0,5.
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Отдельно выделены начало и конец спирали.
Элементы вторичной структуры:
зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно.
Расстояния показаны пунктирными линиями. Длины указаны в нанометрах (nm).
|
Образование водородных связей происходит с n+4 и n-4 остатками (если у рассматриваемого остатка номер - n). В данном случае (рис.10.),
рассматривался остаток 21, образующий водородные связи с 17 и 25 остатками.
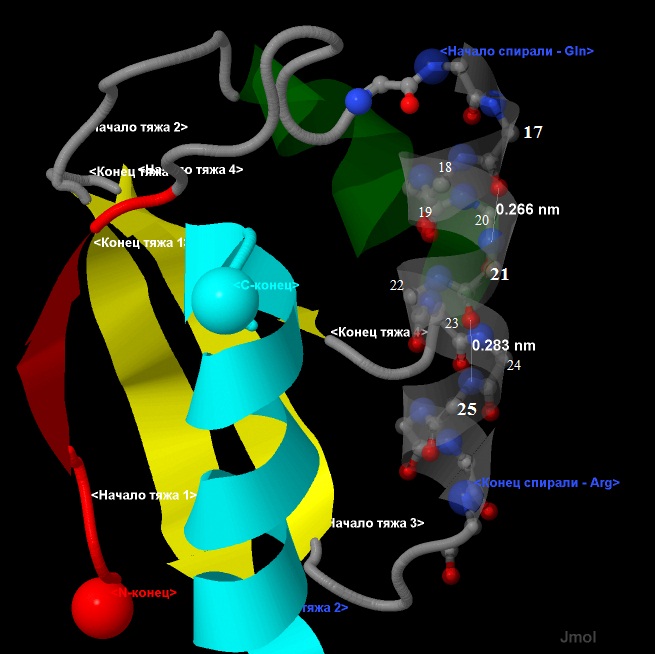 |
Рис.10. Геометрические параметры α-спирали - образование водородных связей.
Исследуемая α-спираль показана в виде wireframe+cpk+cartoon, с прозрачностью 0,5.
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Отдельно выделены начало и конец спирали.
Элементы вторичной структуры:
зеленым и светлоголубым выделены α-спиралные участки,
а красным и желтым - β-лист.
Направление тяжей - антипараллельное.
Терминальные атомы выделены командой cpk и подписаны как
N- и С-конец соотоветственно.
Расстояния показаны пунктирными линиями. Длины указаны в нанометрах (nm).
Аминокислотные остатки пронумерованны.
|
β-лист
В белке HPR имеется обширный β-лист, состоящий из 4 тяжей. Тяжи располагаются антипараллельно. (см. рис.11)
Лист образует выпуклую винтовую поверхность (см. рис.12)
 |
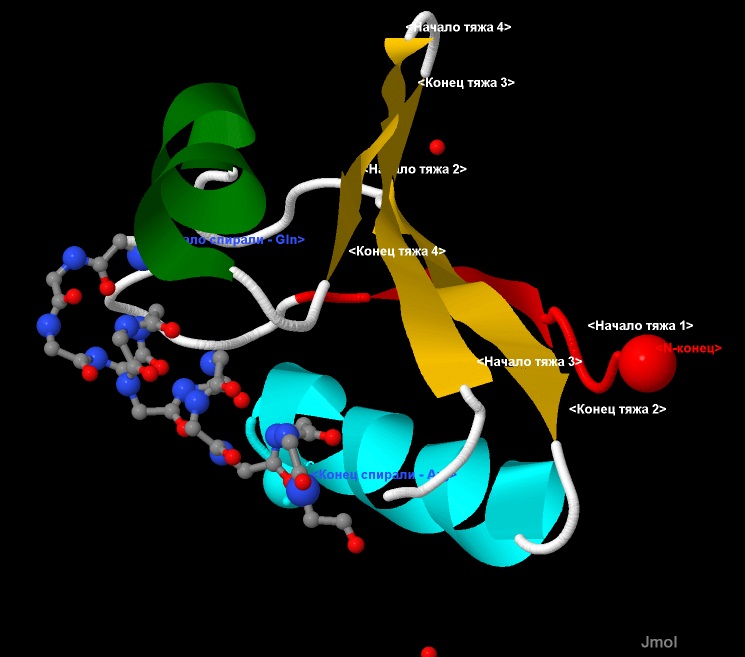 |
Рис.11. Структура β-листа.
В белке HPR имеется обширный β-лист, состоящий из 4 антипараллельных тяжей.
Обозначены начало и конец каждого тяжа.
|
Рис.12. Топология β-листа.
В белке HPR имеется обширный β-лист, образующий выпуклую винтовую поверхность.
Обозначены начало и конец каждого тяжа.
|
Результаты исследования геометрии и топологии элементов вторичной структуры белка CRH, представлены в таблице 2:
| Параметр: |
Значение: |
| α-спираль |
| Шаг витка α-спирали (средн. знач.)(Å) |
4.14 |
Количество аминокислотных остатков,
приходящихся на 1 виток спирали |
Примерно 4 |
| Расположение водородных связей в α-спирали |
Связи образуются с каждой пятой аминокислотой |
| Средняя длина водородных связей (Å) |
2.93 |
| β-лист |
| Направление β-тяжей в β-листе |
Антипараллельное |
| Топология листа |
Выпукло-вогнутая винтовая поверхность |
Внутримолекулярные взаимодействия боковых групп белка в цепи P структуры 1ZVV
Дисульфидные мостики.
Дисульфидные мостики, это ковалентные связи между остатками цистейнов,
находящихся в разных местах цепи белка, сшивающие петли белка между собой.
С помощью программы JMol, было установлено, что ни в белке А, ни в CRH нет Cys остатков.
Следовательно, в них не может быть и дисульфидных мостиков.
Солевые мостики.
Солевые мостики - разновидность координационных взаимодействий между разноименно-заряжеными группами атомов.
Как следует из определения, это взаимодействия между положительно- и отрицательнозаряженными радикалами аминокислот (рис.13).
Как известно, отрицательнозаряженные радикалы есть у Asp и Glu, а положительно- - у Lys и Arg. Следовательно, теоретически может быть
4 типа солевых мостиков.
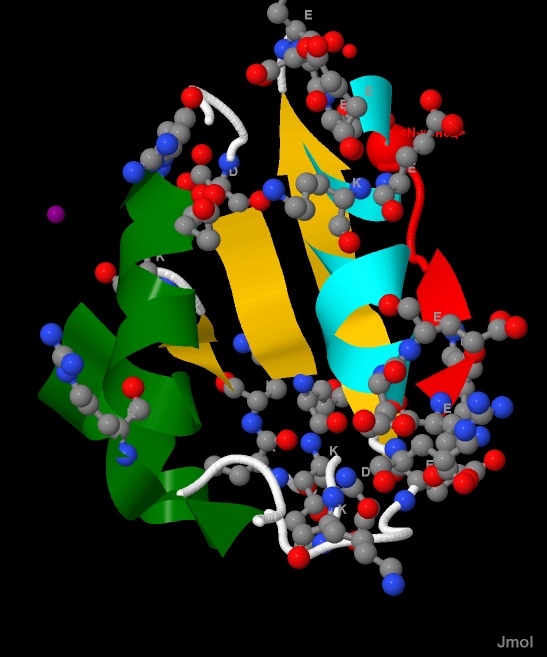 |
Рис.13. Расположение заряженных аминокислот в белке CRH.
Заряженные аминокислотные остатки (Lys, Arg, Glu, Asp) показаны в виде wireframe+cpk,
и подписаны однобуквенными названиями (К, R, E, D).
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
|
Первый шаг поиска: анализируем взаимное расположение Arg и Glu (см.рис.14).
Измерения, проведенные в программе, не показали наличия солевых мостиков, т.к. были получены слишком большие расстояния между заряженными группами.
 |
Рис.14. Взаимное расположение радикалов Arg и Glu в белке CRH.
Аминокислотные остатки Arg и Glu показаны в виде wireframe+cpk,
и подписаны однобуквенными названиями (R, E).
Расстояния между группами атомов показаны пунктиром, длины даны в нанометрах (nm).
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Остальной белок показан в виде backbone 50.
|
Второй шаг поиска: анализируем взаимное расположение Arg и Asp (см.рис.15).
Измерения, проведенные в программе, не показали наличия солевых мостиков, т.к. были получены слишком большие расстояния между заряженными группами.
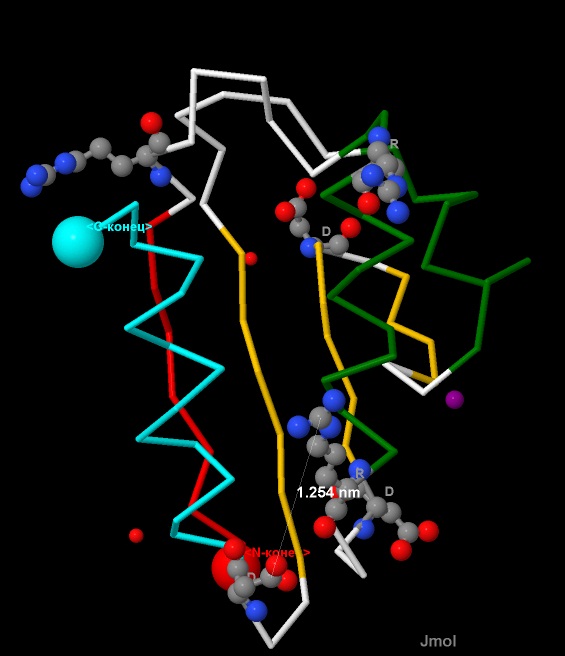 |
Рис.15. Взаимное расположение радикалов Arg и Asp в белке CRH.
Аминокислотные остатки Arg и Asp показаны в виде wireframe+cpk,
и подписаны однобуквенными названиями (R, D).
Расстояния между группами атомов показаны пунктиром, длины даны в нанометрах (nm).
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Остальной белок показан в виде backbone 50.
|
Третий шаг поиска: анализируем взаимное расположение Lys и Asp (см.рис.16).
Измерения, проведенные в программе, не показали наличия солевых мостиков, т.к. были получены слишком большие расстояния между заряженными группами.
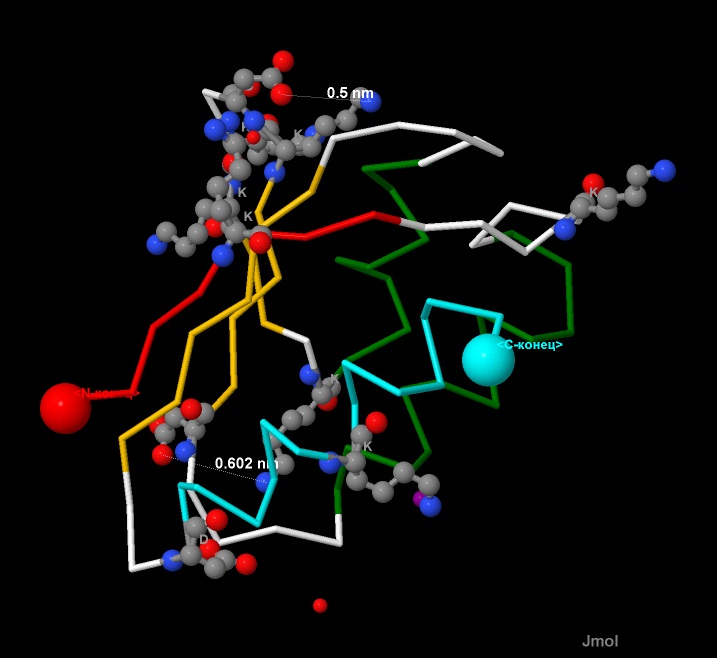 |
Рис.16. Взаимное расположение радикалов Lys и Asp в белке CRH.
Аминокислотные остатки Lys и Asp показаны в виде wireframe+cpk,
и подписаны однобуквенными названиями (K, D).
Расстояния между группами атомов показаны пунктиром, длины даны в нанометрах (nm).
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Остальной белок показан в виде backbone 50.
|
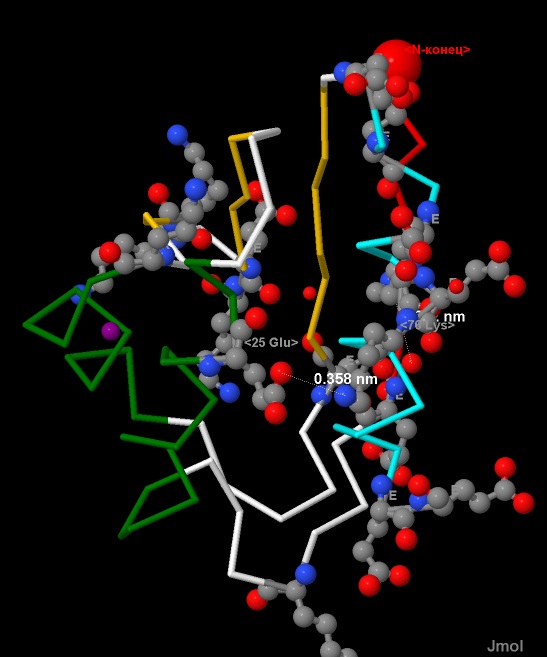
Четвертый шаг поиска: анализируем взаимное расположение Lys и Glu (см.рис.17).
Измерения, проведенные в программе, показали возможное существование солевого мостика между 25 Glu и 76 Lys, длиной 3,58 Å (см.рис.14).
 |
 |
Рис.17. Взаимное расположение радикалов Lys и Glu в белке CRH.
Аминокислотные остатки Lys и Glu показаны в виде wireframe+cpk,
и подписаны однобуквенными названиями (K, E).
Расстояния между группами атомов показаны пунктиром,
длины даны в нанометрах (nm).
Атомы имеют стандартную окраску - азот-синий, кислород-красный, углерод-серый.
Остальной белок показан в виде backbone 50.
|
Рис.18. Образование солевого мостика между 76 Lys и 25 Glu в цепи Р белка CRH. |
Результаты исследования внутримолекулярных взаимодействий, формирующих третичную структуру белка, представлены в таблице 3:
| Дисульфидные мостики |
В молекуле не найдено цистеинов |
| Солевые мостики |
Предположительно найден 1 солевой мостик,
между 25 остатком глутамата и 76 остатком лизина. |
| Длина солевого мостика (Å) |
3.58 |
© 2012; Sutormin Dmitry

















