| Запрос |
Запрос как его понял PubMed из Search details |
Всего находок |
Всего в открытом доступе |
Всего обзоров |
| (Bcl2[Title]) AND apoptosis[Title] |
Bcl2[Title] AND apoptosis[Title] |
90 |
41 |
6 |
| (Bcl2[Title]) AND apoptosis AND ("Nature"[Journal] OR "Cell"[Journal]) |
Bcl2[Title] AND ("apoptosis"[MeSH Terms] OR "apoptosis"[All Fields]) AND ("Nature"[Journal] OR "Cell"[Journal]) |
3 |
1 |
0 |
| (Bcl2[Title]) AND function[Title] |
Bcl2[Title] AND function[Title] AND "loattrfree full text"[sb] |
9 |
6. В PubMed Central - 5 |
1 |
| |
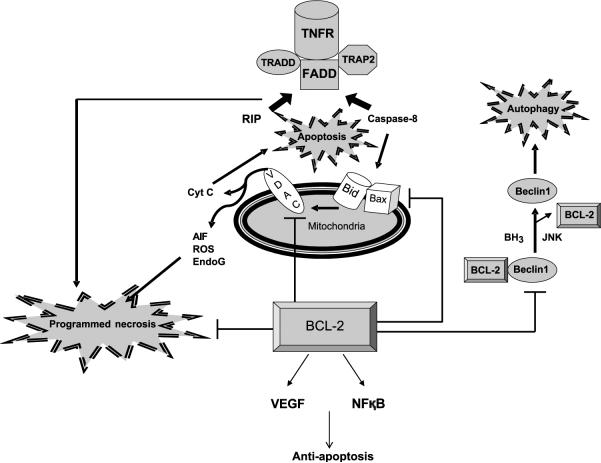
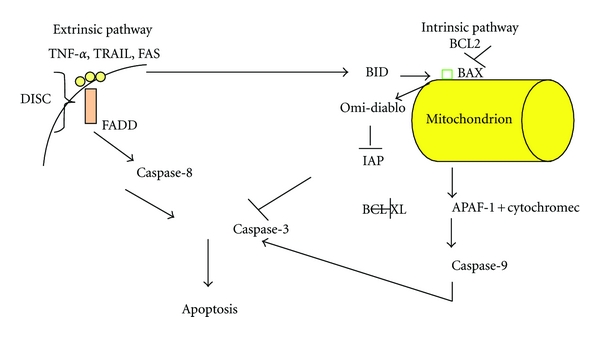
Related citation статьи Regulated cell death pathways: new twists in modulation of BCL2 family function.
Sasi N, Hwang M, Jaboin J, Csiki I, Lu B. на статью: Bcl-2 family proteins and cancer. Yip KW, Reed JC. |
|
Хотя это и не указано явно, обзор является открытым. |
|
| (Bcl2[Title]) AND function AND properties |
Bcl2[Title] AND ("physiology"[Subheading] OR "physiology"[All Fields] OR "function"[All Fields] OR "physiology"[MeSH Terms] OR "function"[All Fields]) AND properties[All Fields] |
17 |
9 |
1 |
Наилучшим, с точки зрения количества доступных и информативных статей, оказался запрос: (Bcl2[Title]) AND function[Title]
Ссылка на открытую коллекцию статей по данной тематике:
View my collection, "bcl2" from NCBI
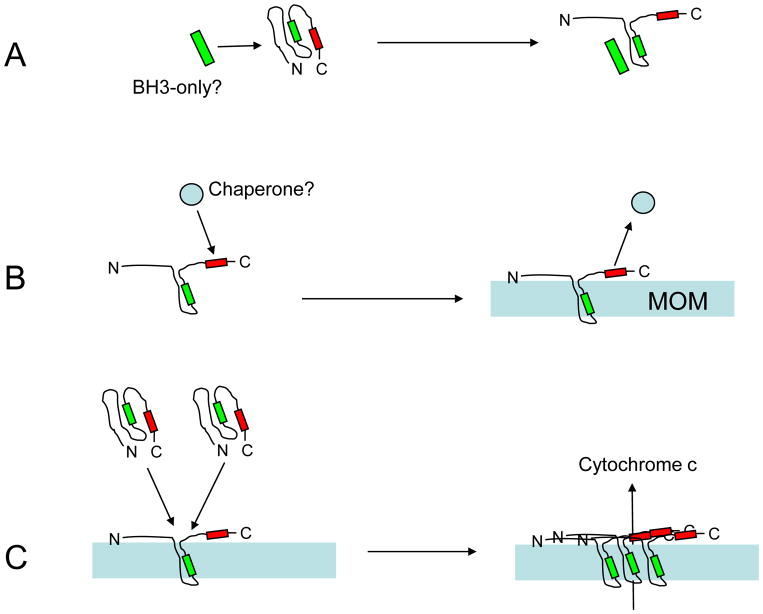
Краткое описание статьи: Upregulation of Bcl2 inhibits apoptosis-driven BAX insertion but favors BAX
relocalization in mitochondria. O. Teijido, L. Dejean