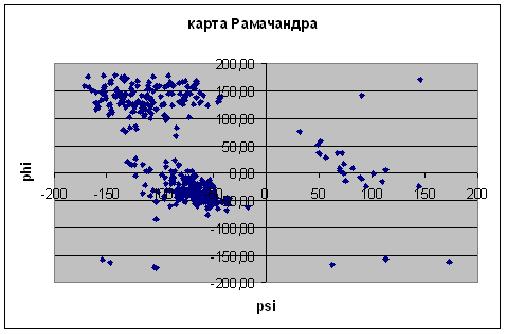
В абсолютном большинстве случаев значения торсионных углов попадают в область, где фи принимает значения от -75 до 20 и от 75 до 180, а пси, соответственно, от -160 до -30.
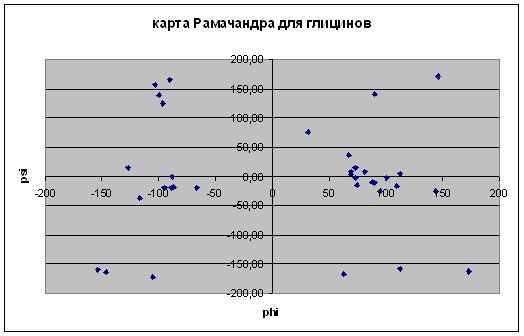
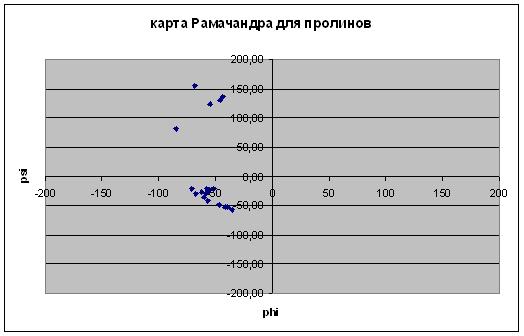

В абсолютном большинстве случаев значения торсионных углов попадают в область, где фи принимает значения от -75 до 20 и от 75 до 180, а пси, соответственно, от -160 до -30. |
|
 |
 |