Атлас контактов
Введение
Рассматриваемый белок — транстиретин — встречается у Homo sapiens (человека разумного). Он отвечает за транспорт тироксина и ретинола (отсюда название) [1].
Транспорт ретинола происходит при соединении транстиретина с ретинол-связывающим белком. Транстиретин связан с такими заболеваниями, как старческий системный амилоидоз, семейная амилоидная полинейропатия, семейная амилоидная кардиомиопатия [2]. Транстиретин производится преимущественно в печени, сосудистом сплетении желудочков мозга и в эпителии сетчатки глаза [1].
Представляет собой гомотетрамер: четыре одинаковых субъединицы объединяются сначала в два димера (в файле PDB представлен один такой димер), а потом в димер димеров [3].
| Название белка | Транстиретин |
| Банк UniProt | P02766 |
| Банк PDB | 5JID |
| Классификация | транспортный белок |
| Организм | Homo sapiens |
| Общий вес конструкции | 28405.85 |
| Количество атомов | 2022 |
| Количество остатков | 254 |
| Уникальные цепи протеина | 1 |
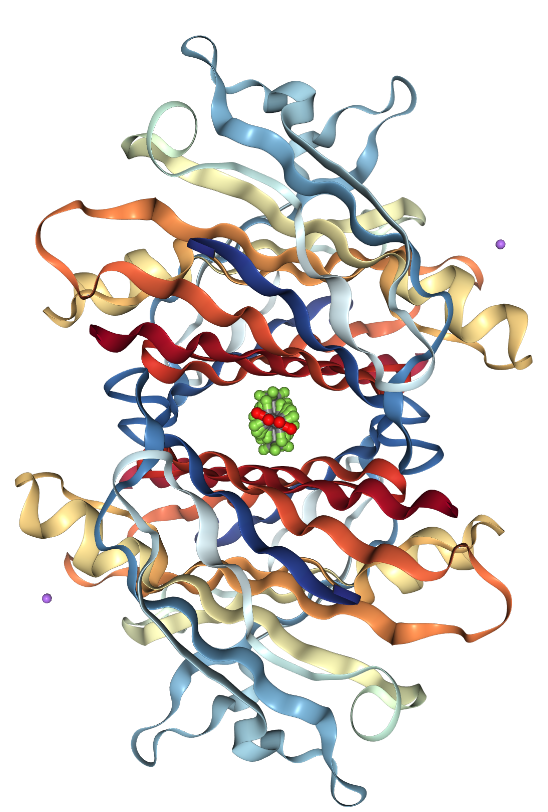
Лиганды
| Название лиганда | Молекулярная масса | Бутто-формула | PubChem | Химическая формула |
|---|---|---|---|---|
| Ион натрия | 22,989 | Na | 923 | Na⁺ |
| Пентадекафтороктановая кислота | 414,064 | C8HF15O2 | 9554 | 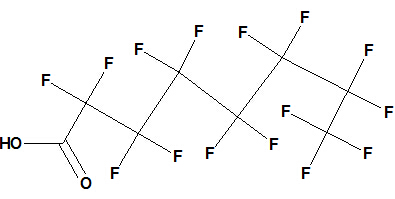 |
Апплет с моделью молекулы и лигандов:
Белок-белковые контакты
Апплет объединяет сразу несколько типов контактов, объяснения и комментарии по каждому из них ниже.
Ковалентные связи
В данном белке отсутствуют ковалентные связи между цепями (S-S мостики и посттрансляционные сшивки). Цепь содержит один цистеин, но он не соседствует с цистеинами других цепей.
Водородные связи
В 5JID выявлено 142 водородные связи. В основном они формируют α-спирали, β-листы. Обеспечивают упаковку молекулы, связывая её в одно целое: соединяют между собой β-листы и две α-спирали.
Для подробного отображения были выбраны по одному представителю водородных связей из α-спирали и из в β-листа.
Ионные взаимодействия
Потенциально заряженными группами в белке могут быть аминогруппа на N-конце, карбоксигруппа на C-конце, карбоксигруппы Asp и Glu, аминогруппы Arg, Lys, кольцо His. В ходе ручной проверки было выявлено, что на N-конце нет ни одного протона, а сам остаток имеет номер десять. Возможно, это значит, что имеющаяся структура белка неполная. Далее эта аминогруппа не учитывалась. Также вручную были проверены гистидины, оказалось, что из четырёх гистидинов, присутствующих в цепи, два протонированы, а два нет. Отавшиеся группы, судя по протонам, действительно имеют именно тот заряд,который предполагался.
Далее к выделенным заряженным группам была применена команда connect с ограничением на расстояние в 5 ангстрем. Результат — общая модель и последовательно все из найденных контактов, за исключением симметричных уже показанным, — преставлены в апплете.
Гидрофобные взаимодействия
Гидрофобные взаимодействия определялись "на глаз": по расположению гидрофобных остатков в гидрофобном окружении. Также для найденного места контакта двух цепей была применента команда contact.
В апплете можно увидеть, что гидрофобные радикалы в основном направлены внутрь, например, в промежуток между двумя бета-листами, формируя, таким образом, третичную структуру.
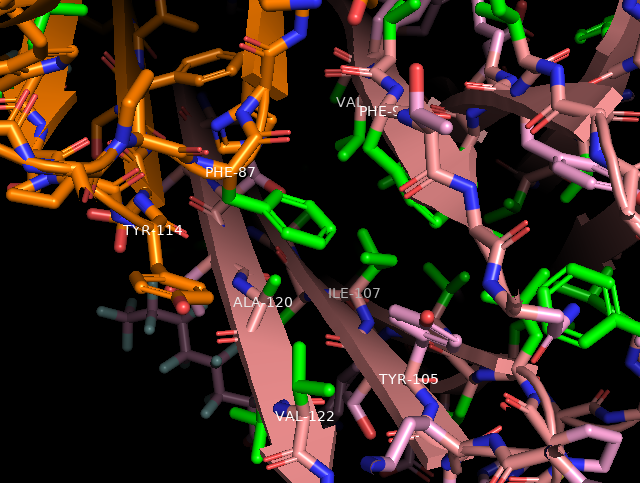
Помимо этого, гидрофобные взаимодействия обеспечивают отчасти и четвертичную, что можно видеть на рисунке (и в последнем из видов апплета):
Гидрофобные радикалы (выделены зелёным) одной цепи (оранжевый) находятся в окружении гидрофобных радикалов другой цепи (розовый), обеспечивая связь между ними.
Плотность упаковки
Апплет ниже последовательно показывает окружение остатка фенилаланина ([PHE]95:A) на разном расстоянии.
Можно видеть, что минимальное расстояние, на котором остаток становится "полностью покрыт", это 5 Å.
Для исследования плотности упаковки было выбрано большее расстояние — 7 Å (5 Å из предыдущего пункта + радиус углерода, округление вверх), поскольку на 5 Å остаток окружён всё-таки не полностью. Добавление радиуса, а не, к примеру, диаметра, позволяет надеться, что мы затронем только непосредственных соседей ("видимых" от центрального атома), не заходя во "второй слой". Рассчёт характерного расстояния был произведён при помощи PyMol. Для случайной выборки в 1000 атомов были подсчитаны и в дальнейшем усреднены промежутки между поверхностями ван-дер-ваальсовых сфер этих атомов и их соседей, находящихся на расстоянии ближе 7 Å, но при этом не являющихся их соседями по цепи (в пределах 5 связей: такое расстояние было выбрано потому, что в 7 Å помещается примерно 5 одинарных связей С-С). Промежуток между ван-дер-ваальсовыми сферами рассчитывался как разница расстояния между центрами и ван-дер-ваальсовыми радиусами рассматриваемых атомов.
Полученное значение характерного расстояния между атомами оставляет порядка 2.3 Å. Это меньше, чем диаметр кислорода (2.8 Å), соответственно, вода между соседними атомами поместиться не может.
Необходимое замечание: в структуре в некоторых случая присутствует несколько позиций для одного остатка. Программой они воспринимаются как различные атомы и учитываются при расчёте. Для их исключения было введено ограничеие на промежутки — они должны быть положительны (различные положения одного остатка находятся обычно близко друг к другу, что приводит к сильному перекрыванию атомов и, как следствие, отрицательному значению формального промежутка), однако это решение не может считаться полным, поэтому полученное характерное расстояние может оказаться заниженным.
Стекинг-взаимодействия
Для поиска стекинг-взаимодействий были выделены цветом все ароматические аминокислотные радикалы и далее для тех структур, которые выглядели похожими на стекинг-взаимодействия, измерялись параметры и сверялись с табличными [4].
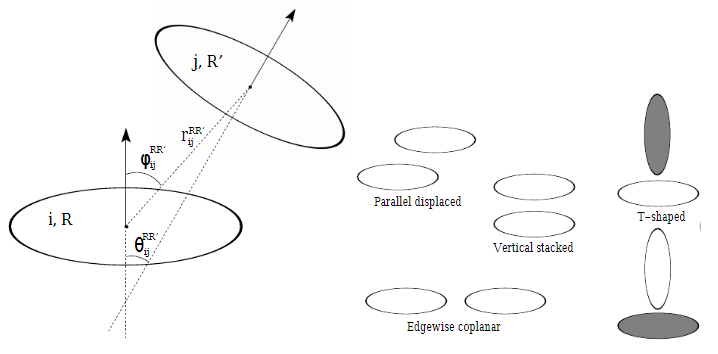
Измерения проводились в использовался PyMol. Для измерения расстояния между радикалами в центре ароматической системы создавался псевдоатом; для измерения угла создавались также псевдоатомы на оси, перпендикулярной плоскости кольца (комбинацией команд orient и translate).
Последовательность аминокислот на верхнем рисунке проверялась на соответствие параллельному стекингу:
| пара | r | φ | θ |
|---|---|---|---|
| B/TYR'114 - B/PHE'87 | 5,8 | 58,9 | 27,8 |
| B/PHE'87 - A/PHE'95 | 4,9 | 56,7 | 14,2 |
| A/PHE'95 - A/TYR'69 | 6,1 | 35,9 | 25,9 |
| ожидаемое [5] | 4-5 | < 45 | 0 |
Параметры значительно отличаются, считать это стекинг-взаимодействием нельзя.
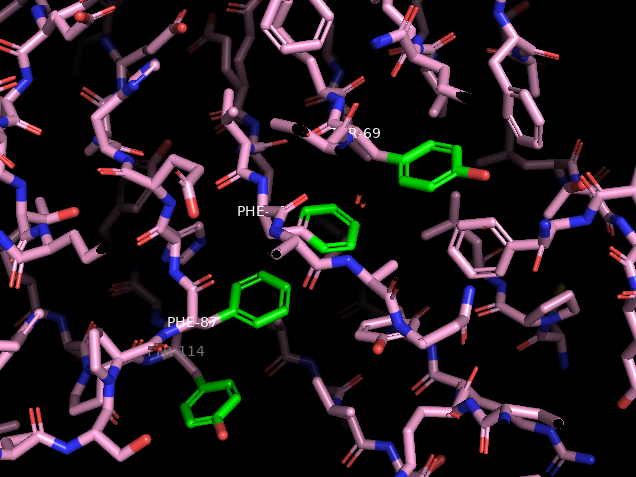
Зелёным выделены предположительно участвующие в стекинге радикалы.
Пара на нижнем рисунке проверялась на соответствие Т-стекингу:
| пара | r | θ |
|---|---|---|
| A/TRP'79 - A/TYR'78 | 5,3 | 69,7 |
| ожидаемое [5] | 4,5 - 5,5 | 90 |
Угол значительно отличается от ожидаемого, поэтому Т-стекингом считать нельзя.
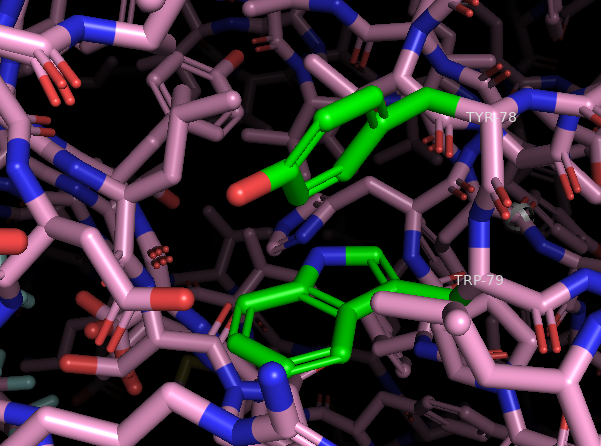
Таким образом, можно утверждать, что чётких стекинг-взаимодействий в данном белке нет.
Контакты с лигандом
Апплет общий для обоих лигандов, пояснения и комментарии ниже.
Ион натрия
В структуре белка есть атом натрия. Возможно, он играет роль кофактора в белке, но есть и вероятность, что его добавили к белку для упрощения его кристаллизации. Натрий гидрофилен, поэтому находится снаружи. В нашем файле к нему были подсоединены 3 молекулы воды, но они были удалены, чтобы не было проще увидеть связь. Связь была также взята с сайта PDB. Это ионная связь, так как она между натрием и кислородом. К сожалению, команда, использовавшаяся для кислоты, здесь не дала никаких результатов.
Пентадекафтороктановая кислота.
В нашем белке присутствуют 2 молекулы данного вещества. В апплете видны: просто форма кислоты, её общее положение относительно белка, связи кислоты и белка. Данные связи были взяты с сайта PDB. Там они названы, как гидрофобные контакты. Также некоторые их них можно найти, воспользовавшись функцией contact [8PF] connect.
PFOA считается поверхностно-активным веществом [6], состоящим из перфторированной н- октильной «хвостовой группы» и карбоксилатной «головной группы». Головная группа может быть описана как гидрофильная, в то время как фторуглеродный хвостгидрофобный и липофобный. Группа хвоста инертна и не сильно взаимодействует с полярными или неполярными химическими группами; Головная группа реактивна и сильно взаимодействует с полярными группами, в частности с водой, поэтому кислота находится на поверхности белка (гидрофильные остатки энтропийно выгодно иметь снаружи).
Личный вклад
Буев Виталий: контакты с лигандами, поиск команд для некоторых других разделов; Колодяжная Екатерина: введение, натрий, общая редактура; Романова Татьяна: гидрофобные контакты, стекинг, html; Хохлова Мария: водородные связи, ионные контакты.
Источники
[1] Википедия (en), Transthyretin (просмотрено 21.03.2020)
[2] Genetics Home Reference Transthyretin amyloidosis (просмотрено 21.03.2020)
[3] Банк PDB(просмотрено 21.03.2020)
[4] Дж. Эмсли. Элементы. 1993г.
[5] Piero Procacci, "Thermodynamics of stacking interactions in proteins", Annual Reports Section C (Physical Chemistry), 2011
[6] Википедия (en), Perfluorooctanoic acid (просмотрено 21.03.2020)