| Главная страница |
Из выравнивания были удалены плохо выровненные и слишком короткие последовательности: UniRef50_A0A0H9FYH5/1-84, UniRef50_G6FNR8/1-121, UniRef50_H5U5I9/1-116, UniRef50_L8F2W4/1-150, UniRef50_H1WDY9/1-202, UniRef50_N1V8V5/1-195, UniRef50_K6WPZ2/1-94, UniRef50_A0A0N7MZJ6/1-219, UniRef50_A0A090RVN5/1-90, UniRef50_C5YVN5/1-174, UniRef50_T1JA18/1-460, UniRef50_V9FCD3/1-450, UniRef50_UPI0005C34624/1-276, UniRef50_T1JC82/1-494.
Для исходного белка найдены участки трансмембранных спиралей, анализ производился на основании его структуры, слишком короткие альфа-спирали, которые не могут быть трансмембранными не учитывались – всего таких структур 3.
Участки последовательностей, соответствующие трансмембранным спиралям консервативны, в них преобладают гидорофобные остатки, хотя и гидрофильные тоже встречаются, вероятно, они поддерживают необходимую структуру. Участки между спиралями менее консервативны.
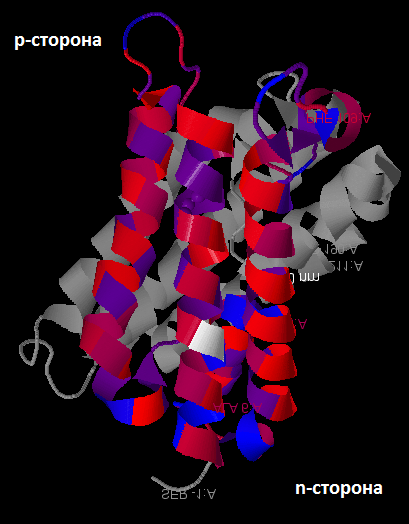
Рис.1 Структура аквопорина Z; красным обозначены гидрофобные аминокислоты, синим – гидрофильные.
Для последовательности UniRef50_P55064 также определены участки трансмембранных спиралей с помощью программы TMHMM – 6 спиралей (Рис.2).
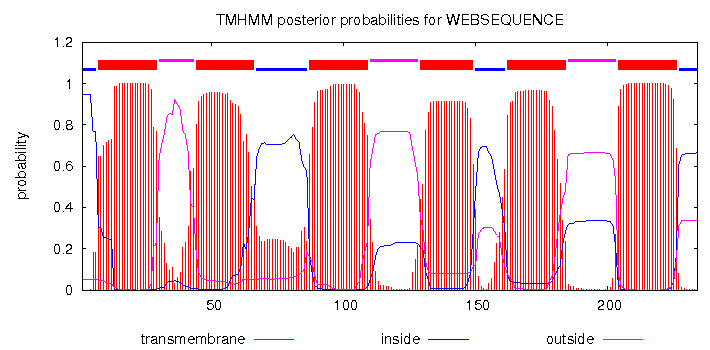
Рис.2 Структура, предсказанная программой TMHMM
Все три спирали, показанные для исходного белка определились TMHMM, еще три спирали, определенные программой, находятся в части белка, которой нет у исходного.
JavView project
Аквапорин Z также был найден в базе данных OPM (Рис.3).

Рис.3 Структура аквопорина Z из базы данных OPM
Толщина мембраны 2.97 нм. Среднее количество остатков в трансмембранной спирали – 21,3. Белок расположен на внутренней мембране грамм-отрицательных бактерий.
Это основной водный канал у бактерий. ТС-код в базе данных TCBD: 1.A.8.3.1:
1.A.* - каналы состоят из альфа-спиралей
1.A.8.* - белки семейства MIP (Major Intrinsic Protein)
Белок с бета-бочкой 3qrc (Рис.4).
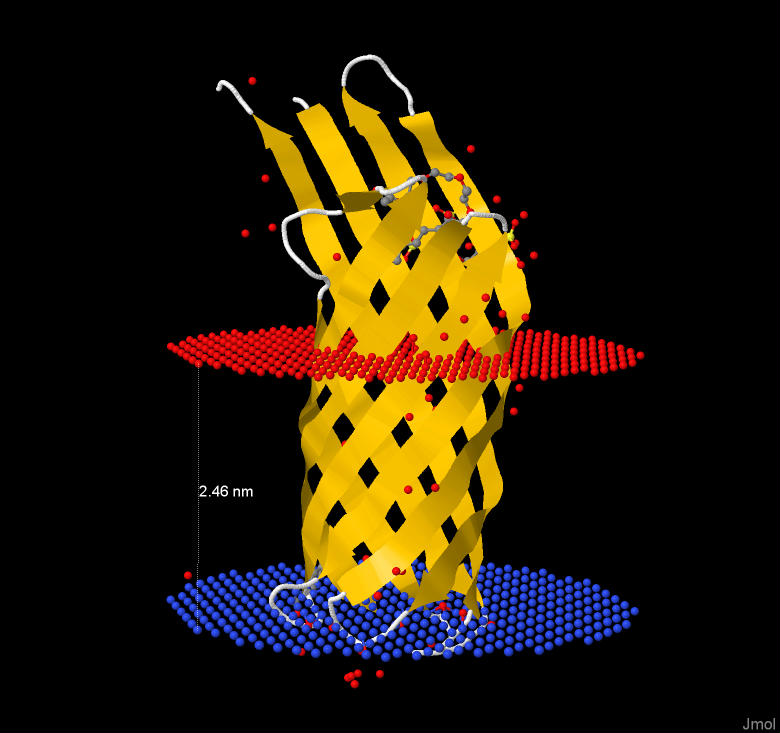
Рис.4 Структура 3qrc из базы данных OPM
Толщина мембраны 2.46 нм. Белок расположен на внешней мембране грамм-отрицательных бактерий.
Нужен для прикрепления при заражении.
В базе TCBD нет.