| Седьмой семестр |
| Главная страница |
Таблица 1
Информация о гомологах 1w81.
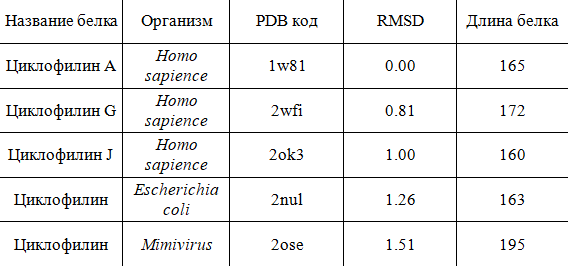
Выравнивание этих структур показано на рисунках 1, 2, 3. Человеческие циклофилины выравниваются хорошо, расхождение только в некоторых петлях (рис. 1), у бактериального циклофилина появляются дополнительные вторичные структуры (рис. 2), еще сильнее отличается вирусный белок (рис.3).
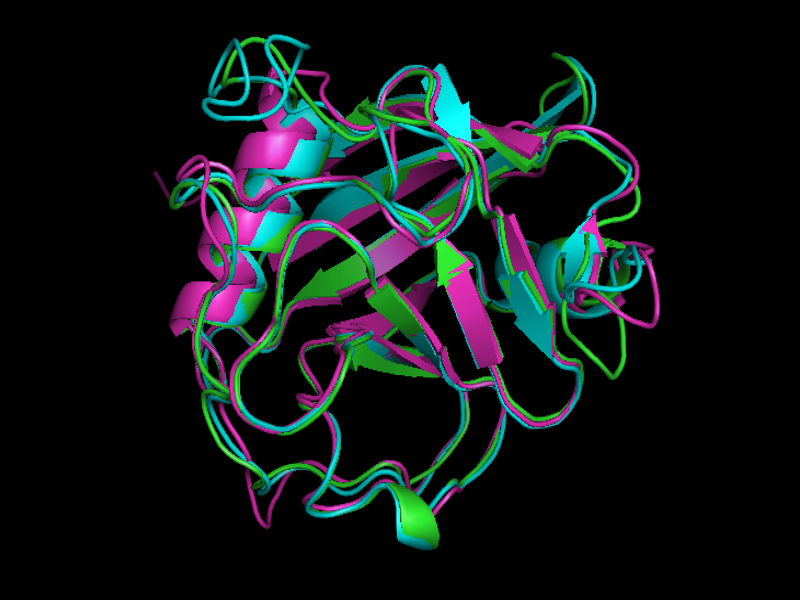
Рис.1
Выравнивание структур 1w81 (зеленый), 2wfi (голубой), 2ok3 (сиреневый).
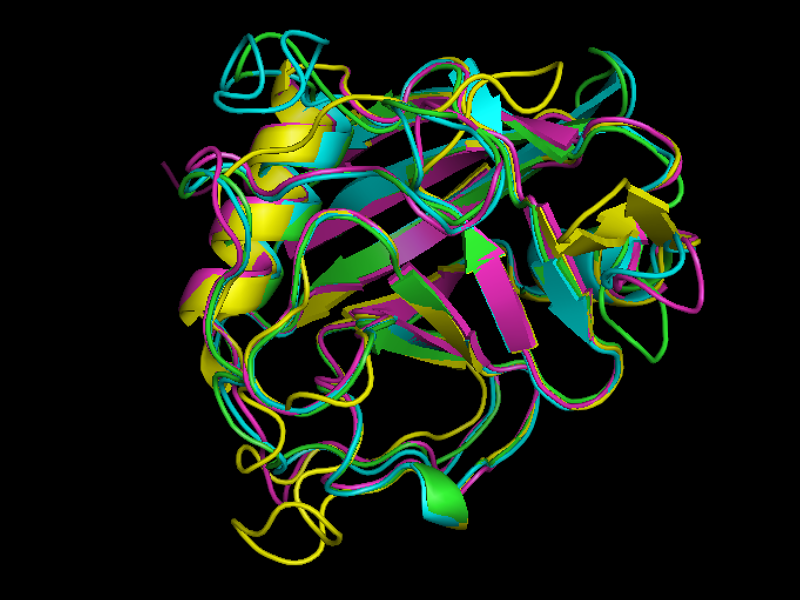
Рис.2
Выравнивание структур 1w81 (зеленый), 2wfi (голубой), 2ok3 (сиреневый), 2nul (желтый).
Рис.3
Выравнивание структур 1w81 (зеленый), 2wfi (голубой), 2ok3 (сиреневый), 2nul (желтый), 2ose (розовый).
Сравним выравнивание по структуре, сделанное с помощью сервиса PDBeFold с выравниванием последовательностей, сделанным с помощью программы Mascle (рис. 4).
Рис.4
Выравнивание по структуре сверху, выравнивание по последовательности снизу. Красным выделены отличающиеся места.
Первое отличие – в выравнивании по последовательностям выровнены первые аминокислоты, а в выравнивании по структуре – нет. Если посмотреть на структуры (рис.5), становится понятно, что метионин белка мимивируса лежит далеко от других первых аминокислот, но остальные аминокислоты могли бы быть выровнены.
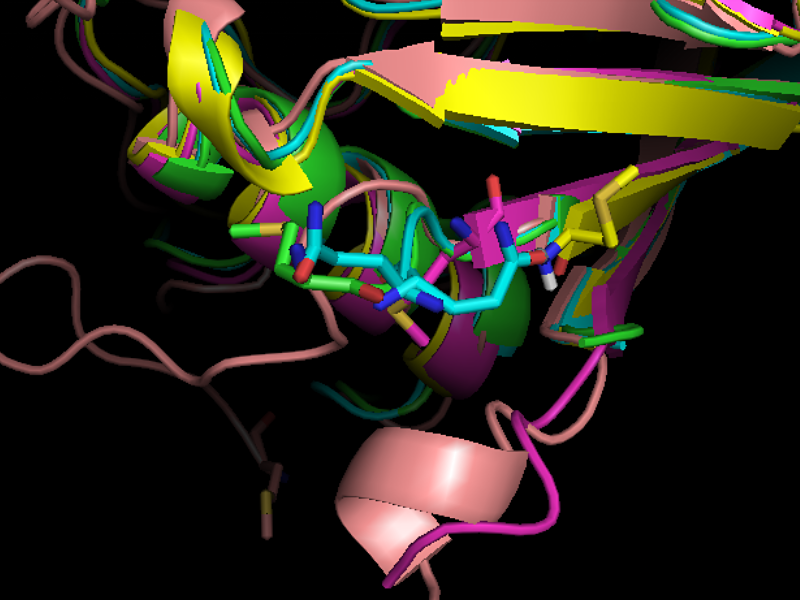
Рис.5
Положение начальных аминокислот на структурном выравнивании.
Еще одно отличие выравниваний – столбец валинов (и один цитозин), который присутствует только в структурном выравнивании. Эти остатки действительно очень хорошо выравниваются по структурам (рис. 6).

Рис.6
Положение столбца аминокислот, который отсутствует на обычном выравнивании по структурам.
Следующее задание было выполнено со структурами константных доменов Т-клеточных рецепторов из цепи альфа (2bnu) и из цепи бета (1bd2). На рисунках 7 и 8 показаны карты бета-листов для этих структур.
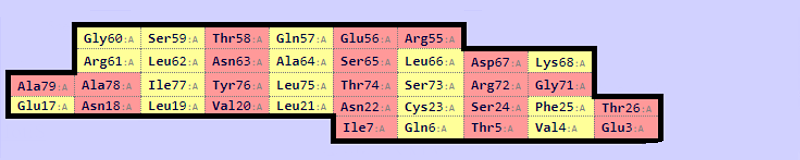
Рис.7
Карта бета-листов для структуры 2bnu.
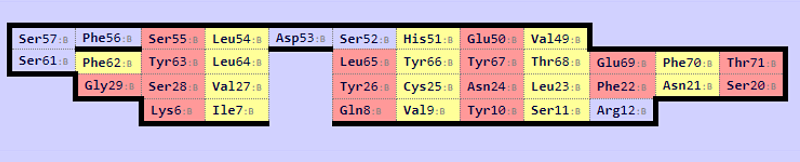
Рис.8
Карта бета-листов для структуры 1bd2.
Для построения совмещения структур были выбраны С-альфа атомы консервативного цистеина (Cys23 для 2bnu и Cys25 для 1bd2) и окружающих аминокислот.
Команды для построения совмещения:
select a, pdb2bnu and resi 72-74+22-24+5-7 and name CA and chain a
select b, pdb1bd2 and resi 65-67+24-26+8-10 and name CA and chain b
pair_fit a, b
Полученное совмещение доменов показано на рисунке 9. Ход полипептидной цепи совпадает, но, в целом, совмещение не очень хорошее.
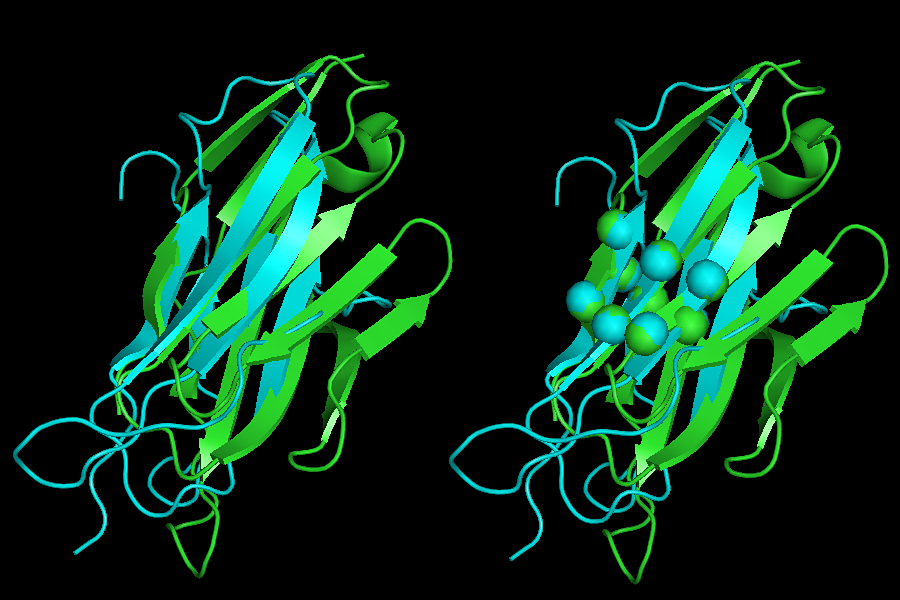
Рис.9
Совмещение доменов 2bnu и 1bd2. Шариками показаны атомы, по которым проводилось совмещение.