На главную страницу четвертого
семестра
Membrane proteins
Мембранные белки
Задача — предсказать 2-мя способами топологию мембранного белка
и сравнить предсказание с 3D-структурой данного белка или его близкого гомолога
Построение выравнивания исследуемого
белка с заданным прототипом
ID SwissProt исследуемого белка — PIP1_ATRCA
AC SwissProt исследуемого белка — P42767
Последовательность исследуемого белка P42767 была получена в результате выполнения следующей команды
в ОС UNIX:
seqret sw: P42767
Последовательность белка-прототипа была дана
Попарное выравнивание белковых последовательностей строилось с помощью программы
needle:
needle 1z98.fasta pip1_atrca.fasta 1z98_pip1_atrca.needle
Выравнивание исследуемого белка
PIP1_ATRCA с белком-прототипом, построенное с помощью программы needle
Процент идентичности последовательностей (Identity) — 82.6%
Вес выравнивания (Score) — 1225.0
Также для импорта в GeneDoc было построено выравнивание исследуемого белка и белка-прототипа с помощью
emma — одной из реализаций ClustulW
Предсказание топологии почти вручную
С помощью программы pepwindow пакета EMBOSS (-graph data -lengyh 19 (оптимальный размер окна
при предсказании трансмембранных сегментов )) были получены два столбца чисел. В первом столбце содержатся номера
а. о., находящихся в середине скользящего окна, во втором столбце — средняя гидрофобность для
соответствующих окон.
По полученным данным был построен профиль гидрофобности с помощью Excel.
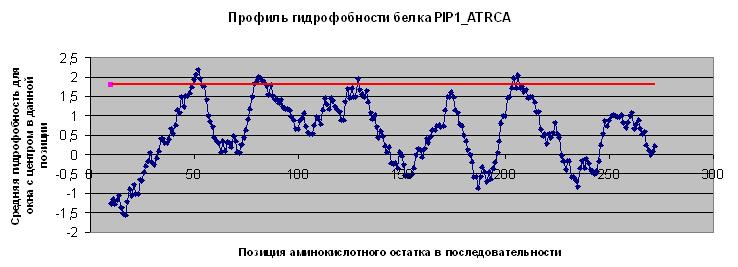
Были рассмотрены пики (4 пика) со средним значением гидропатичности более 1.8 (выше красной линии на графиек). Каждый
такой пик соответствует центру сегмента а.к. последовательности с длиной, равной размеру выбранного окна.
Границы выбранных трансмембранных сегментов можно посмотреть в
файле отчета.
На основании правила von Hejne, согласно которому цитоплазматические (внутренние) петли между мембранными сегментами содержат
больше положительно заряженных остатков (K, R), чем внешние петли, были определены внутренние петли.
В выравнивании исследуемого белка с белком-прототипом
в поле Manual позиции мембранных сегментов отмечены буквой "Н", позиции цитоплазматических петель знаком "+",
остальные — знаком "-".
В поле Helix буквами "H" отмечены альфа-спирали в последовательности белка прототипа (1z98)
Предсказание топологии с помощью программы
TMHMM
Результат предсказания топологии
исследуемого белка PIP1_ATRCA с помощью TMHMM
График, выданный программой TMHMM
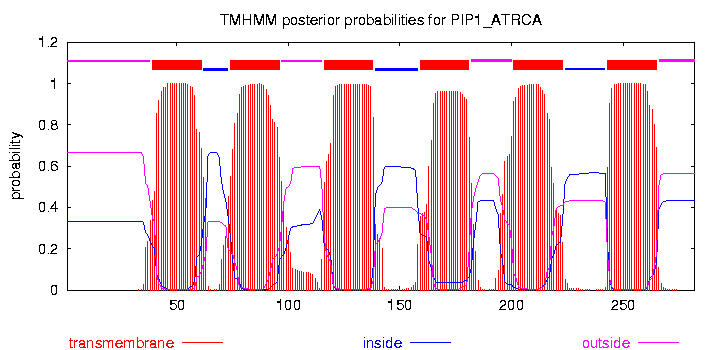
На графике схематично показана последовательность белка PIP1_ATRCA. Красными прямоугольниками отмечены
трансмембранные сегменты, всего их по данным TMHMM 6. Фиолетовыми линиями отмечены участки последовательности,
располагающиеся снаружи, а синими — участки, находящиеся внутри клетки. N- и C- конец последовательности
PIP1_ATRCA находится снаружи.
Также данный график содержит информацию о трех вероятностях:
вероятность того, что данный участок последовательности является трансмембранным сегментом (красные столбцы на графике);
вероятность расположения участка последовательности внутри клетки (синий график);
вероятность расположения участка последовательности снаружи клетки (фиолетовый график).
В выравнивании исследуемого белка с белком-прототипом
в поле TMHMM отражены результаты работы программы. Позиции мембранных сегментов отмечены буквой "Н",
позиции цитоплазматических петель знаком "+", остальные — знаком "-".
В поле Helix буквами "H" отмечены альфа-спирали в последовательности белка прототипа (1z98)
В файле отчета в таблице "Топология белка PIP1_ATRCA"
содержится информация о границе мембранных участков по данным TMHMM.
Выделение трансмембранных сегментов в 3D-структуре прототипа
По идентификатору PDB (2b5f) белка-прототипа было найдено описание трансмембранных сегментов в
БД OPM (Orientations of Proteins in Membranes database)
Затем используя выравнивание белка-прототипа с PIP1_ATRCA, были определены границы трансмембранных сегментов в белке
PIP1_ATRCA.
Границы трансмембранных сегментов в белке PIP1_ATRCA по
данным OPM
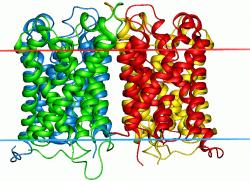
|
Слева приведено расположение аквапорина (Aquaporin Sopip2), состоящего из 4 аминокислотных цепей,
в плазматической мембране.
Одна из цепей — белок-прототип.
Красной линией обозначена внеклеточная сторона мембраны, синей — цитоплазматическая.
В выравнивании исследуемого белка с белком-прототипом
в поле OPM можно посмотреть расположение трансмембранных сегментов и петель. Позиции мембранных сегментов отмечены буквой "Н",
позиции цитоплазматических петель знаком "+", остальные — знаком "-". В поле Helix буквами "H" отмечены альфа-спирали в
последовательности белка прототипа (1z98)
|
Сравнение предсказанных
топологий с описанием трансмембранных сегментов в 3D-структуре прототипа
| |
По профилю гидрофобности |
TMHMM |
| Всего предсказано (N) |
77 |
138 |
| Из них |
|
|
|
| |
А. По данным ОРМ находятся внутри мембраны |
69 |
114 |
| |
В. Из них - "торчащие" из мембраны остатки на концах спиралей |
4 |
11 |
| |
С. Вообще не имеют никакого отношения к трансмембранным
спиралям |
8 |
24 |
| D. Число непредсказанных остатков, которые по данным ОРМ
находятся в мембране. |
67 |
23 |
| Точность предсказания, A/N |
89.6% |
82.6% |
| Сверхпредсказание, C/N |
10.4% |
17.4% |
| Недопредсказание, D/(L-N), где L-длина последовательности |
38.5% |
20.35% |
Примечание:
Для определения "торчащих" из мембраны остатков на концах спиралей использовалась данные PDBsum
о расположении альфа-спиралей в последовательности белка-прототипа (1z98).
Выравнивание исследуемого белка с белком-прототипом
(в поле Helix буквами "H" отмечены альфа-спирали в
последовательности белка прототипа (1z98)).
По данным OPM в мембране белка-прототипа находится 8 сегментов последовательности.
По профилю гидрофобности было найдено 4 мембранных сегмента, а с помощью программы TMHMM — 6.
Недопредсказание по профилю гидрофобности выше, чем по TMHMM (38.5% против 20.35%).
Все трансмембранные сегменты, предсказанные обоими методами, перекрываются с трансмембранными сегментами по данным OPM.
По определению границ трансмембранных сегментов наиболее точным оказался метод, использующий профиль гидрофобности.
Точность предсказания данного метода на 7% выше, чем — TMHMM (89.6% против 82.6%).
Также хочу заметить, что оба метода неверно определили расположение петель.
На главную страницу четвертого
семестра
©
Армаш Татьяна,2006

