Альтернативные положения, B-фактор, кристалл
В данном практикуме продолжилось изучение полученных с помощью рентгеноструктурного анализа структур белков и их характеристик с помощью программы Pymol.
Задание 1. Альтернативные положения.
Для получения структуры белка проводят рентгеноструктурный анализ кристалла этого белка, так как это позволяет получить усиленный сигнал и делает возможным создание трехмерной структуры. Хотя кристалл в целом очень упорядоченная структура, ячейки не полностью идентичны друг другу и мелкие детали в них могут различаться. Так, какие-то отдельные аминокислотные остатки в белках могут иметь несколько конформаций, и их конечное расположение в кристалле будет зависеть от того, в каком состоянии они находились на момент кристаллизации. Когда стабильность таких положений не сильно различается, это отражается и на экспериментальных данных. В этом случае в файле PDB будут указаны все полученные конформации и их заселенность (пропорциональна доле ячеек в кристалле с таким расположением).
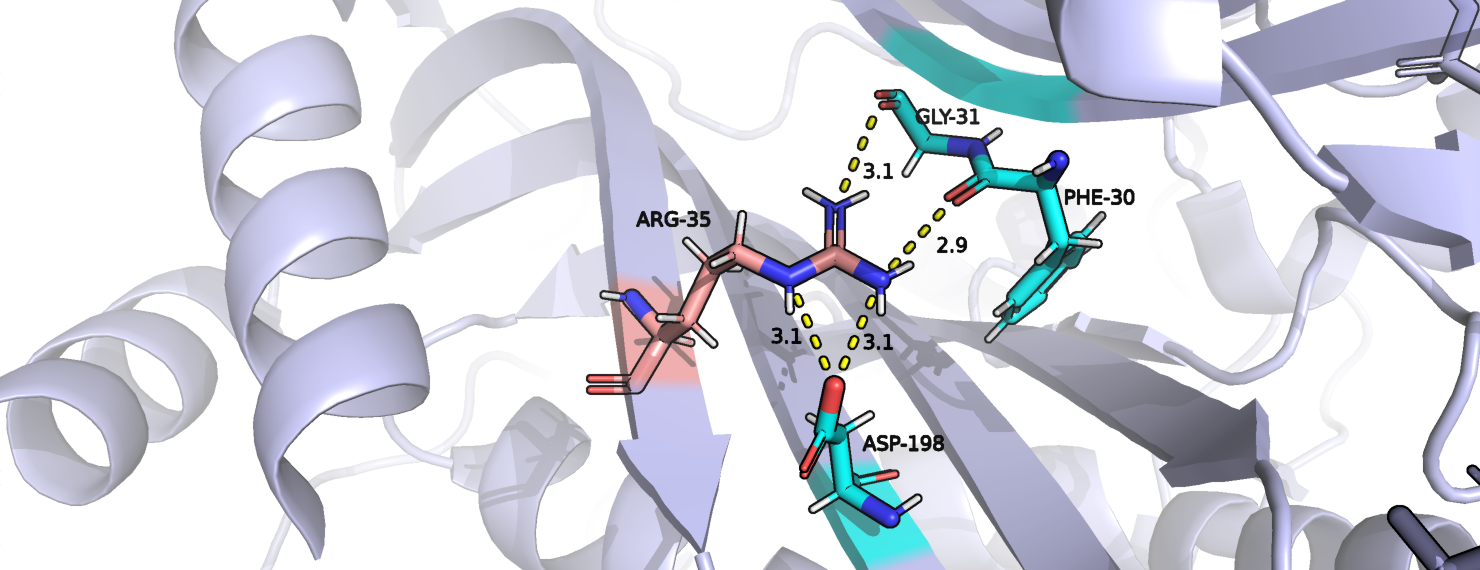
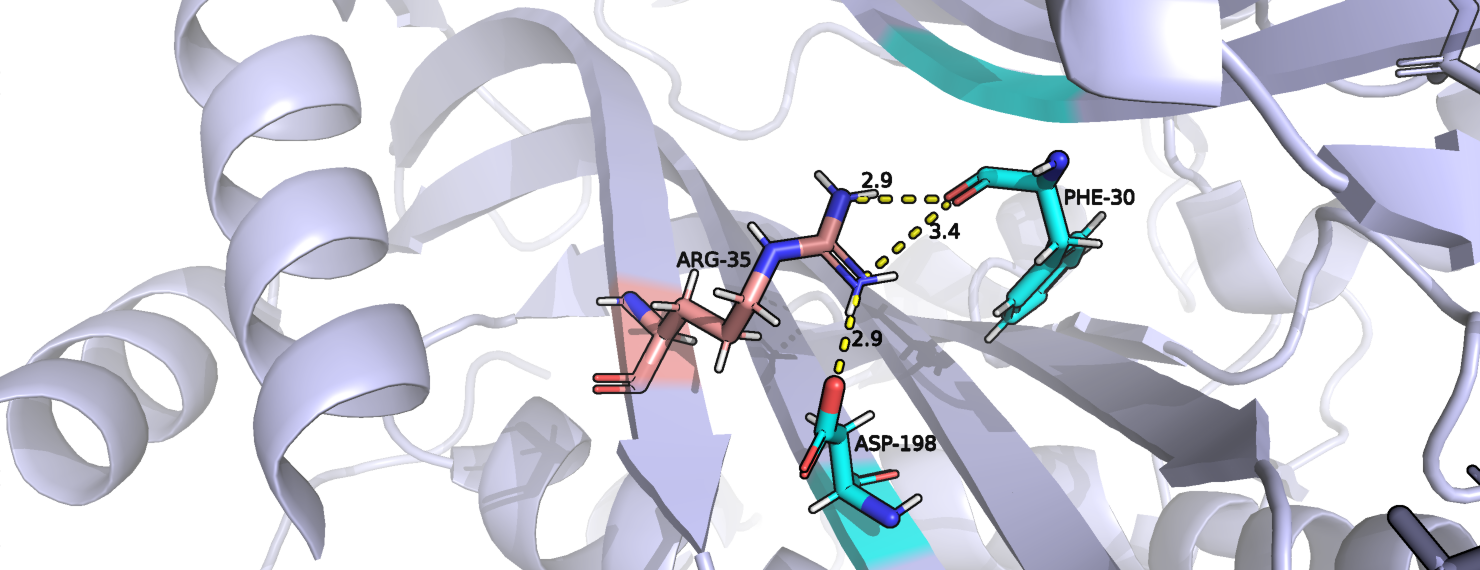
В данной работе для изучения таких альтернативных конформаций (альт-локов) была выбрана структура трансферазы кишечной палочки 6NNR и ее 35 аминокислотный остаток цепи А, являющийся аргинином. На рисунке 1 показаны взаимодействия каждого из альт-локов А и В. Оба альт-лока имеют водородные связи с окружающими их аминокислотными остатками, хотя у альт-лока А ее на одну больше. Также у альт-лока В есть соляной мостик между положительно заряженным азотом аргинина и отрицательным кислородом остатка аспарагиновой кислоты. Хотя расстояние между этими же атомами в альт-локе А больше 4 ангстрем, можно предположить что соляной мостик существует и при такой конформации аргинина, так как у него существует несколько резонансных структур и положительный заряд может быть сконцентрирован не сколько на этом атоме азота, сколько на всей гуанидиновой группе. Если данное предположение верно, то альт-лок А более распространен, так как при таком расположении образуется больше водородных связей. Это согласуется с данными PDB: заселенность альт-лока А - 0.64, а альт=лока В - 0.36.
Задание 2. B-фактор.
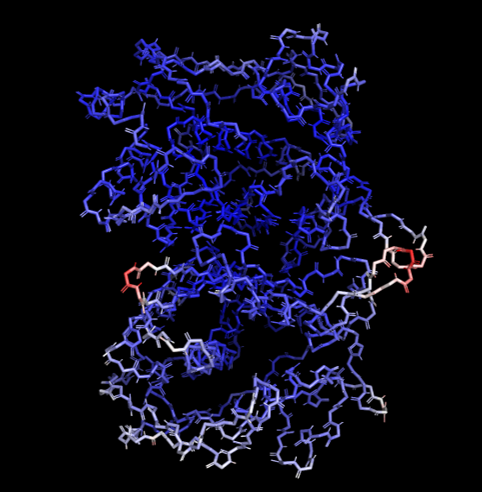
B-фактор - это величина, характеризующая подвижность атома, прямо пропорциональная квадрату среднеквадратичного отклонения атома от его равновесного положения. Чем его значение выше, тем неопределеннее положение данного атома, а значит этот атом более подвижен. Остов молекулы 6NNR был покрашен в зависимости от значения B-фактора (синий цвет означает, что значение этого фактора низкое, а красный - что высокое). На рисунке 2 видно, что чем ближе к периферии, тем ближе цвет остова к белому и красному. Это связано с тем, что поверхностные аминокислотные остатки менее структурированные по сравнению с внутренними частями глобулы, они больше контактируют с растворителем, имеют больше свободы в расположении, отчего имеют более высокий В-фактор.
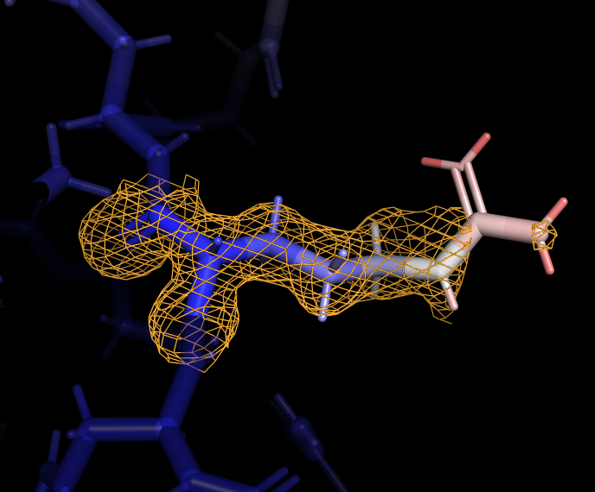
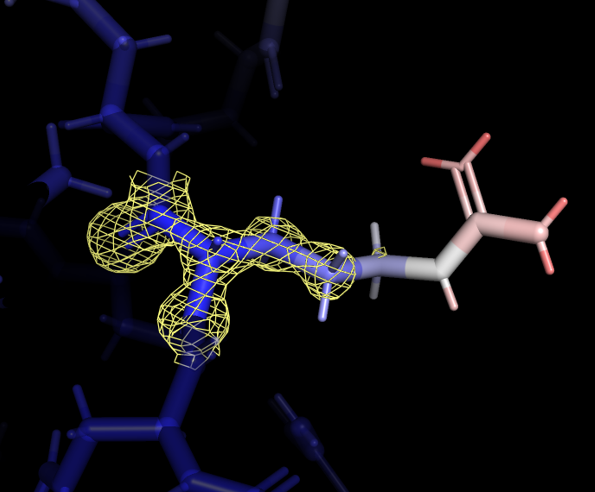
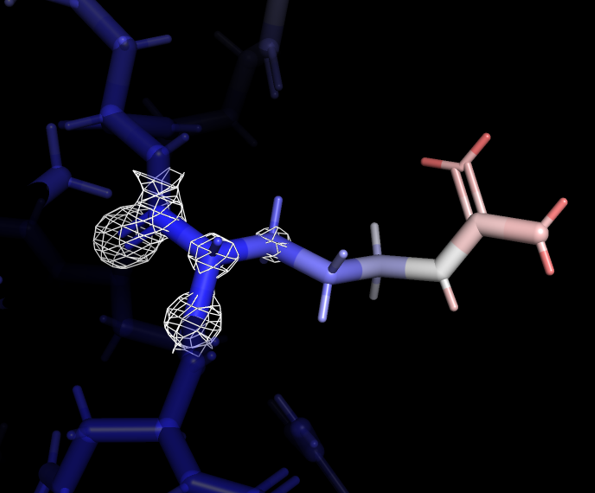
Далее были добавлены все атомы боковых радикалов, и вся структура также была покрашена в зависимости от значения B-фактора. Некоторые из аминокислотных остаток, расположенных на периферии, заметно меняли значение В-фактора: окончание бокового радикала имело более высокое значение. Для одного из таких остатков, Arg-243 цепи А, была визуализирована электронная плотность при carve=1.17 и разных уровнях подрезки - 0.7, 1.9, 3.1 (рисунок 3).
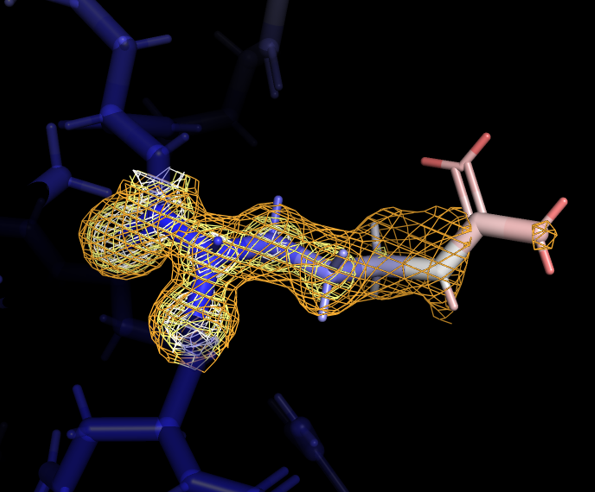
Даже при самом низком уровне подрезки электронная плотность не покрывает атомы с высоким значением B-фактора. При самом высоком уровне подрезки электронная плотность остается практически только на атомах остова. В целом видна связь между распределением электронной плотности и B-фактором: чем более подвижен атом, тем менее определено его расположение, тем больше значение B-фактора и из-за менее слабого сигнала электронная плотность отображается только при низких значения уровня подрезки.
Задание 3. Соседи.
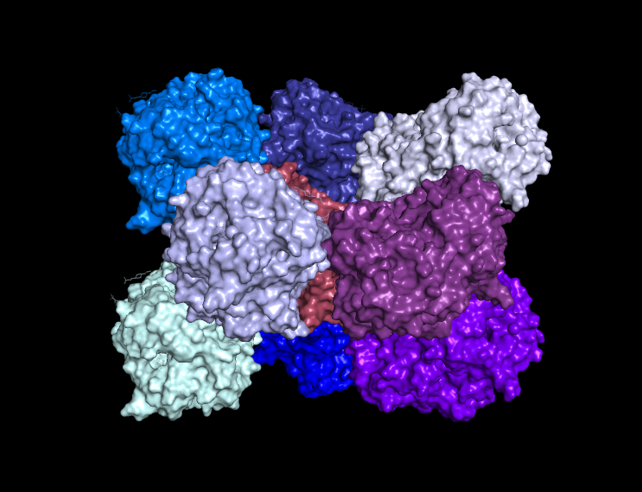
Чтобы показать, что молекулы белка - это часть кристалла, были визуализированы соседи исходной молекулы. На рисунке 5 хорошо видно, что это действительно кристалл и у него есть повторяющийся фрагмент.
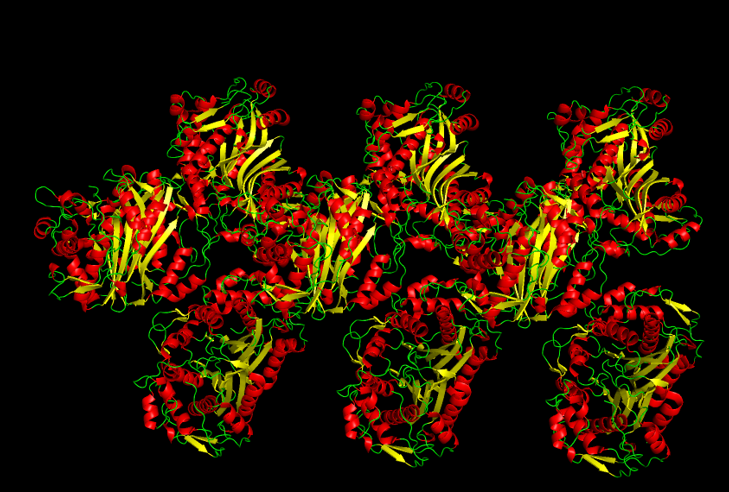
Для отображения всех соседей исходной молекулы для начала была выбрана отсечка равная 12 А, а потом все несоприкасающиеся молекулы были удалены. Оказалось, что исходная молекула контактирует с 8 молекулами (рисунок 6).