ЯМР vs РСА
В этом практикуме сравнивались модели структуры убиквитина человека, которые были получены рентгеноструктурным анализом и методом ЯМР-спектроскопии.
Задание 1. Различия в макроструктурах модели ЯМР и РСА.
Для сравнения методов получения трехмерной структуры белка анализировали модели убиквитина человека. Структура 3ZLZ, полученная рентгеноструктурным анализом, состоит из двух полипептидных цепей, также в ней имеются ионы цинка и молекулы воды, но ее разрешения недостаточно для определения положения атомов водорода и некоторые аминокислотные остатки визуализированы не полностью. В структуре 6KOX, полученной с помощью ЯМР-спектроскопии, у серина-65 и треонина-66 OH-группа заменена на фосфатную. Так как молекула достаточно маленькая (состоит из 76 аминокислотных остатков), то ее структуру смогли получить без замены атомов водорода на дейтерий, что позволило получить модель, в которой присутствуют атомы водорода.
| PDB-код | 6KOX | 3ZLZ |
|---|---|---|
| Метод получения структуры | ЯМР | PCA |
| Разрешение | 2.9 | |
| Количество моделей | 20 |
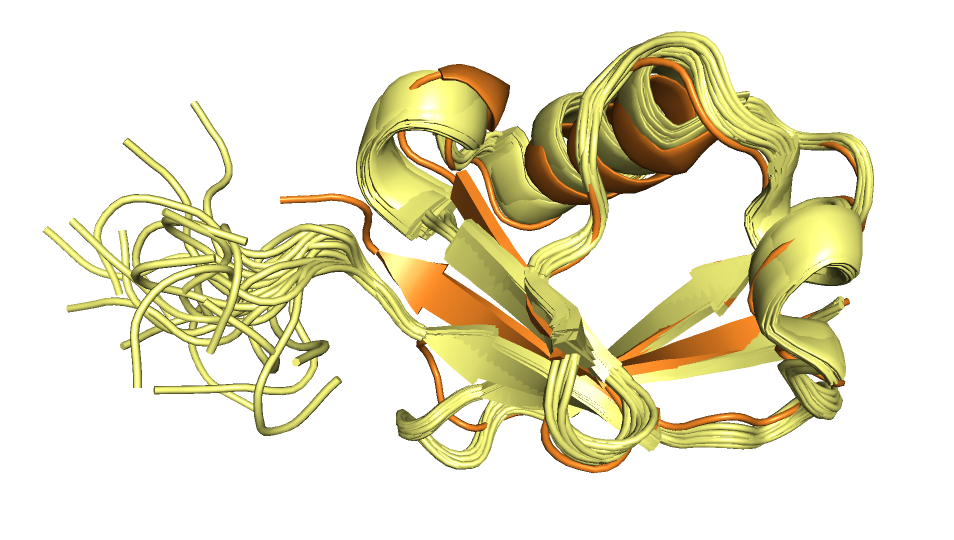
Всего методом ЯМР было вычислено 240 возможных конформаций структуры, но загружены в PDB только 20 с самой низкой энергией. На рисунке 1 показано выравнивание цепи А структуры 3ZLZ со всеми 20 моделями 6KOX. Видно, что все протяженные участки вторичной структуры совпадают, а значимее всего различается расположение аминокислотных остатков в петлях. Также в структурах ЯМР идентифицируется больше альфа-спиралей, тогда как в PCA эти же участки либо не отмечены как альфа-спирали, либо имеют меньшую протяженность вторичной структуры.
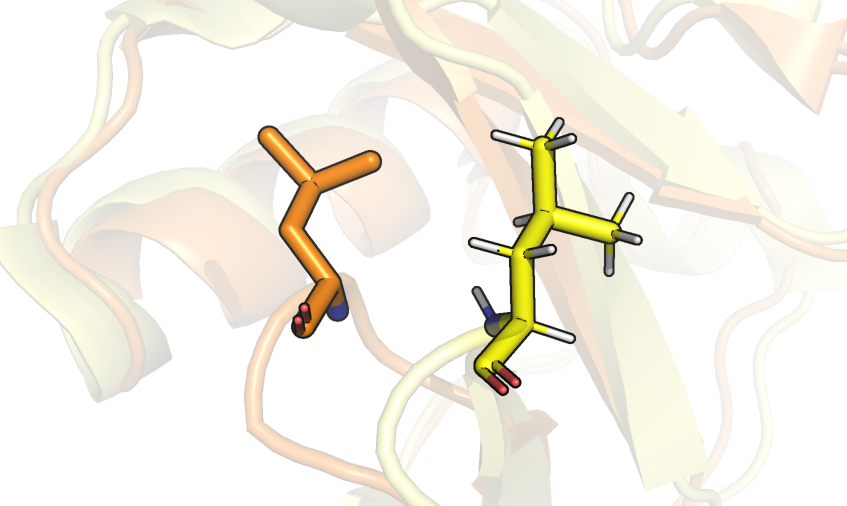
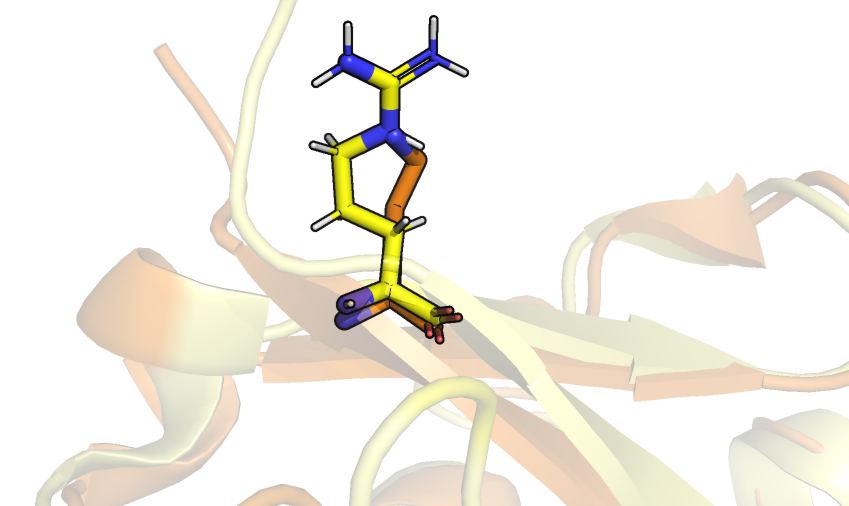
На рисунке 2 детальнее показаны отличия в структурах. На первом изображении визуализированы аминокислотные остатки обеих структур в петле. Отличается не только положение всего аминокислотного остатка в пространстве относительно всех остальных остатков, но и углы между атомами. На втором изображении видно, что в PCA структуре не все атомы некоторых аминокислотных остатков представлены, в отличие от структуры ЯМР.
Задание 2. RMSF.
Если предположить, что множество структур, полученных при помощи ЯМР, это отражение подвижности определенных частей белка, а не следствие шума и неточностей данных, то можно сопоставить значения RMSF ЯМР структуры со значениями B-фактора (который тоже является мерой подвижности) аминокислотных остатков в структуре PCA. Для более точного сравнения были удалены последние аминокислотные остатки в 6KOX, так как у 3ZLZ они отсутствуют. Также не рассматривались остатки, у которых в ЯМР структуре группы OH заменены на PO4, и остаток 48, различающийся в данных молекулах.
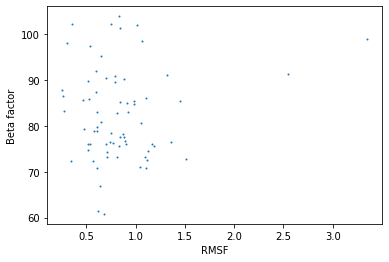
По графику, в котором B-фактор аминокислотных остатков структуры 3ZLZ сопоставлен с RMSF 6KOX, кажется, что однозначной зависимости нет, так как низкому значению RMSF соответствует большое разнообразие в значениях В-фактора и при этом у аминокислотных остатков с большим RMSF может быть как низкое, так и высокое значения B-фактора. То есть судить о подвижности по моделям ЯМР не стоит, хотя стоит отметить, что высокие значения B-фактора могут быть обусловлены плохим качеством данных рентгеноструктурного анализа.
Задание 3. Сравнение обеих структур.
Для более детального анализа рассматривалась водородная связь между определенными остатками в структуре PCA и ее наличие либо отсутствие в моделях ЯМР.
| Расположение водородной связи | Номера остатков | Расстояние в структуре PCA | % ЯМР-моделей, содержащих водородную связь | Минимальное расстояние в ЯМР-моделях, А | Максимальное расстояние в ЯМР-моделях, А | Медианное раастояние в ЯМР-моделях, А |
|---|---|---|---|---|---|---|
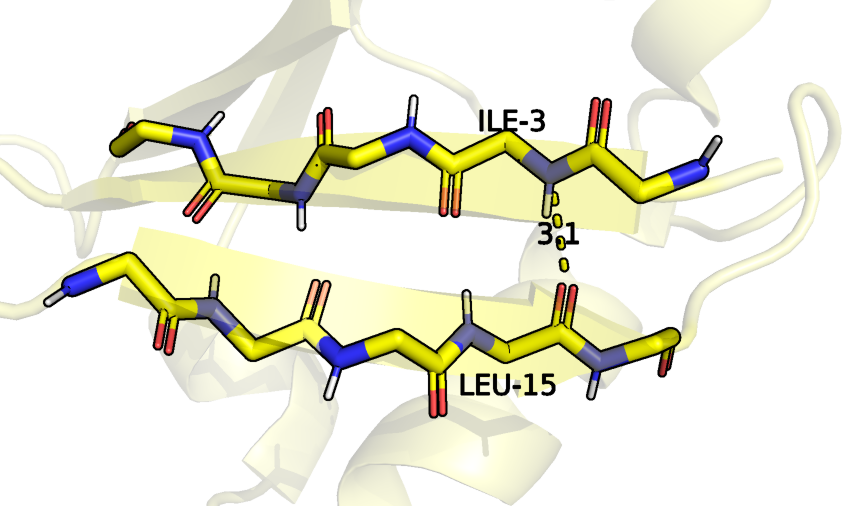
| между атомами остова в ядре белка | Ile-3, Leu-15 | 3.0 | 100 | 2.99 | 3.22 | 3.1 |
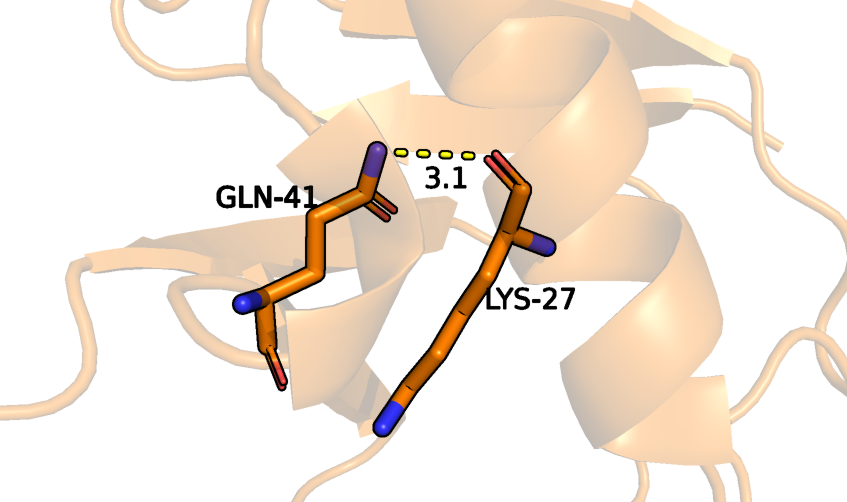
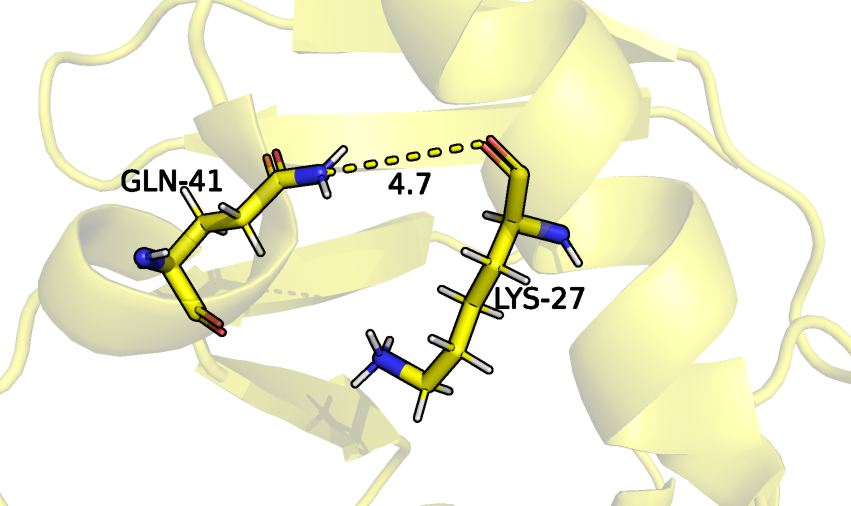
| между боковыми цепями в ядре белка | Gln-41, Lys-27 | 3.1 | 0 | 4.64 | 10.17 | 6.6 |
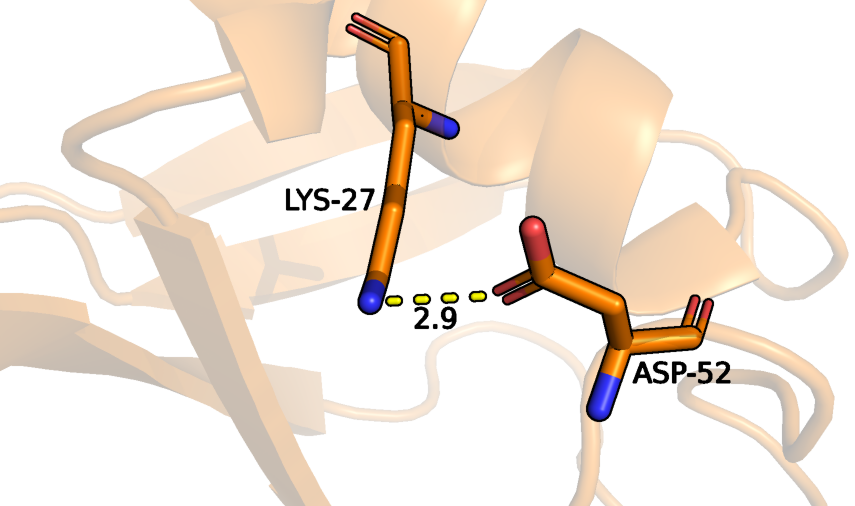
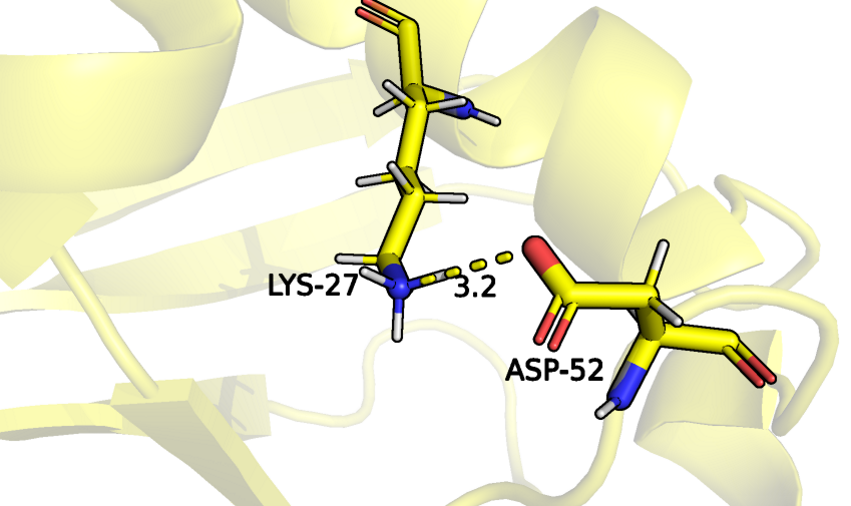
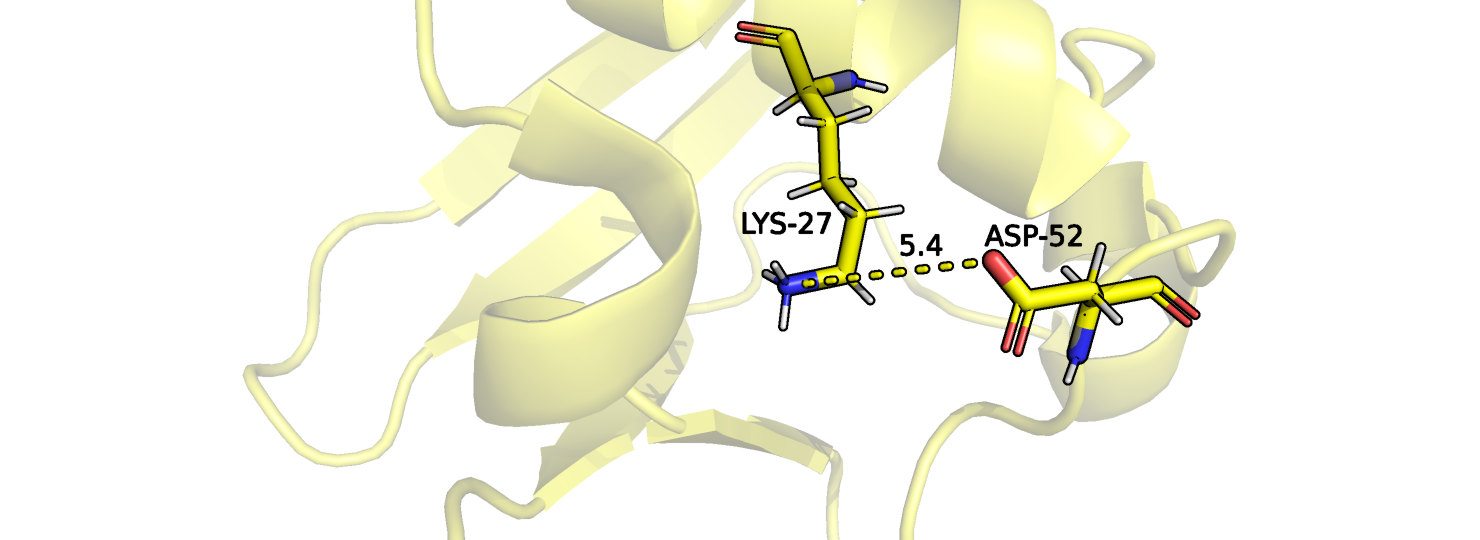
| в петлях на поверхности | Lys-27, Asp-52 | 2.9 | 15 | 2.5 | 9.2 | 5.63 |
Водородная связь между атомами остова бета-листа присутствует в обеих структурах, причем во всех моделях ЯМР, что логично, так как это самые структурированные части и наименее подверженные изменениям, что отражается и в близких значениях длин.
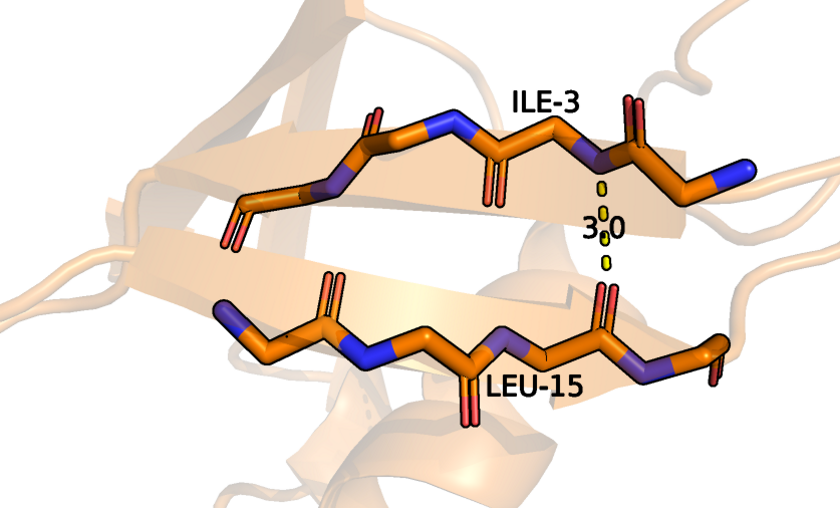
Так как в структуре PCA у некоторых аминокислотных остатков не все атомы бокового радикала присутствуют и в целом боковых радикалов, способных образовывать водородную связь, очень мало, то найти водородную связь именно между боковыми радикалами в ядре молекулы оказалось невозможным. Поэтому для рассмотрения была выбрана связь между кислородом остова и азотом бокового радикала. У ЯМР структур расстояние между двумя остаткам намного превышает расстояние в PCA структурах, из-за чего образование водородной связи невозможно.
Водородная связь, образующаяся в структуре PCA между остатками, которые располагаются ближе к поверхности, присутствует лишь у трех ЯМР структур, в других случаях ее образование невозможно из-за большого расстояния и другого взаимного расположения аминокислот. Неудивительно, что данная водородная связь отсутствует у большинства ЯМР структур, так как остатки, находящиеся ближе к периферии, взаимодействуют больше с растворителем, чем с другими аминокислотными остатками, из-за чего обладают высокой подвижностью.