Связывание лигандов. Карманы связывания. Индуцированное соответствие
В данном практикуме исследовался процесс связывания лиганда с белком посредством изучения открытой и связанной с лигандом форм белка.
Задание 1. Изменения
Рассмотрим остатки, выстилающие карман связывания в открытой форме белка и связанной с путресцином. По общему виду кармана связывания (рисунок 1) видно, что сильнее всего отличается расположение петель между вторичными структурами.
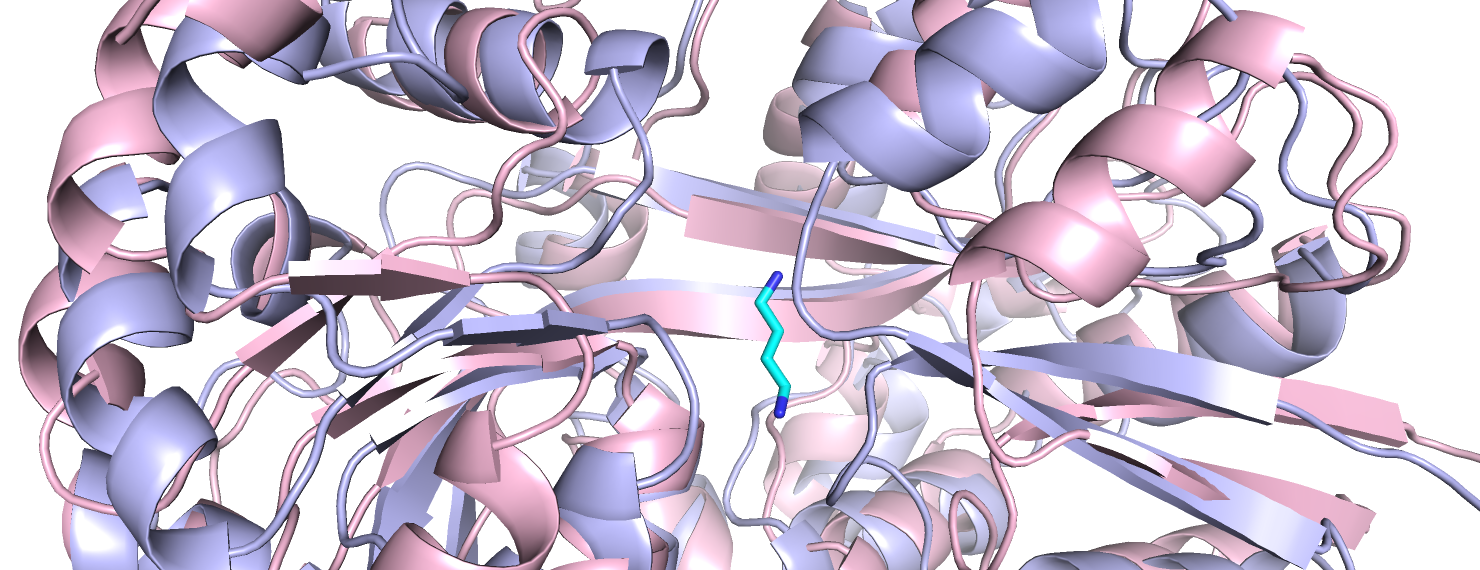
Также стоит отметить, что у закрытой формы остатки более сближены, чем у открытой формы, что хорошо заметно по рисунку 2.
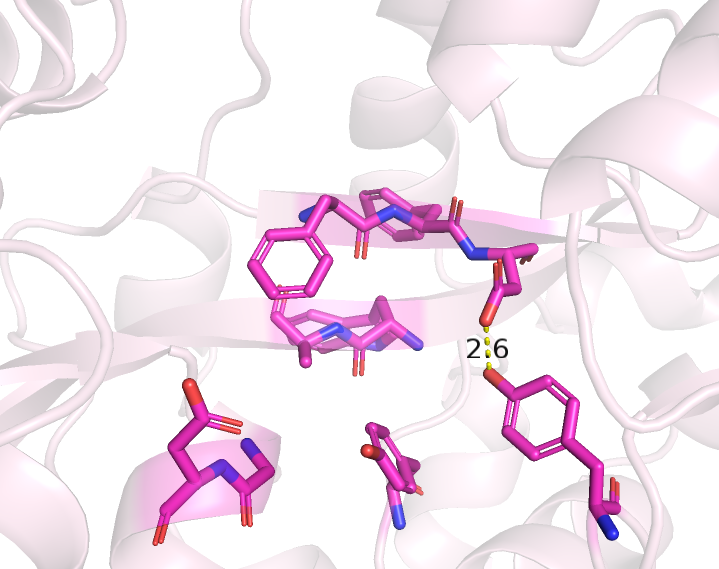
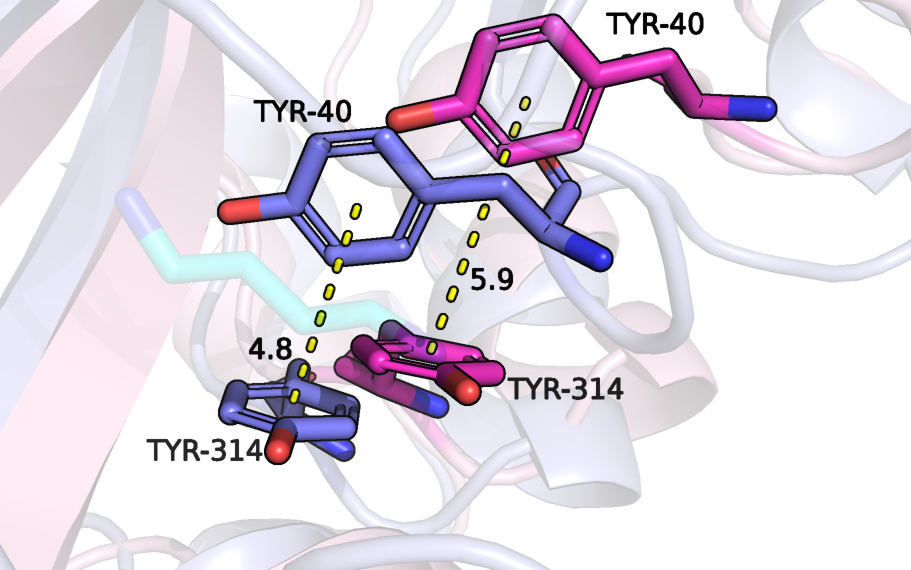
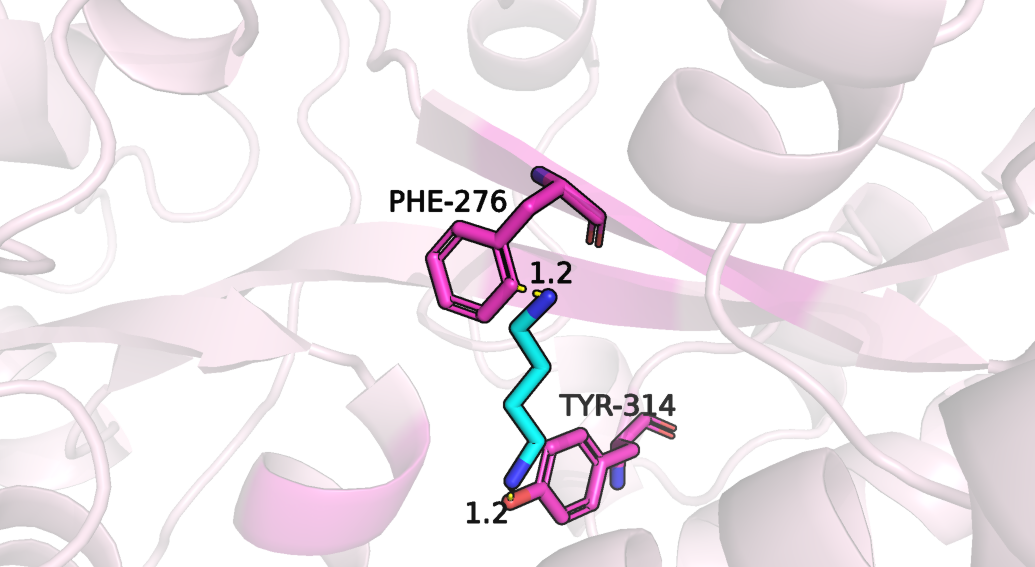
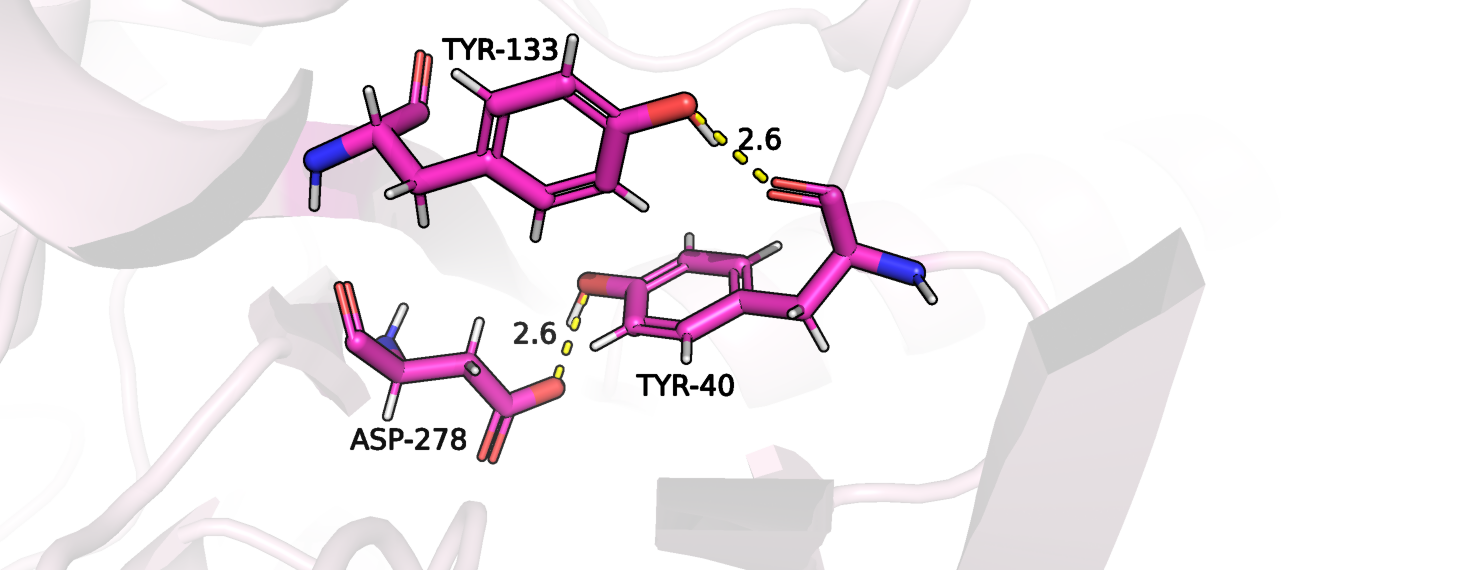
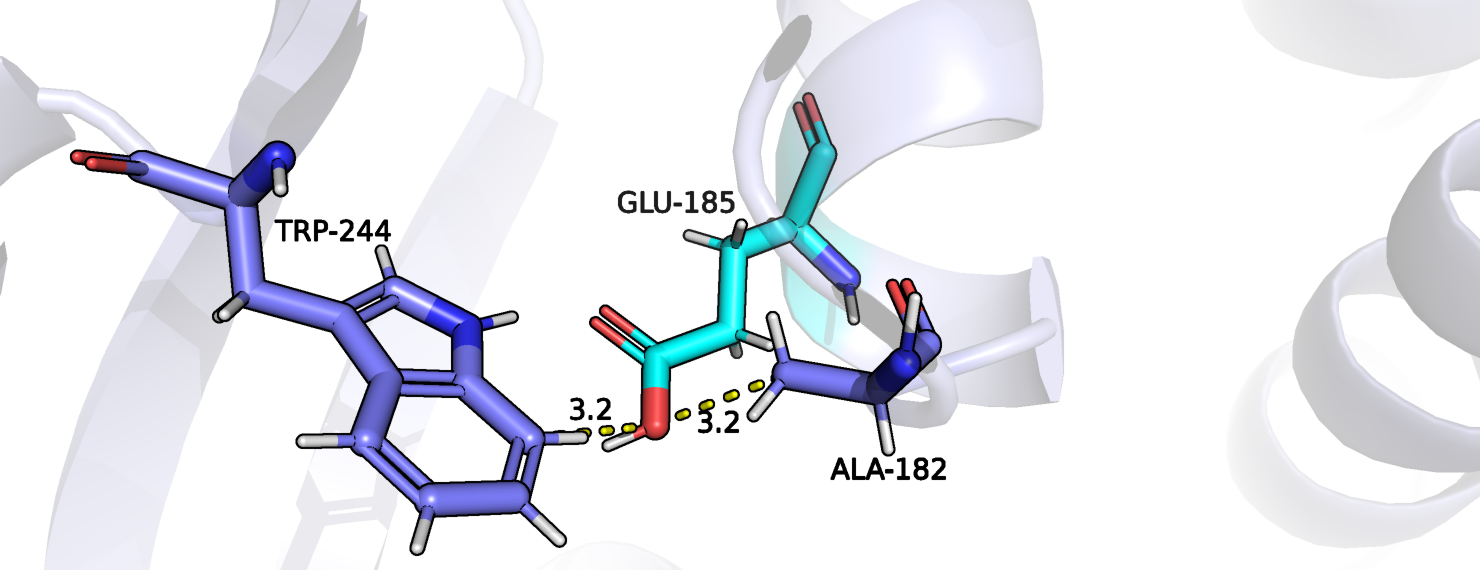
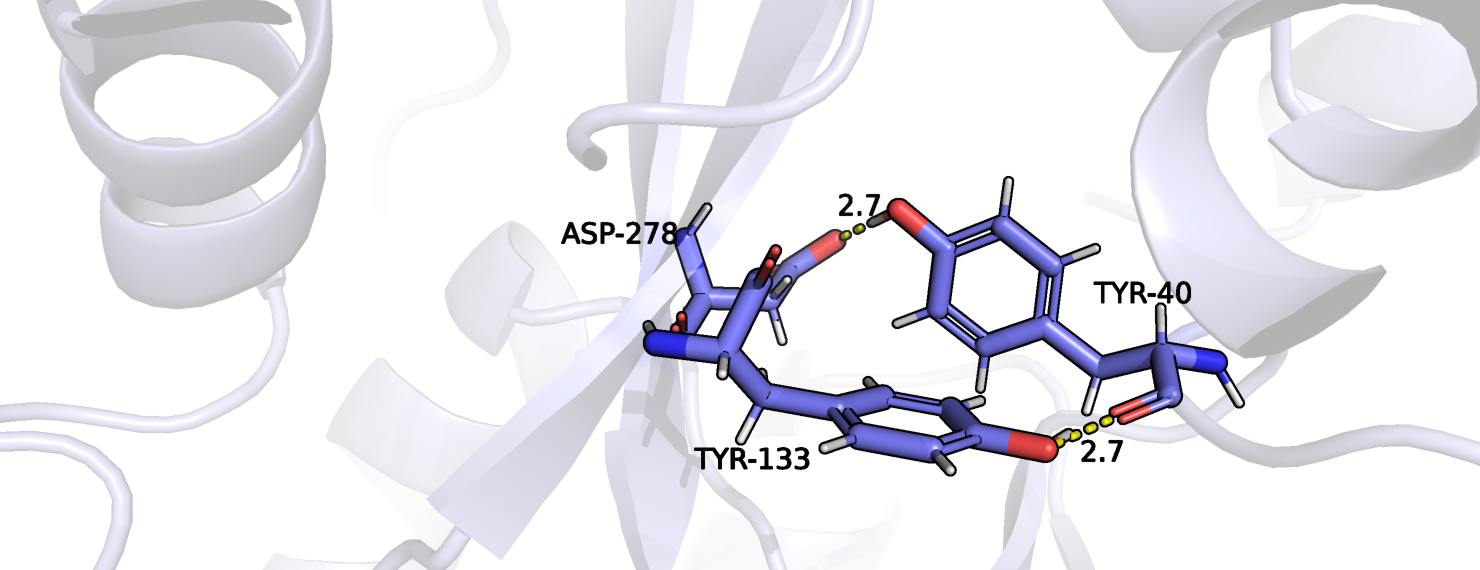
Для более детального изучения кармана рассмотрим отдельно существующие между аминокислотными остатками взаимодействия. Так, водородная связь между Asp-278 и Tyr-40 образуется в каждой из форм и имеет похожую длину, в то время как Т-стекинг между Tyr-40 и Tyr-314 есть только у связанной с лигандом формы, так как расстояние между бензольными кольцами слишком велико в свободной форме. Из-за другого взаимного расположения Tyr-314 и Asp-247 в закрытой форме становится возможным образование между ними водородной связи, в отличие от второй формы. Таким образом, можно заключить, что в закрытой форме белка можно выделить больше взаимодействий в основном за счет уменьшения расстояния между аминокислотными остатками кармана связывания при сохранении старых взаимодействий.
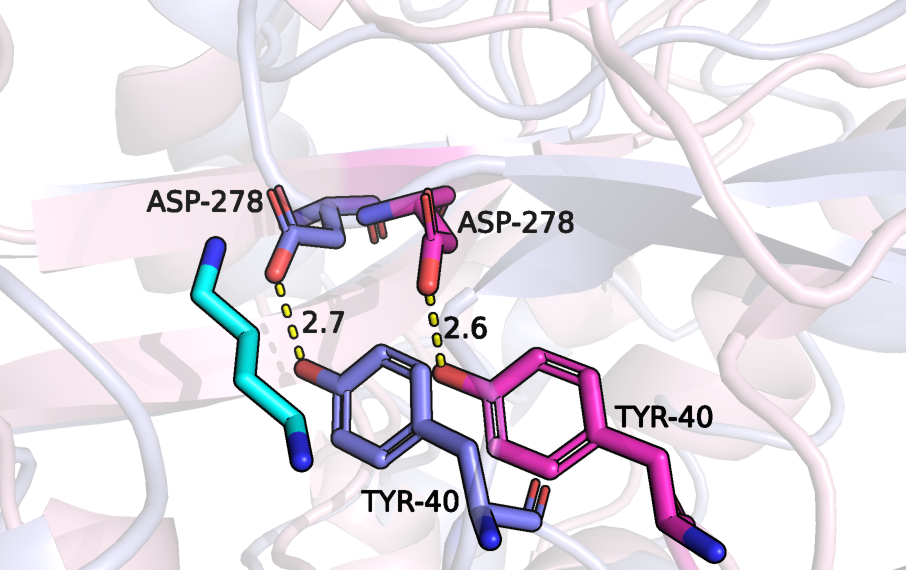
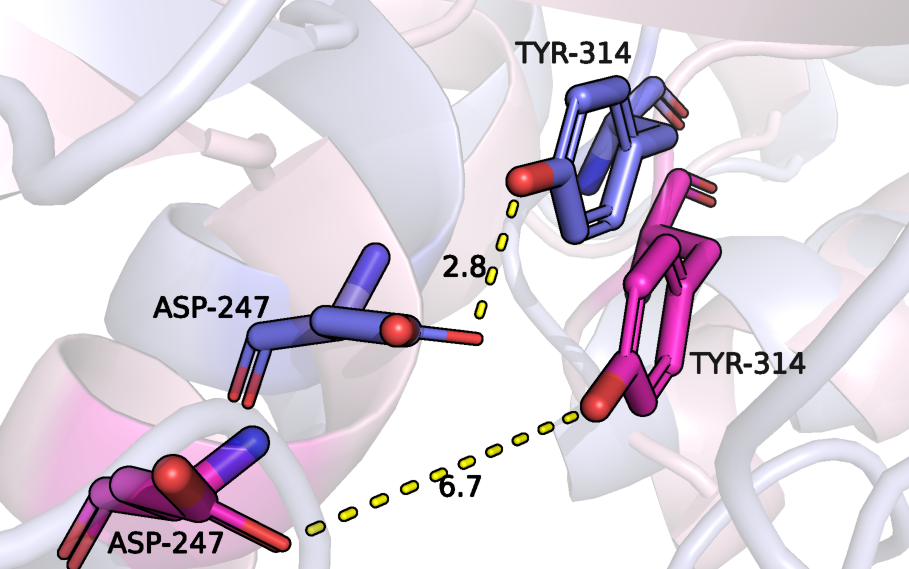
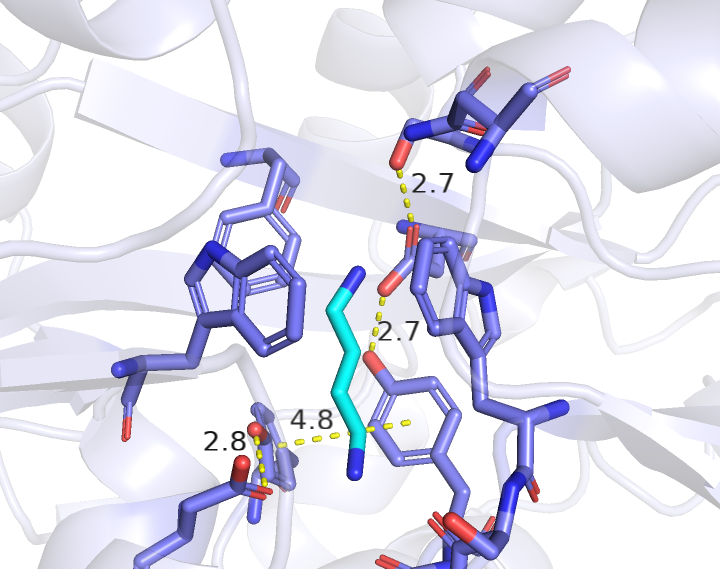
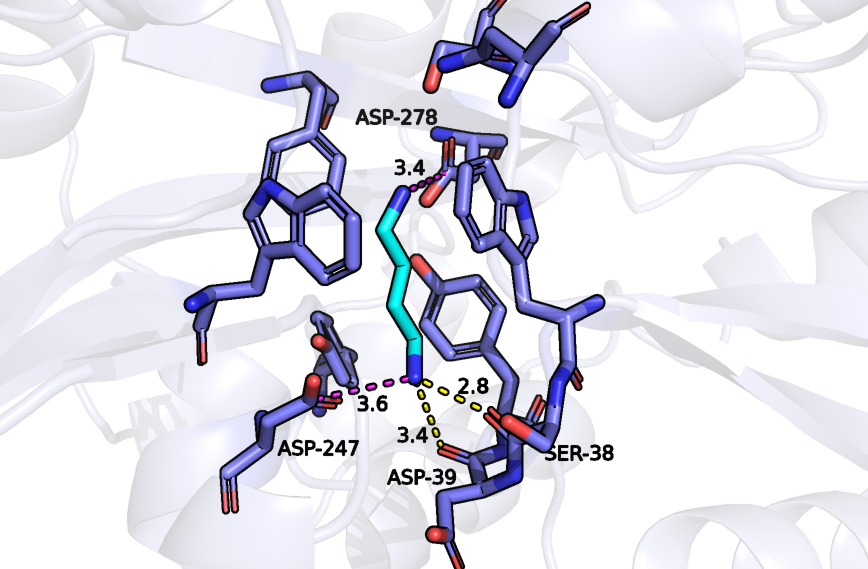
Уменьшение расстояния между аминокислотными остатками происходит за счет их взаимодействия c лигандом. Так, по рисунку 4 видно, что лиганд образует солевой мостик с Asp-278, который сам связан водородной связью с нижележащим тирозином, поэтому изменивший свое расположение тирозин становится ближе к другому тирозину, и между ними образуется Т-стекинг, упомянутый выше. Благодаря солевому мостику лиганда с Asp-247 остаток аспарагиновый кислоты сближается с тирозином, образуя водородную связь, что было невозможно из-за большого расстояния в открытой форме.
Карманы связывания были вычислены с помощью сервера POCASA, причем сравнивались объемы полостей открытой формы и связанной с лигандом, но в которой он был удален. В таблице 1 представлены объемы пяти самых лучших найденных карманов для обеих структур.
| Открытая форма | Закрытая форма | ||
|---|---|---|---|
| ID | Объем | ID | Объем |
| 446 | 473 | 425 | 342 |
| 366 | 141 | 78 | 84 |
| 88 | 133 | 297 | 62 |
| 479 | 117 | 470 | 61 |
| 133 | 53 | 341 | 39 |
Сразу бросается в глаза, что объемы найденных полостей в открытой форме в среднем больше полостей в закрытой, но местоположение некоторых примерно совпадает. Визуализируем найденные карманы (рисунок 5, 6).
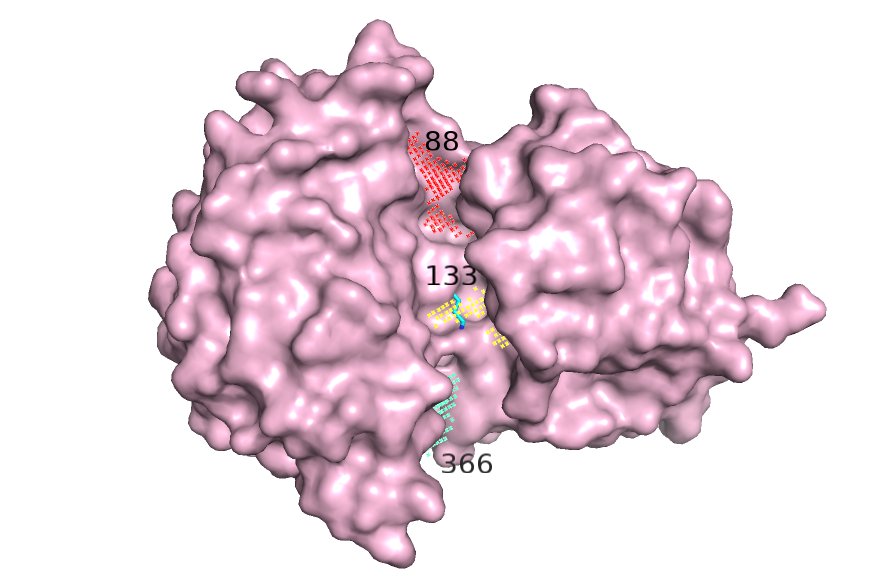
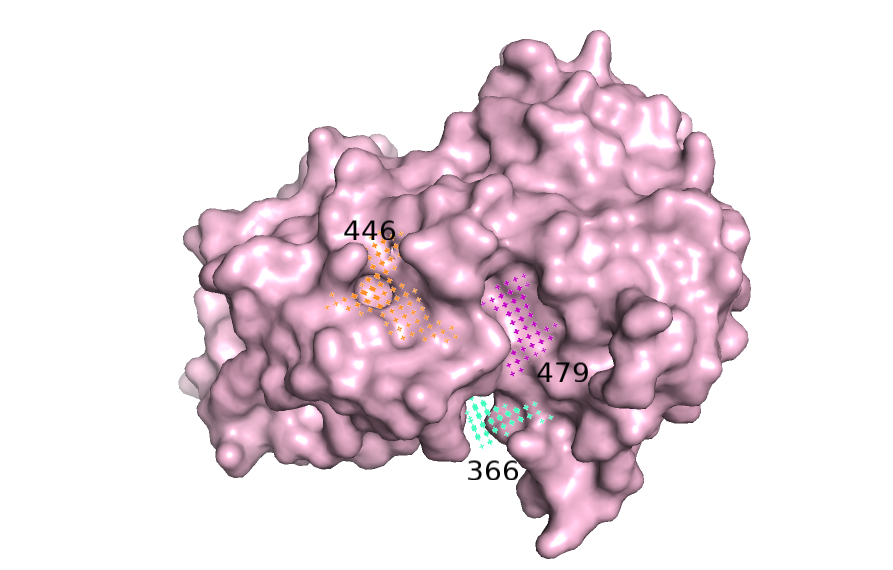
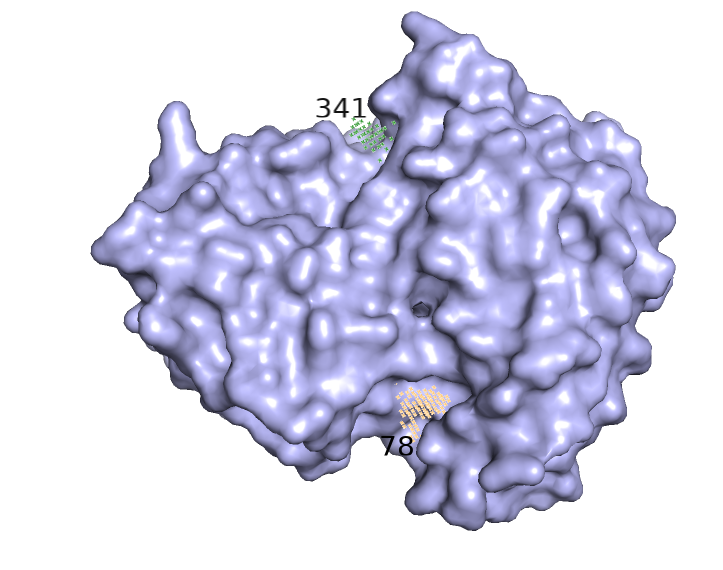
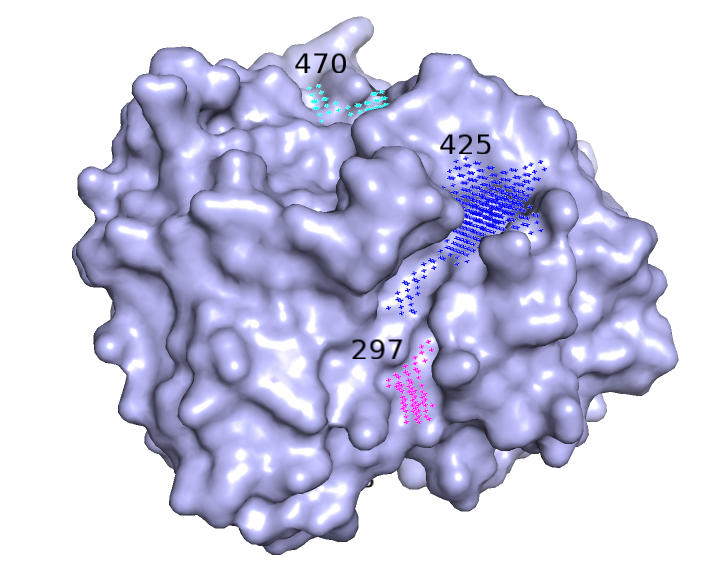
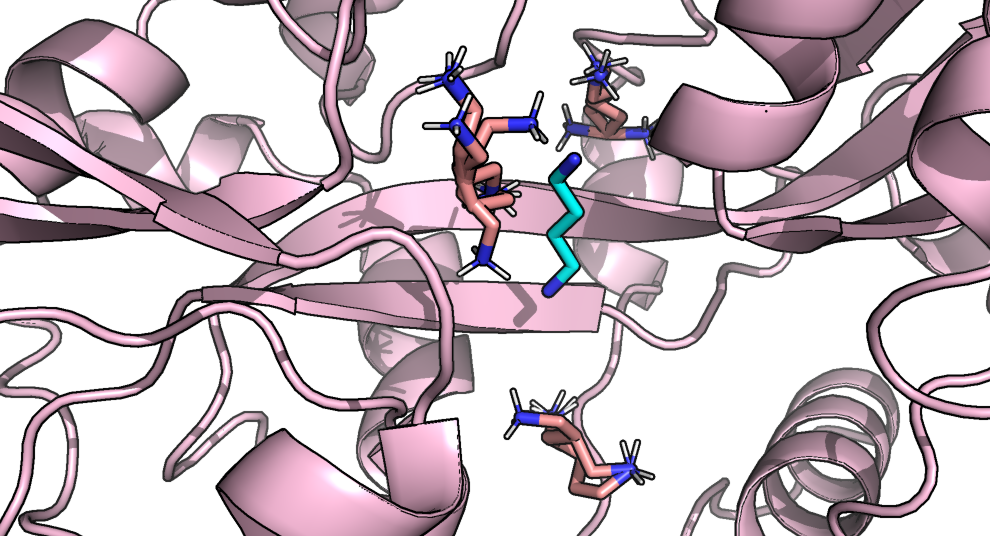
Карманы в открытой форме найдены достаточно хорошо, видна полость для связывания лиганда, но в закрытой форме такого кармана нет.
Место связывания с лигандом находится у связанной с лигандом молекулы белка, если снизить параметр Probe radius с 2 до 1 ангстрема, причем по рисунку 7 видно, что это полость, объем которой равен 37. Сравнивая объемы кармана у открытой формы и полости у закрытой можно сделать вывод о том, что объем резко уменьшается и конформационные изменения приводят к превращению открытого во внешнюю среду кармана в закрытую полость, причем стягивание аминокислотных остатков возможно происходит во время связывания, так как изначальное расположение аминокислотных остатков мешает конечному положению лиганда в белке (расстояние между атомами белка и лиганда меньше Ван-дер-Ваальсовых радиусов, рисунок 8).
Задание 2. Протонирование, подготовка к докингу
Для проведения докинга нужны протонированные формы лиганда и белка, поэтому было проведено протонирование лиганда с помощью SPORES. Лиганд небольшой и довольно простой, поэтому ожидаемо с протонированием не возникло никаких проблем, расположение водородов определяется практически однозначно (рисунок 9).
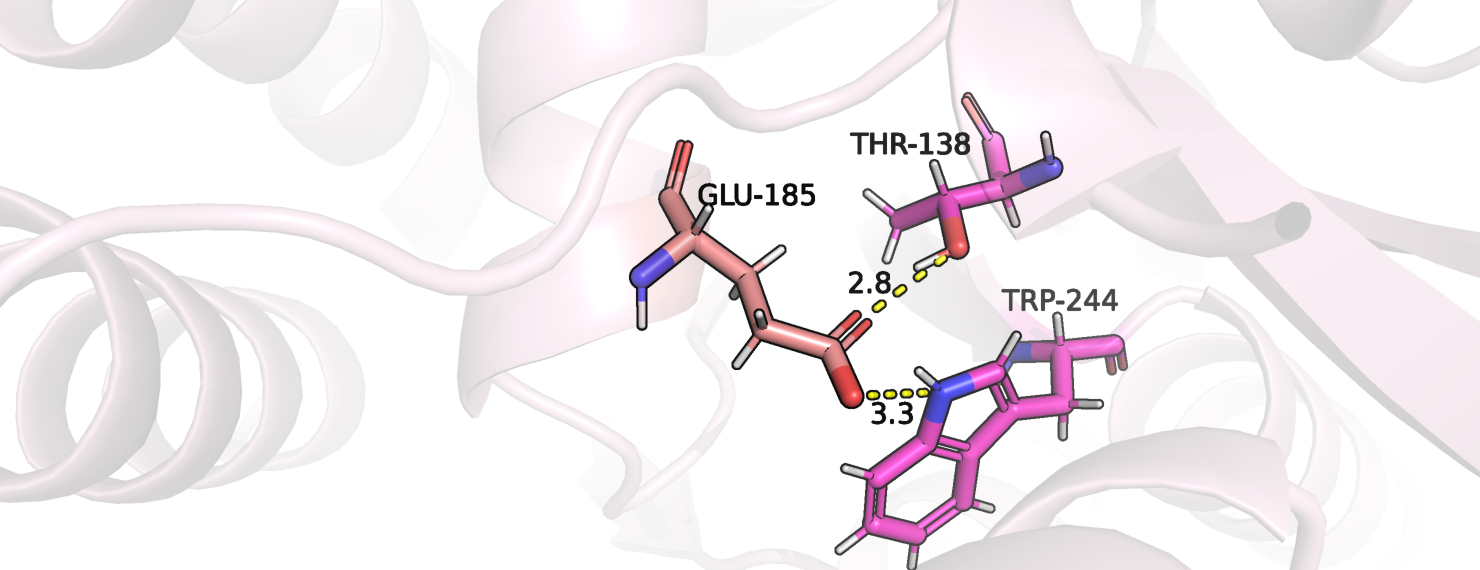
Протонирование не связанной с лигандом формы белка осуществлялось с помощью веб-сервиса PDB2PQR. После проведения протонирования можно скачать файл с предсказанными с помощью PROPKA pKa аминокислотных остатков. Проанализируем различные аминокислотные остатки, pKa которых сильнее всего отличается от референсных, на предмет ошибки.
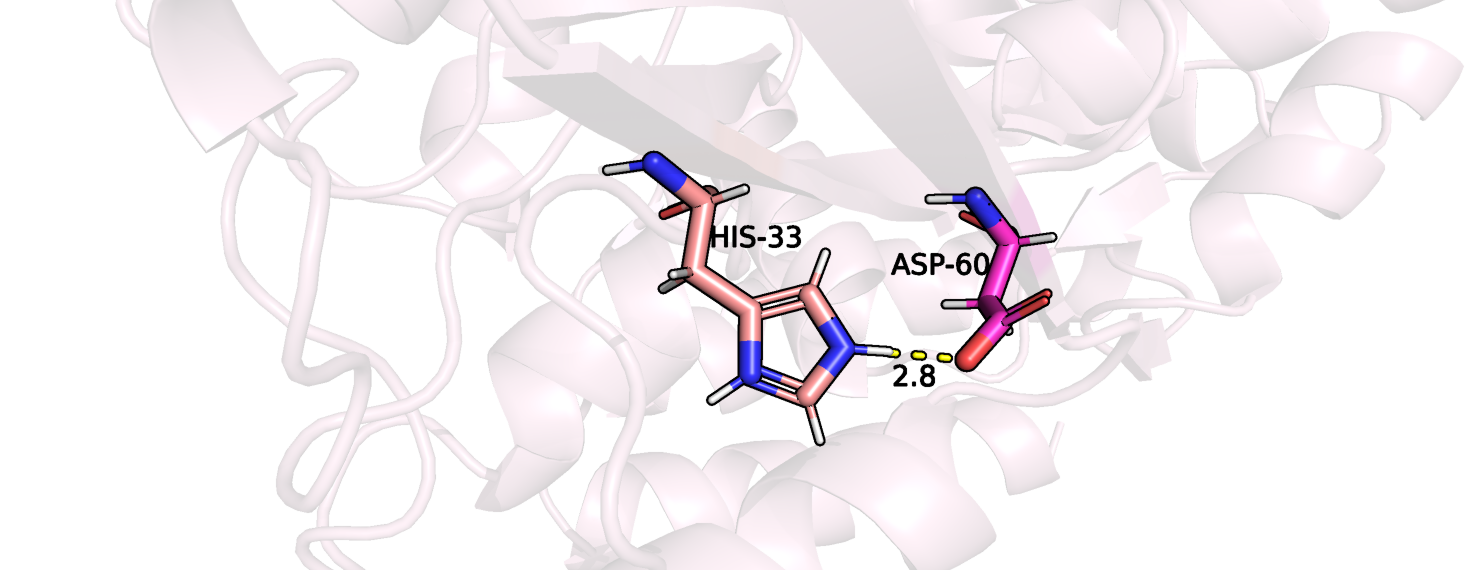
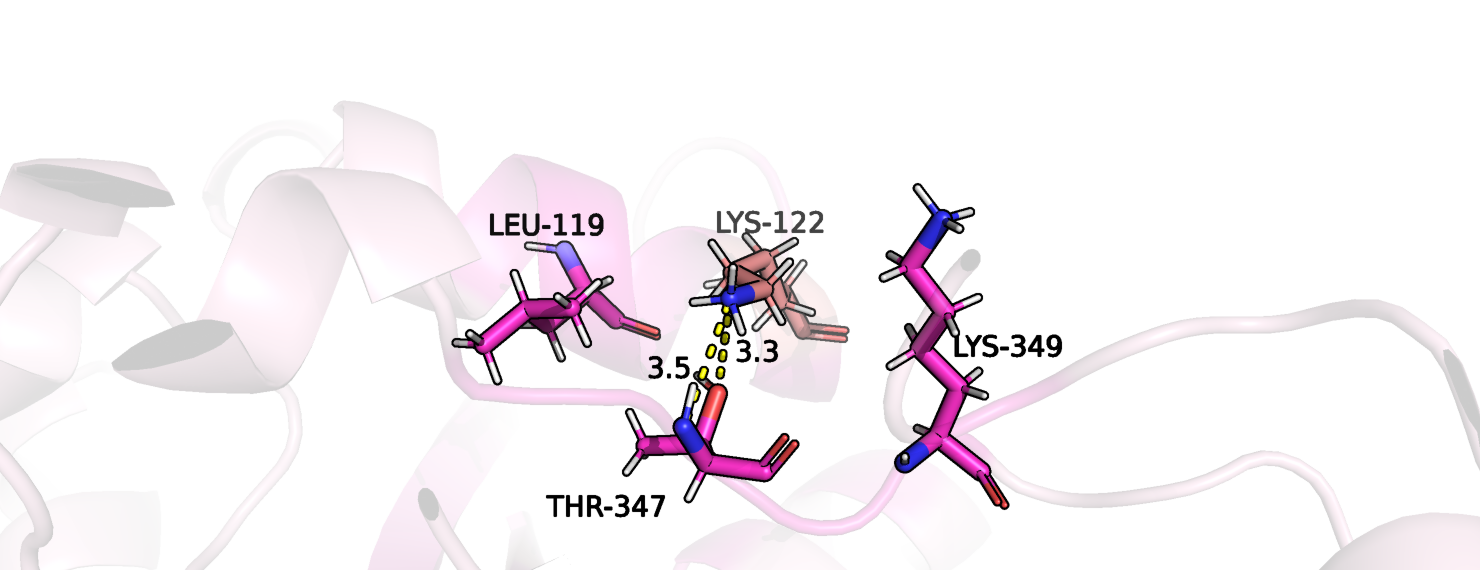
Теперь рассмотрим сильно отличающиеся pKa у закрытой протонированной формы белка, лишенной лиганда.
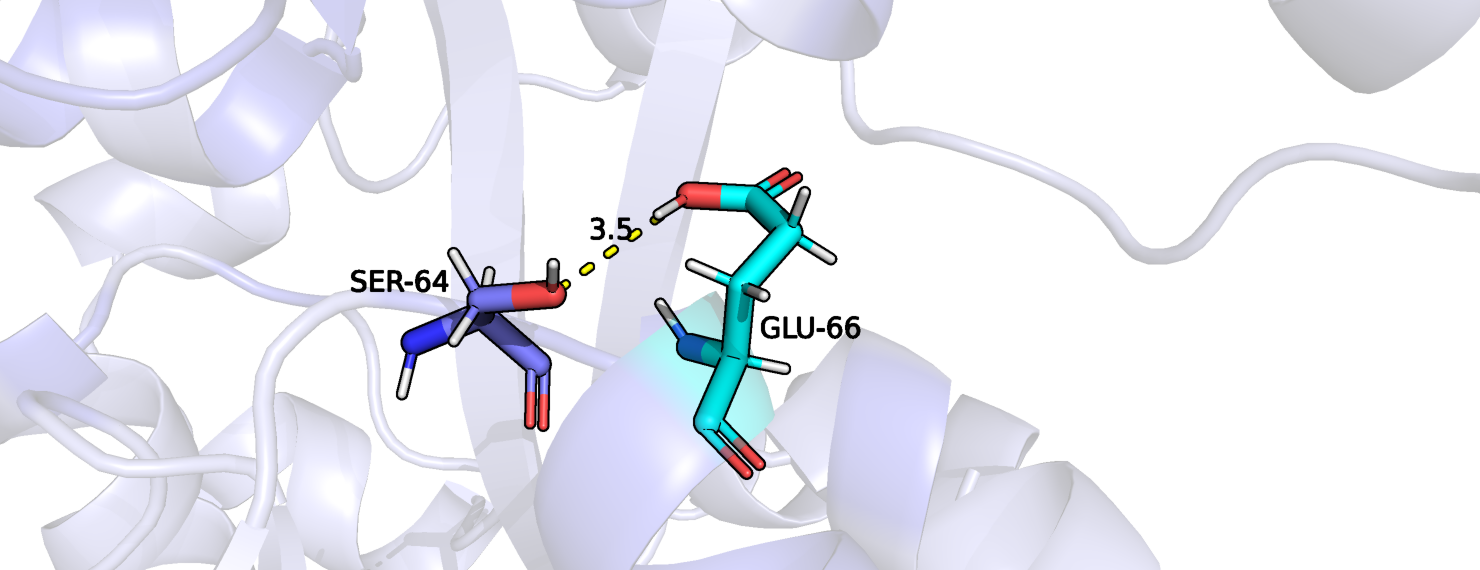
Задание 3. Докинг
После проведения протонирования структур с помощью веб-сервиса Webina было получено 9 наиболее возможных поз для молекулы лиганда в свободной форме белка. Ни одна из них не совпадает с положением лиганда в связанной форме белка, что неудивительно, так как такое положение лиганда невозможно из-за очень близких расстояний с некоторыми из атомов белка.
Далее для сравнения взаимодействий белка с первоначальным положением лиганда и лучшей из полученных поз был использован сервис PoseView. Он позволяет в 2D формате визуализировать все возможные взаимодействия. На рисунке 18 представлены взаимодействия самой оптимальной из найденных поз лиганда со свободной формой белка, взаимодействий между первоначальным лигандом и этой же формой найдено не было. Для удобства также была получена диаграмма взаимодействий между лигандом и связанной с ним формой белка.
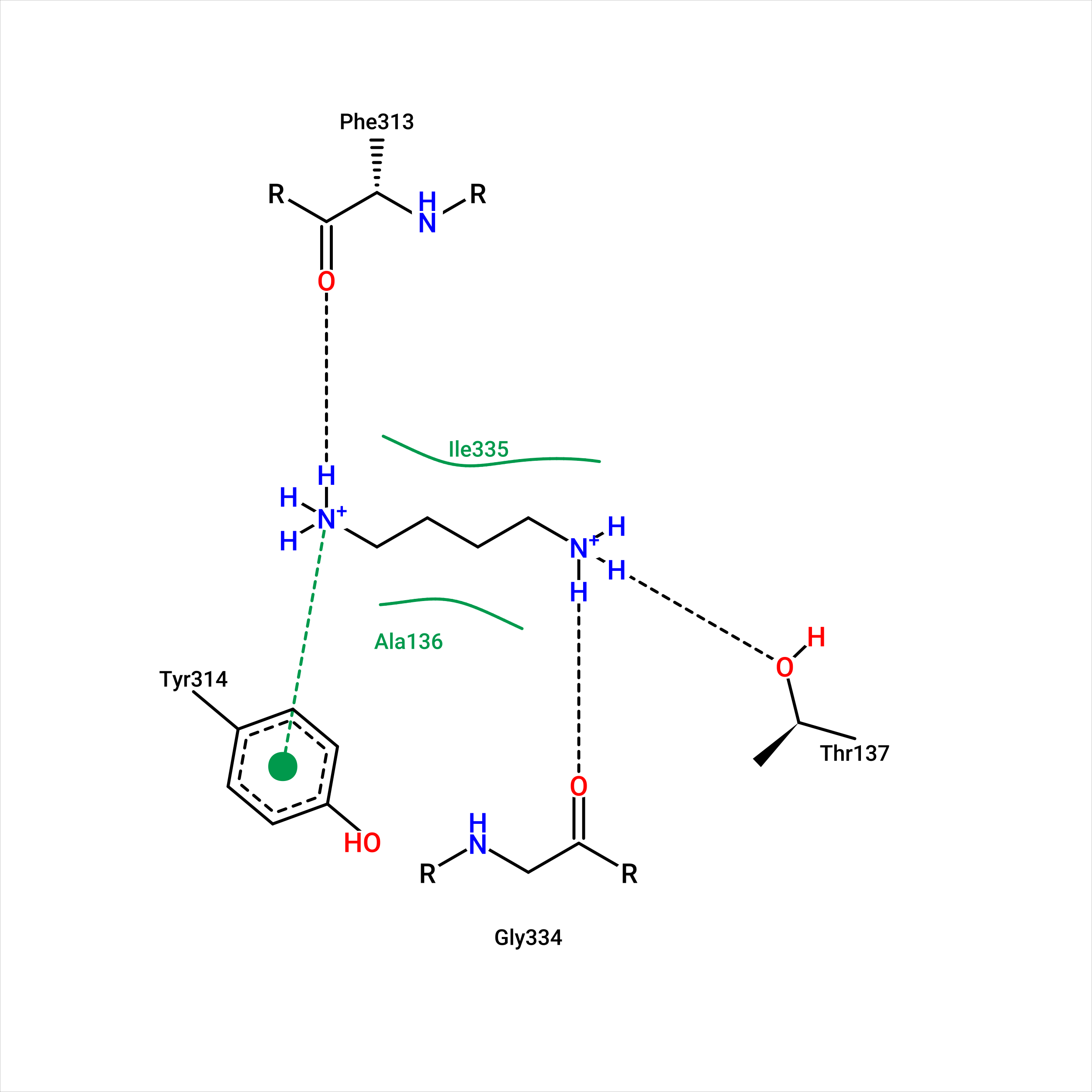
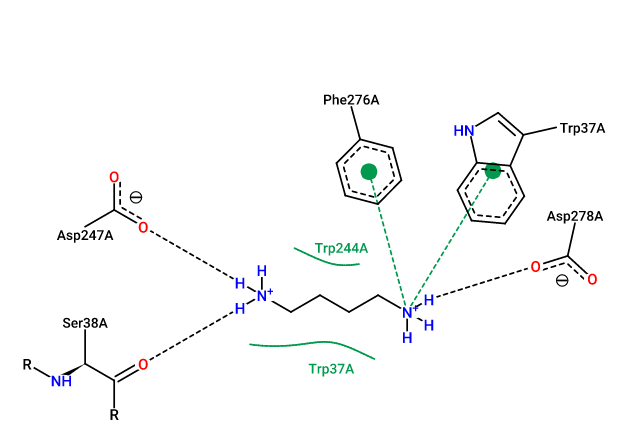
В свободной форме белка небольшая гидрофобная часть лиганда окружена гидрофобными остатками (аланин и изолейцин), тогда как положительно заряженные концевые части стабилизированы водородными связями и взаимодействием с бензольным кольцом тирозина, несущим частичный отричательный заряд. Лиганд в связанной форме окружают другие аминокислотные остатки, но с похожими свойствами: гидрофобное окружение из триптофанов, водородная связь с серином, солевые мостики с аспартатами и взаимодействие с несущими частичный отрицательный заряд бензольными кольцами фенилаланина и триптофана.
Так как не найдено было никаких взаимодействий лиганда из связанной формы с аминокислотными остатками белка свободной формы, то можно предположить, что при связывании лиганд стабилизируется в отличном от конечного кармане связывания с помощью взаимодействий с находящимися там аминокислотными остатками и далее путем конформационных перестроек лиганд принимает нужную ориентацию в соответствующей полости. Таким образом, наблюдается эффект индуцированного соответствия, так как без конформационных изменений в белке становится невозможным окончательное связывание лиганда.