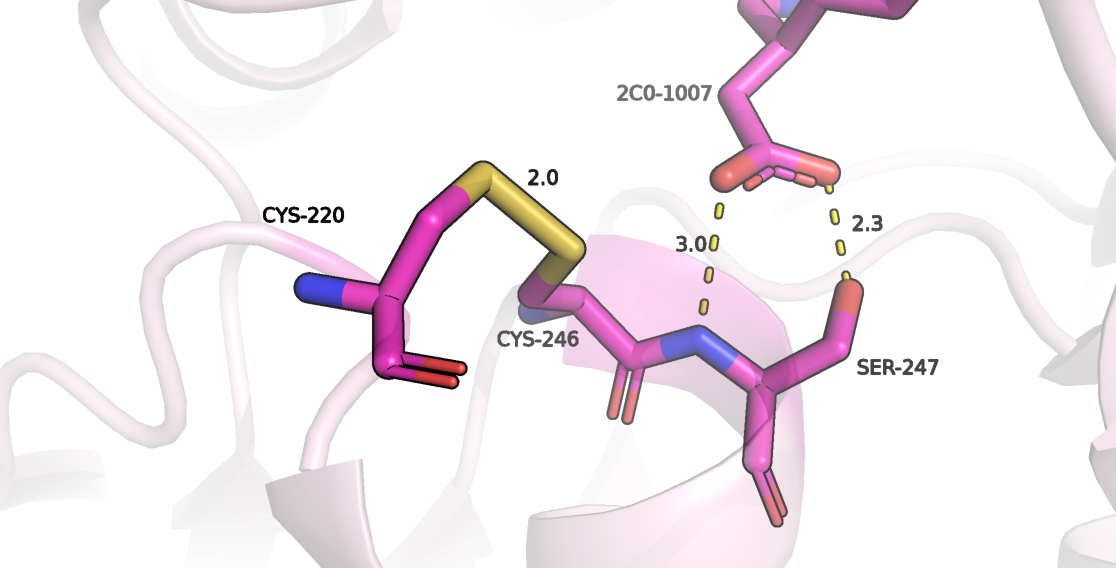Структура и функция
В данном практикуме изучалось влияние точечных мутаций на структуру и функции белка.
Для исследования роли мутаций была выбрана последовательность субъединицы 1 рецептора типа B гамма-аминомасляной кислоты обыкновенной щуки (UNIPROT ID - A0A6Q2YM18). Чтобы получить примерную структуру этого белка, был проведен поиск гомологичных последовательностей в базе данных белковых структур PDB с помощью Protein blast. Было найдено 29 возможных гомологов, два из которых были белками дрозофилы, а все остальные - человека. Структурой (7C7S_A) с лучшим процентом сходства (74,72%) (оказалась цепь А рецептора гамма-аминомасляной кислоты типа В человека). Вообще 7C7S содержит две цепи и гомологичная исходной последовательности цепь А связана с антагонистом из-за чего белок находится в неактивном состоянии. Поэтому было решено взять следующую последовательность (7C7Q_A, процент сходства 74,2%), которая идентична первой во всем кроме четырех аминокислотных остатков на C-конце, но цепь А в ней связана с агонистом, что кажется лучшим выбором, так как аналог субстрата позволит точнее исследовать влияние мутаций на активный центр и связывание с субстратом.
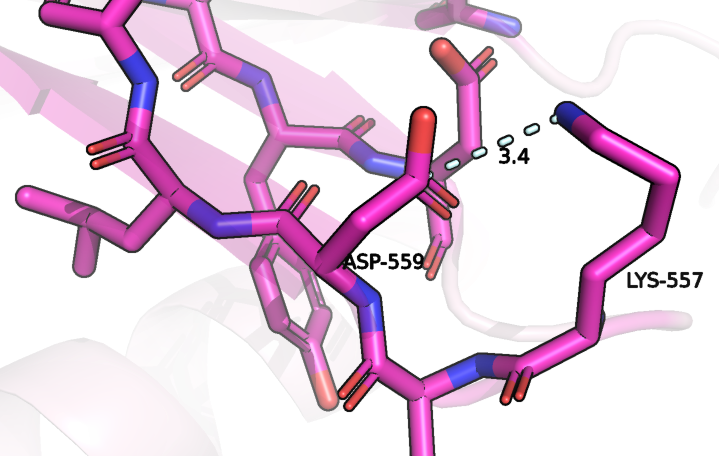
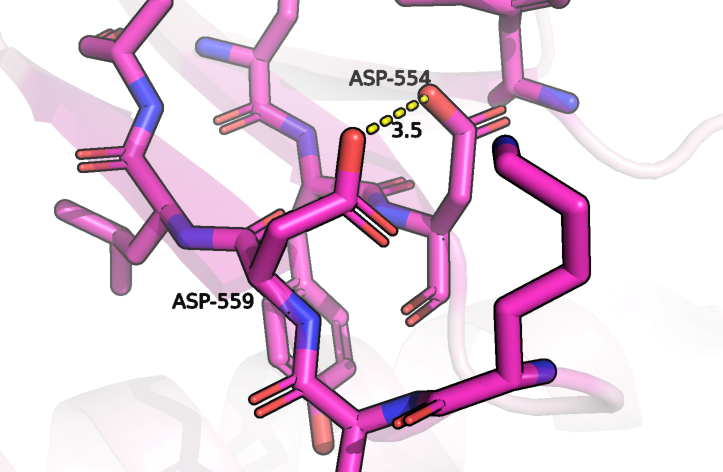
Мутация N557D
Стоит сказать, что так как номера остатков в исходной и выбранной (7С7Q) последовательности не совпадают, то номер нужного остатка в структуре 7C7Q приходилось искать по выравниванию двух последовательностей. Оказалось, что именно остаток аспрагина 557 A0A6Q2YM18 во всех гомологичных последовательностях, найденных Protein blast уже заменен на остаток аспартата. Данный остаток расположен на петле, которая находится на поверхности белка, и образует солевой мостик с рядом расположенным остатком лизина (рисунок 1). Когда на этом месте располагался остаток аспарагина, то вместо солевого мостика он бы образовывал водородную связь с остатком Asp-554, что было бы возможным благодаря появлению атома водорода, связанному с азотом (предполагается, что именно верхний кислород Asp-559 изначально был группой NH2, так как там больше пространства для расположения атомов водорода). При замене аспарагина на аспартат водородная связь заменяется на солевой мостик с другим остатком и при этом довольно близко оказываются два аминокислотных остатка с отрицательным зарядом, но отталкивания не будет, если один из остатков будет протонированным. Если протонированным будет Asp-559, то исчезнет возможность солевого мостика, но будет возможным образование водородной связи с кислородом Asp-554, и тогда сохранятся все связи, существовавшие в молекуле до мутации. Таким образом, эта мутация существенно не повлияет на структуру и следовательно функции этого белка.
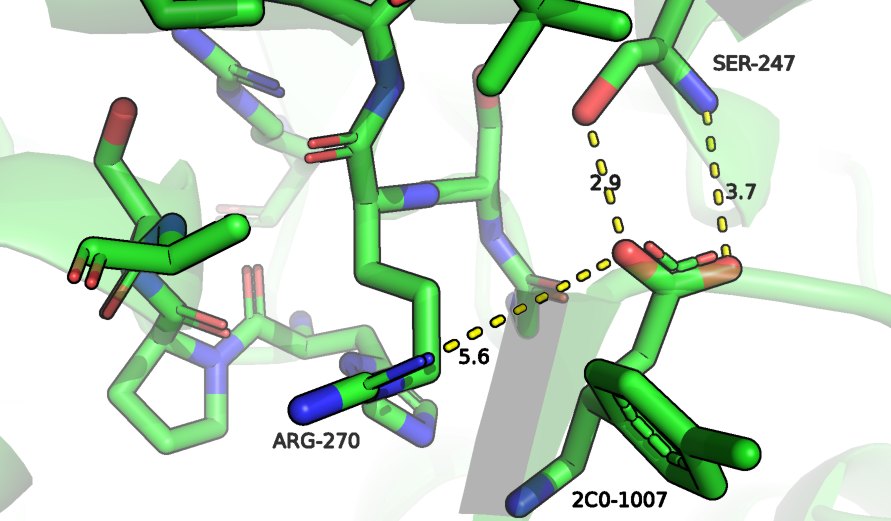
Мутация S267R
В данной структуре остатку Ser-267 A0A6Q2YM18 соответствует Ser-270, который находится рядом с сайтом связывания субстрата (баклофена, отличающегося от гамма-аминомасляной кислоты наличием у бета-углерода радикала) и образует с баклофеном водородную связь (рисунок 2). Уже видно, что с расположением большого остатка аргинина в таком маленьком пространстве будут возникать проблемы, и действительно, из 20 возможных ротамеров аргинина только два из них имеют strain меньше 25, но даже для приобретения ими положения, которое ничему не мешает, должны измениться положения всех рядом расположенных атомов, в том чиле и субстрата, что приведет не только к разрыву водородной связи, которую образовывал Ser-270 с баклофеном, но и одной из водородных связей Ser-247 с баклофеном. Из-за этого расположение баклофена в кармане связывания, во всяком случае этой его концевой части будет полностью нестабильным, поэтому данная мутация имеет негативные последствия и приведет к значительному ухудшению константы связывания с субстратом.
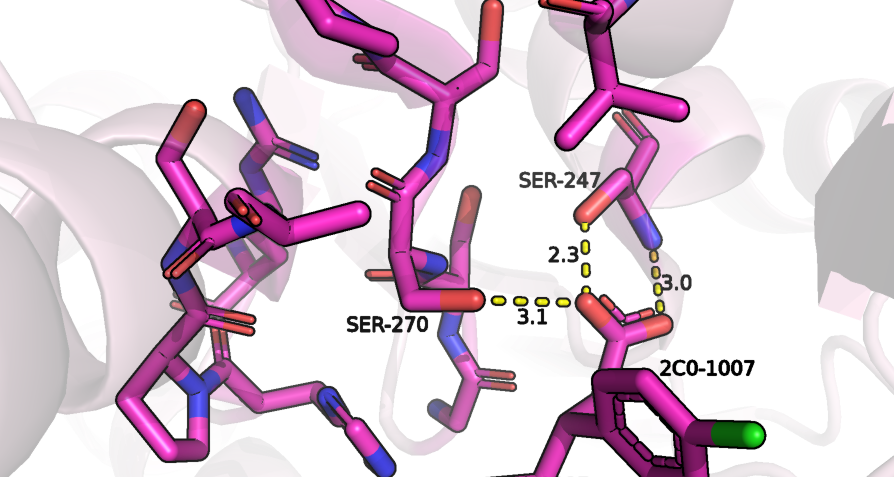
Мутация C217S
При замене Cys-220 на любой другой аминокислотный остаток пропадет S-S связь (рисунок 3), что может привести к отдалению двух остатков цистеина, что, в свою очередь, возможно повлияет на рядом расположенный серин, который стабилизирует субстрат в центре связывания. В любом случае можно точно сказать, что при замене цистеина на серин несмотря на близкие размеры этих двух аминоксилотных остатков все ротамеры (3) не имеют достаточно низкий strain, чтобы была возможна релаксации, при которой исчезнут все нестабильные для белка взаимодействия. Поэтому можно заявить, что данная замена также нарушит структуру белка.