Описание структуры эндонуклеазы, захватывающей кэп, в комплексе с ингибитором 27, выделенной из вируса озера Эбинур.
1.Общее описание
- Представленная макромолекула является белком.
- В полимерной структуре присутствует 1 идентичная полипептидная цепь.
- Биологическая единица состоит из 1 идентичной полипептидной цепи, в ней преобладают альфа-спирали. Биологическая единица не отличается от ассиметрической.
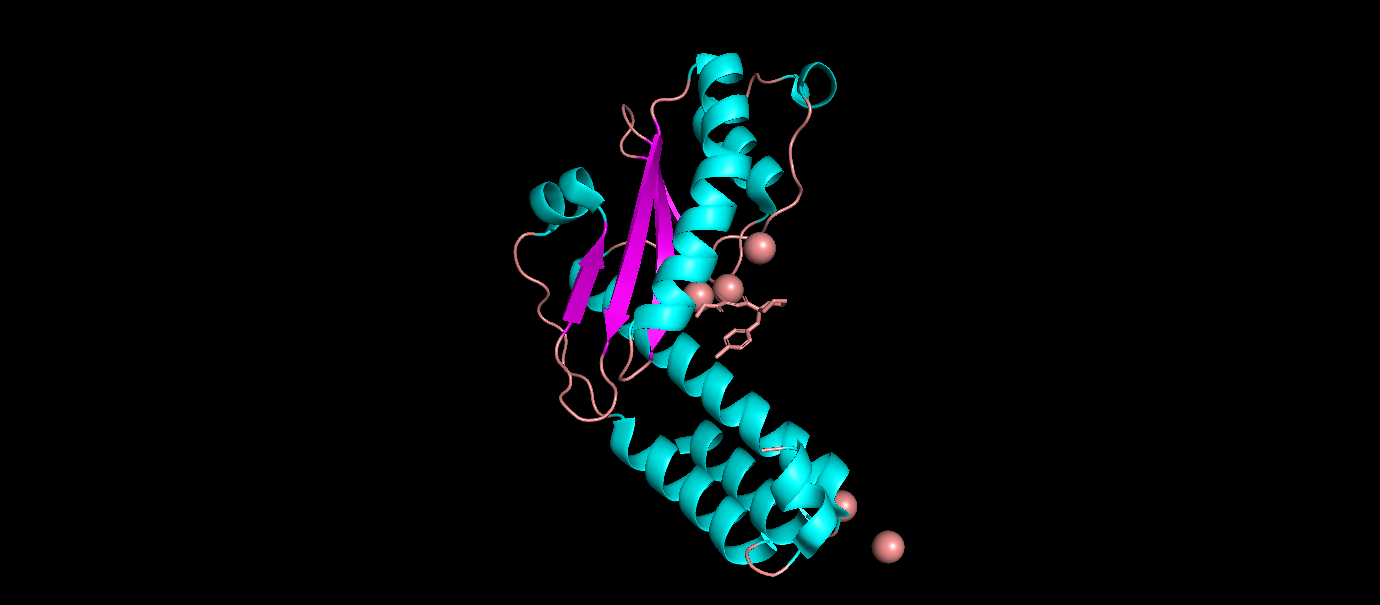
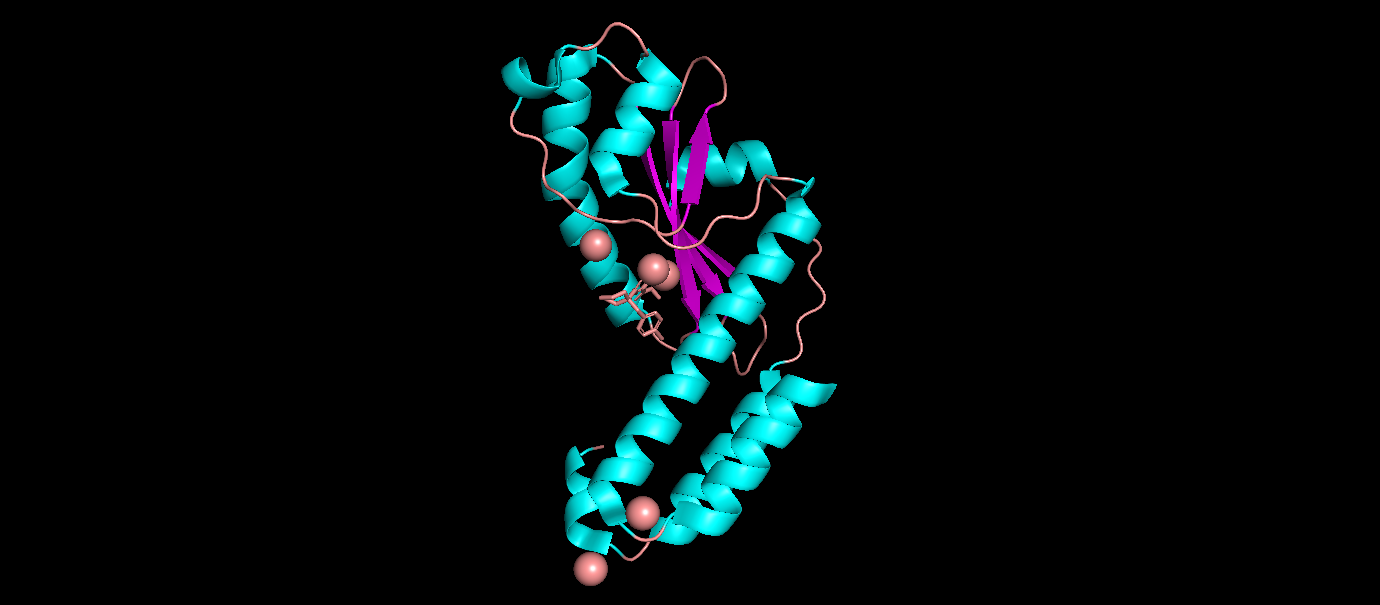
2.Описание отдельных цепей
- Данная макромолекула относится к вирусу озера Эбинур.
- UniProt id- A0A059WLS9 , название- эндонуклеаза, захватывающая кэп, в комплексе с ингибитором 27.
- Мутаций нет
3. Малые молекулы
- В записи присутствуют 4 типа малых молекул:
- Вода (Water, HOH)
- Ионы магния(MANGANESE (II) ION, MN)
- Ионы хлора (CHLORIDE ION, Cl)
- Ингибитор 27 (Метил (Z)-4-[1-[(3-хлорофенил)метил]-4-[(4-хлорофенил)метил]пиперидин-4-ил]-2-oxidanyl-4-oxidanylidene-but-2-enoate, I27)
- Ссылка на файл pdb, включающий эти малые молекулы
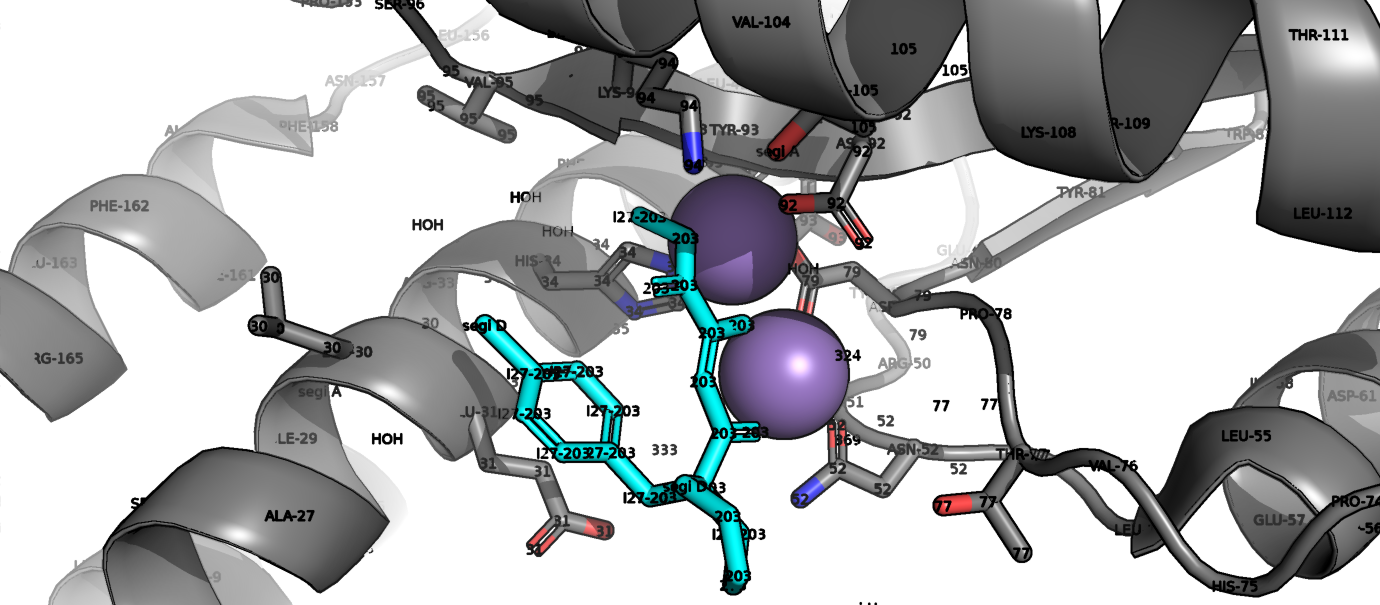
4. Взаимодействия в структуре
4.1 Водородные связи
Среди вторичнх структур в данном белке множество альфа-спиралей, соответственно поддерживаемых водроными связями, между осноными цепями последовательности.
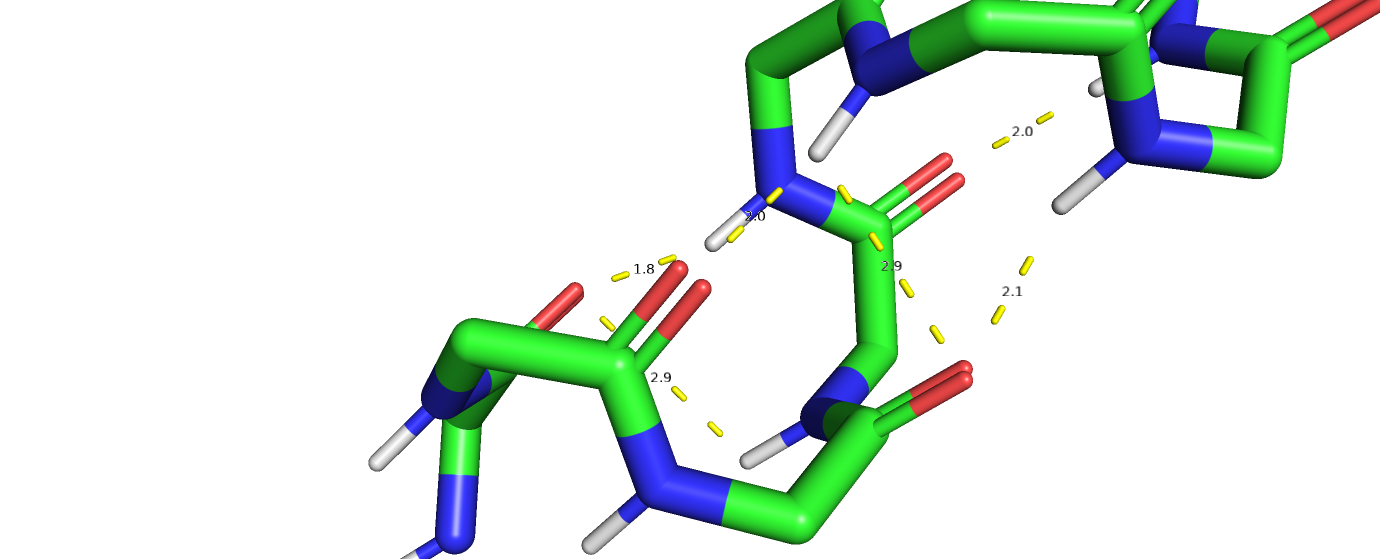
Кроме того, водородные связи присутсвуют и между радикалаи аминокислот.
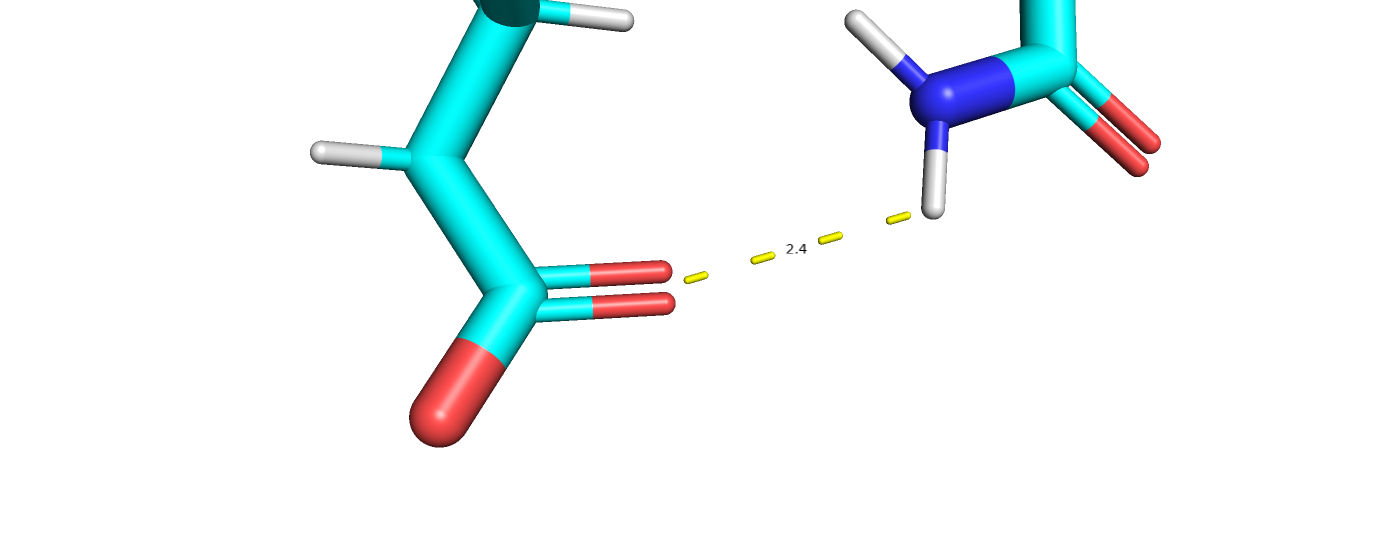
4.1 Электростатические взаимодействия
Данный белок содержит много разнозаряженных аминокислот, между которыми происходят электростатические взаимодейсвия, образующе солевые мостики.

Прочие взаимодействия
В данной структуре не были обнаружены остатки ни цистеина, ни каких либо ароматических аминоислот. Соответственно, ни дисульфидные связи, ни взаимодействия ароматических систем в данном белке не представлены.
5. Ферментативная активность
Данный белок является РНК-зависимой РНК-полимеразой (РЗРП), которая катализирует реакцию: NTP + PNA(n) <=> PP + RNA(n+1). Для эффективной транскрипции вирусного генома РЗРП способна расщеплять или “выхватывать” кэпы РНК из мРНК хозяина с помощью своего домена N-концевой эндонуклеазы, а затем использовать их в качестве праймеров для синтеза вирусной мРНК.
В активный центр входят 9 аминокислот: H34, N52, P78, D79, D92, K94, T105, K108 и Y109 (тк в PDB не описан активный сайт данные взяты из статьи). Аминокислоты активного центра координируют атомы магния и хлора.
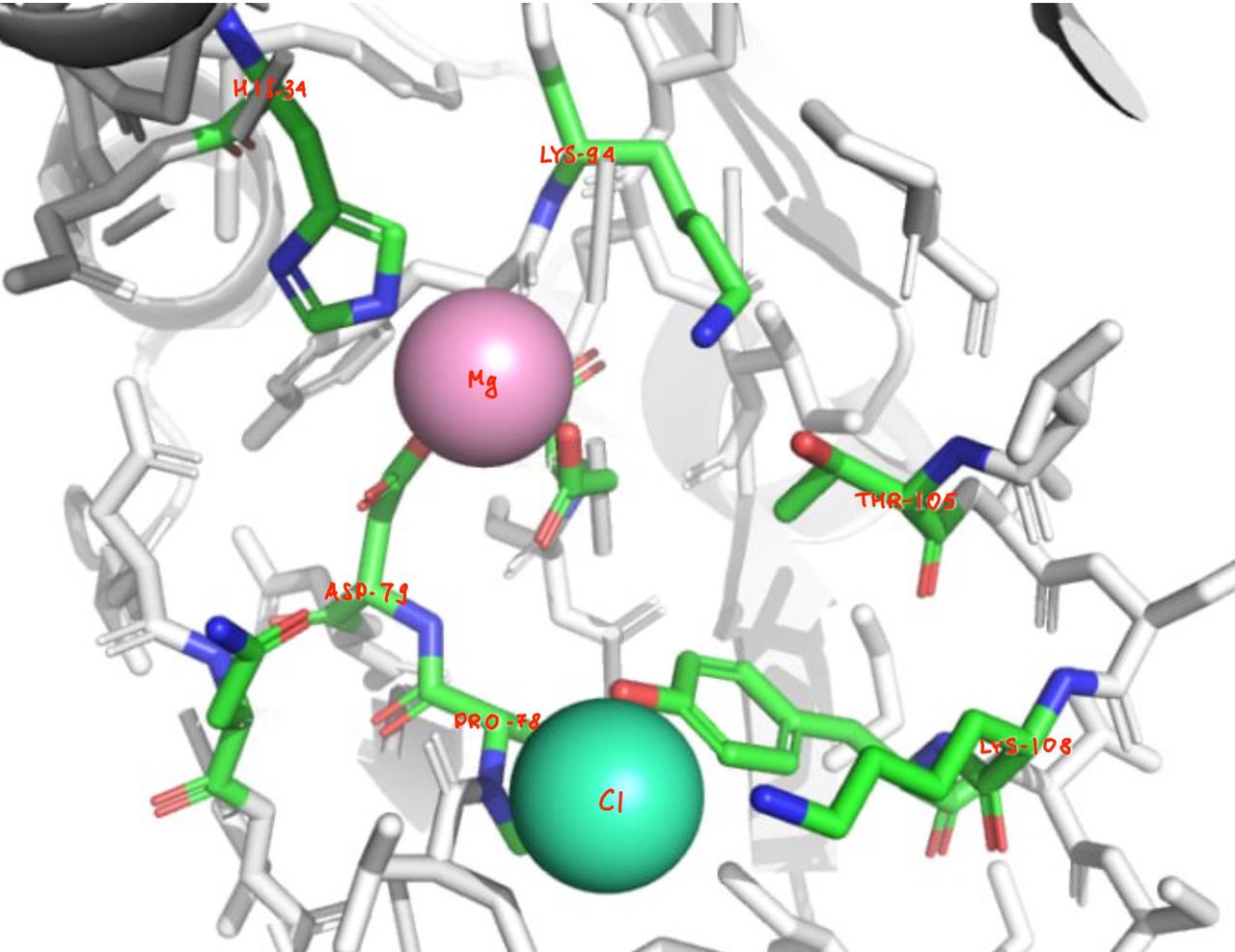
Аминокислотные остатки активного центра связаны между собой и с окружением водородными связями.
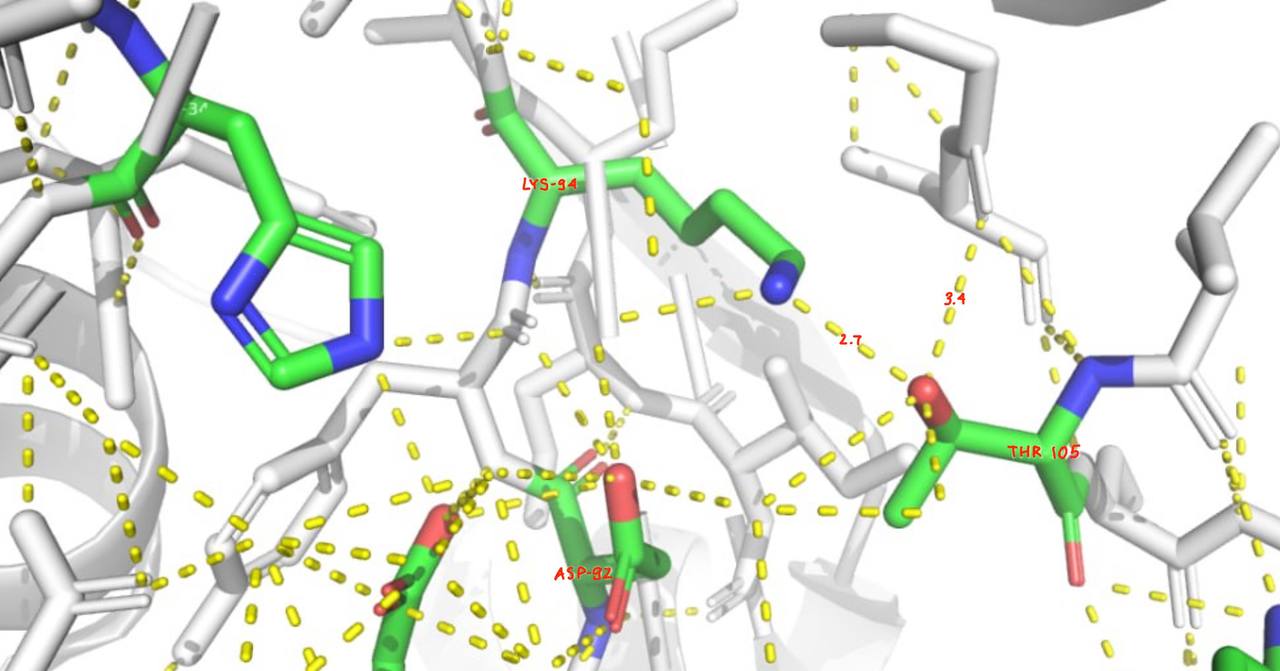
Также аминокислоты активного сайта связаны с ингибитором I27.

Ингибитор I27, связываясь с активным сайтом, мешает координации атомов металла, что нарушает каталитическую активность фермента.