Контакты между аминокилотными остатками в белках
Аминокислотные остатки в белках могут образовывать множество связей: пептидные связи создают первичную структуру белка, объединяя звенья полипептидной цепи в одно целое; остальные связи необходимы для поддержания вторичной и третичной структуры, которые, собственно, и определяют функциональные свойства белков. В этой работе разобраны основные типы контактов и проиллюстрированы примерами из структуры 1D3Y, разобранной в прошлых практикумах.
Водородные связи
Водородные связи - наиболее многочисленные контакты в белках. Они образуются, когда в доноре связи атом, связанный с водородом намного электроотрицательнее его и оттягивает его электрон, оставляя частичный положительный заряд; в акцепторе же связи есть атом, имеющий неподеленную электронную пару, которую он частично отдаёт на образование донорно-акцепторной связи с атом водорода второй частицы. Возникая в остове они обуславливают образование вторичных структур: α-спиралей и β-листов. Водородные связи, в образовании которых принимают участие боковые радикалы аминокислот, могут выполнять различные функции: удерживать вместе элементы вторичной структуры, связывать малые молекулы, обеспечивать взаимодействие с растворителем.
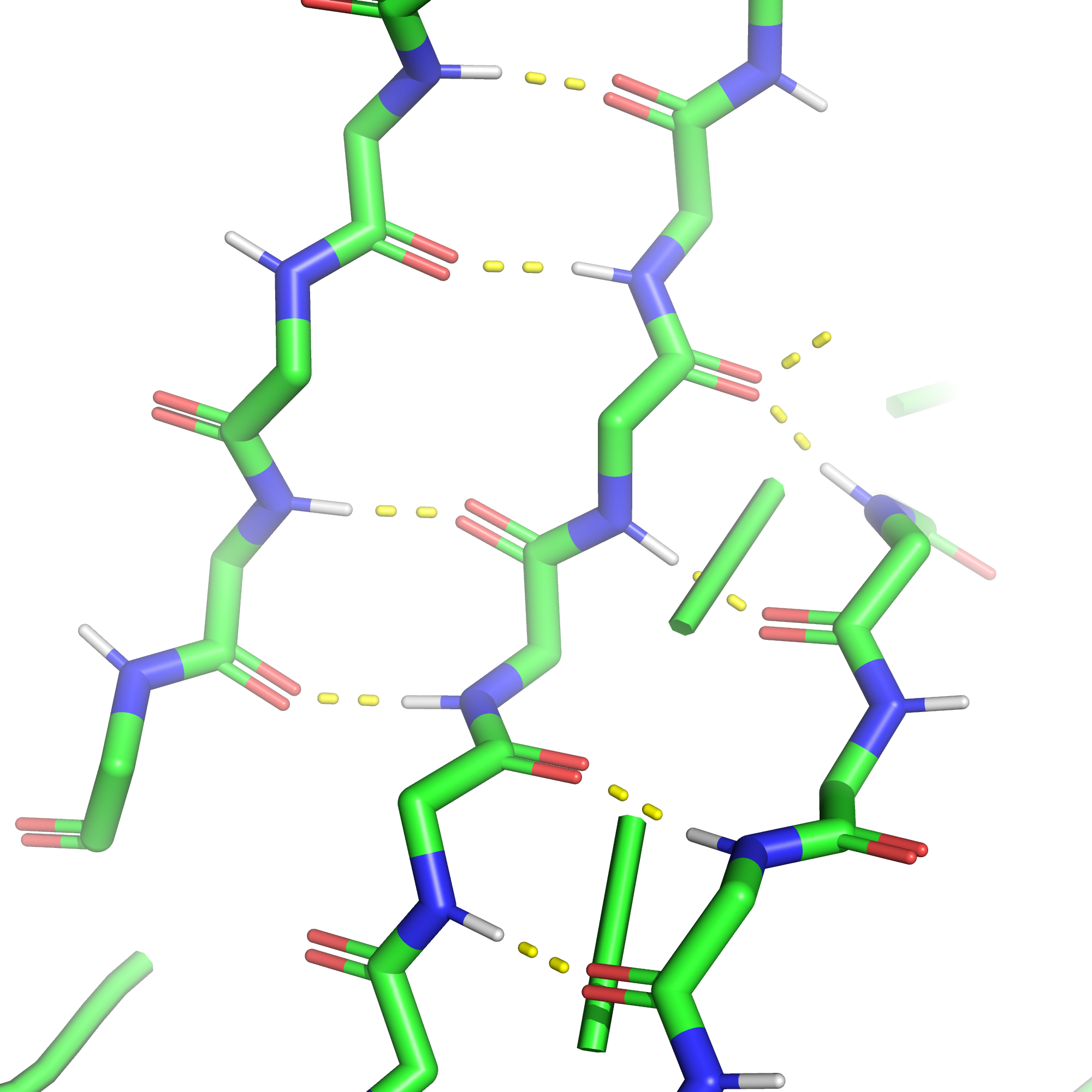
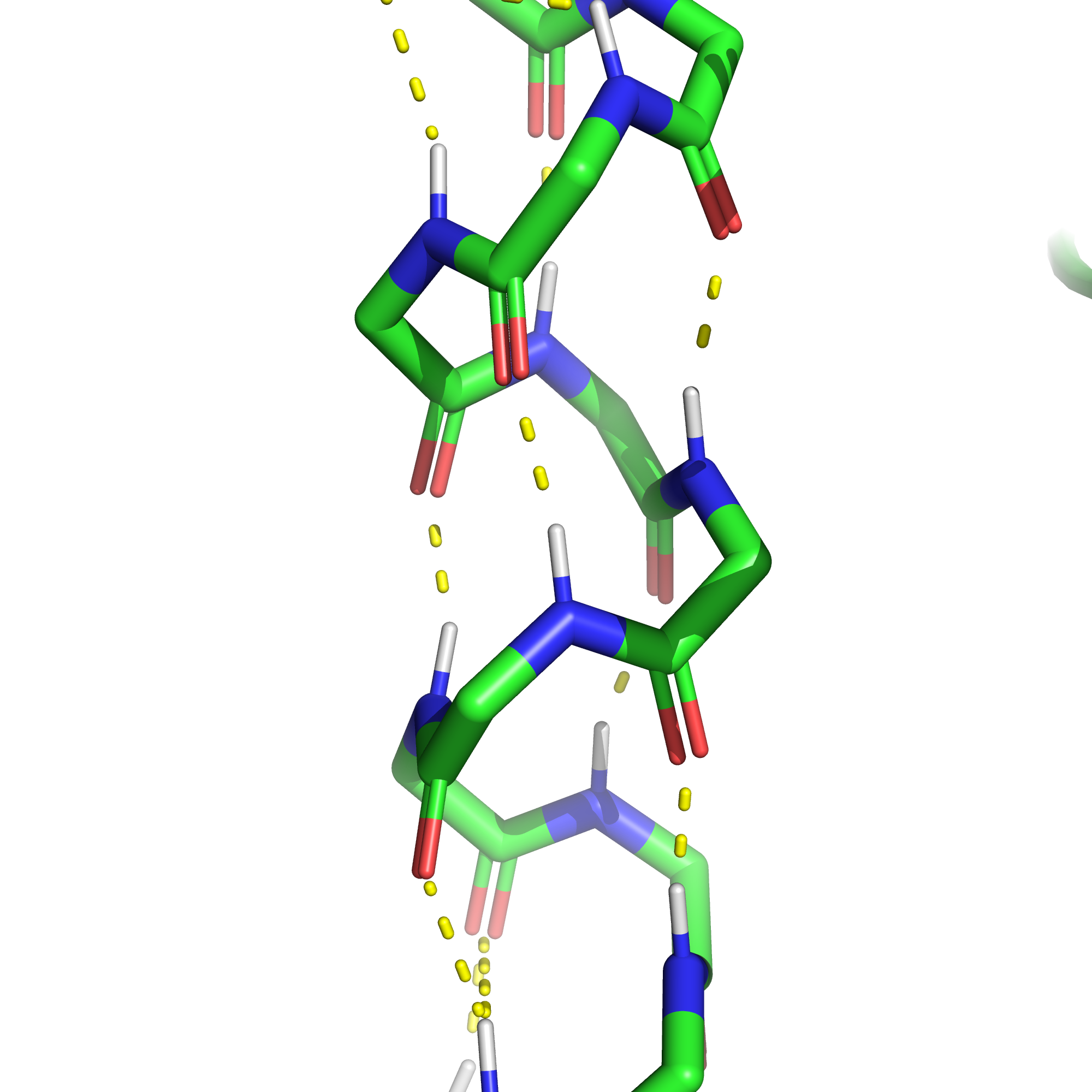
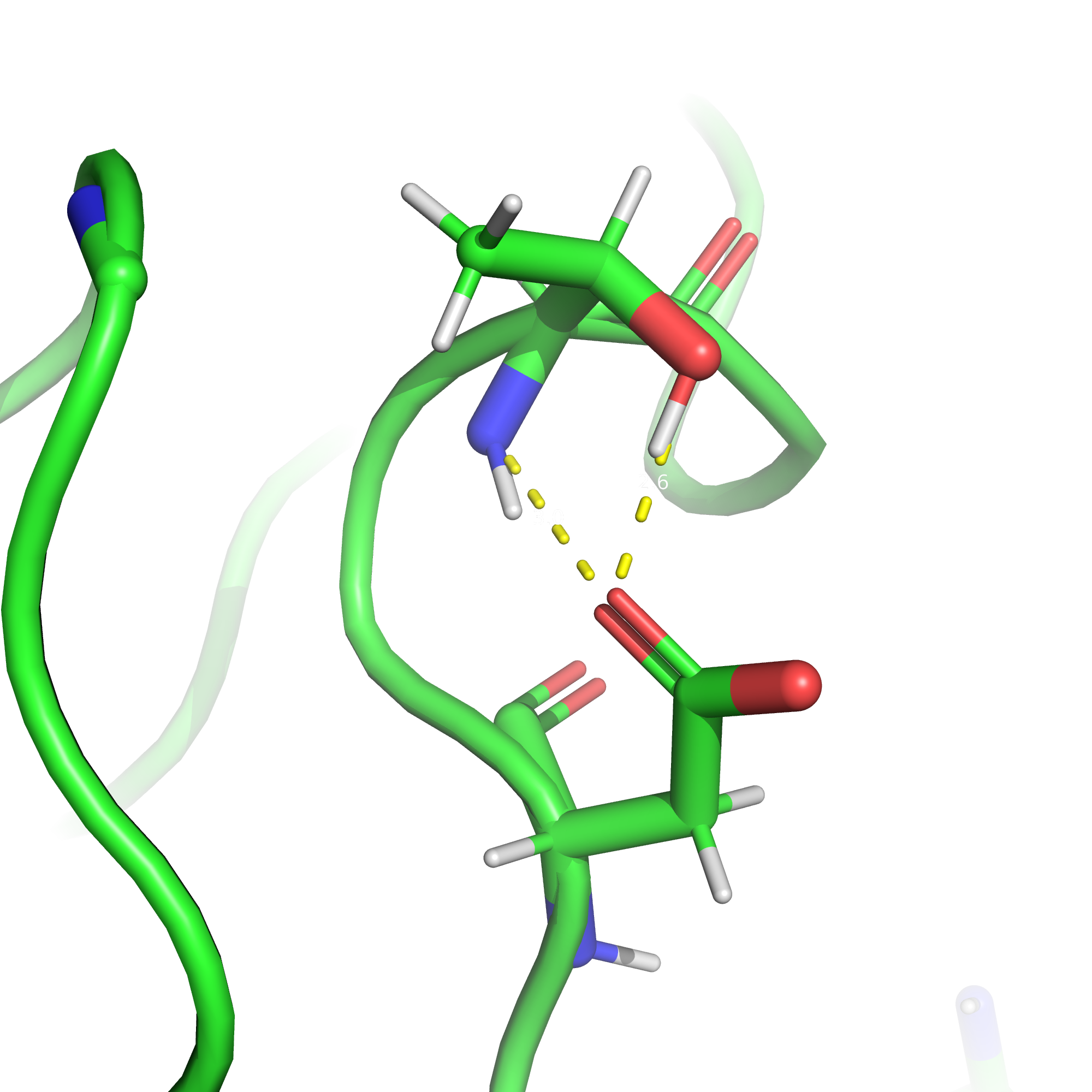
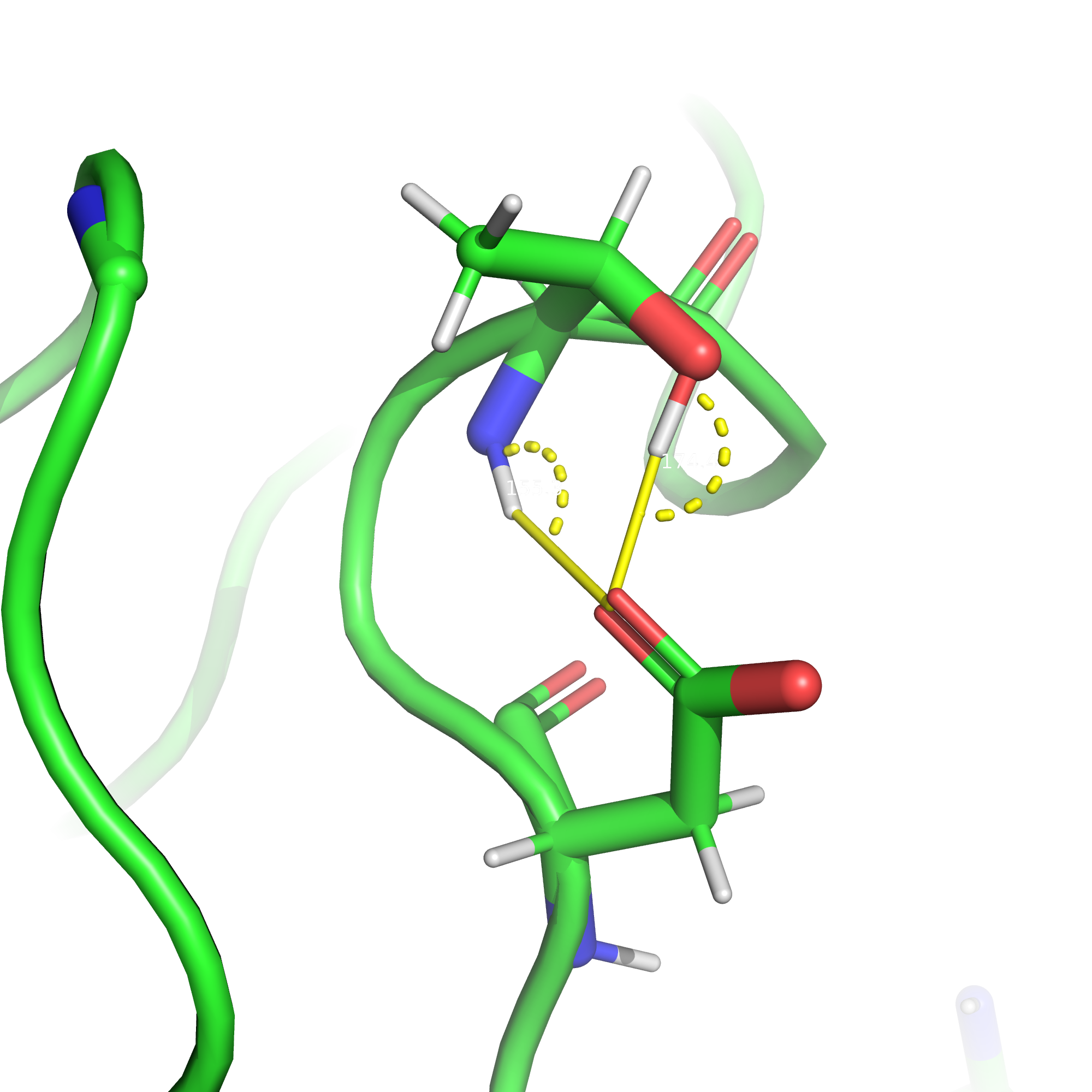
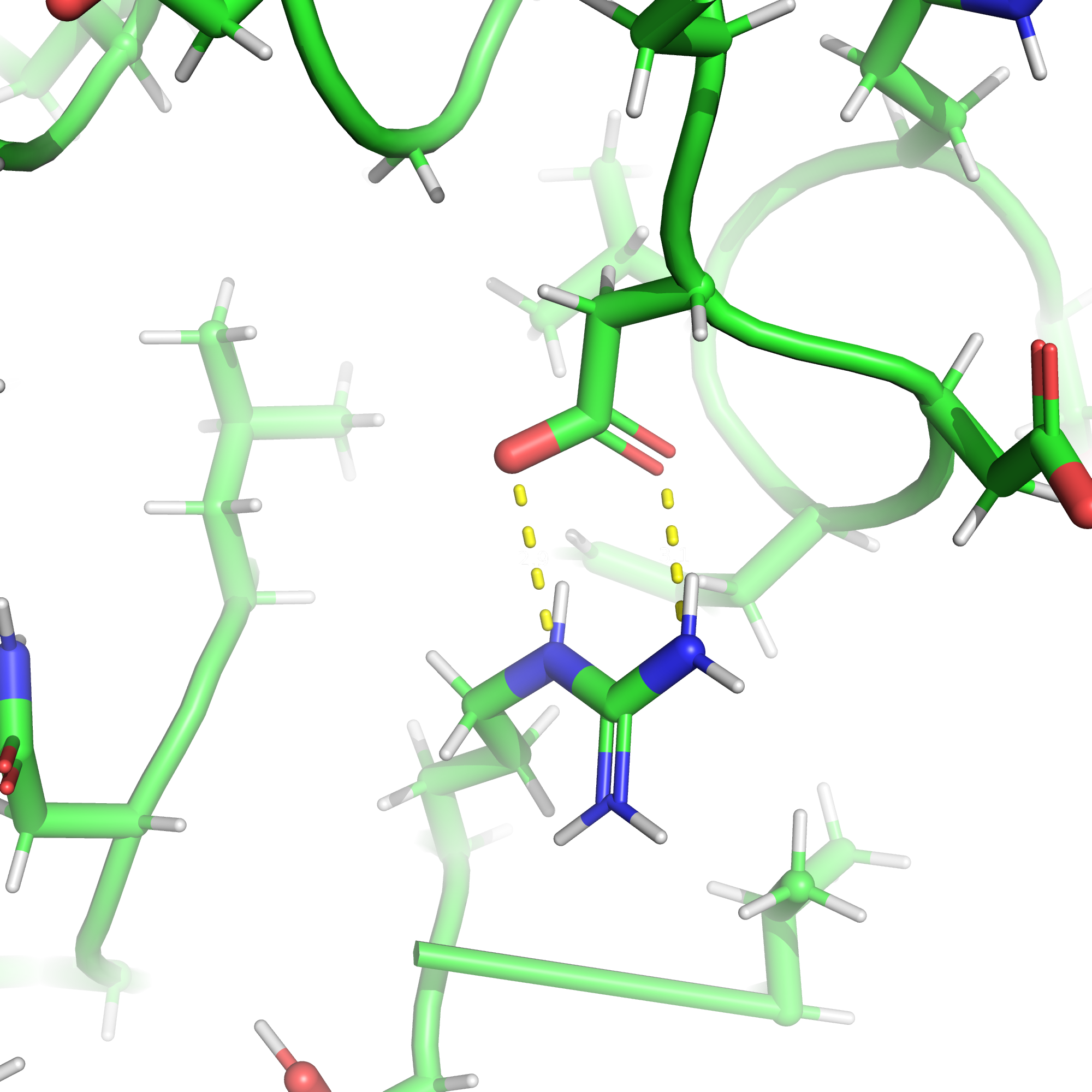
Солевые мостики
Солевые мостики возникают между атомами c противоположным зарядом благодаря силам электростатического притяжения.
Дисульфидная связь
В отличие от остальных проиллюстрированых типов связей, эта - ковалентная, а, следовательно, намного прочнее. Однако она и гораздо реже встречается, а в белке, на примере которого я показываю связи, её вообще нет.
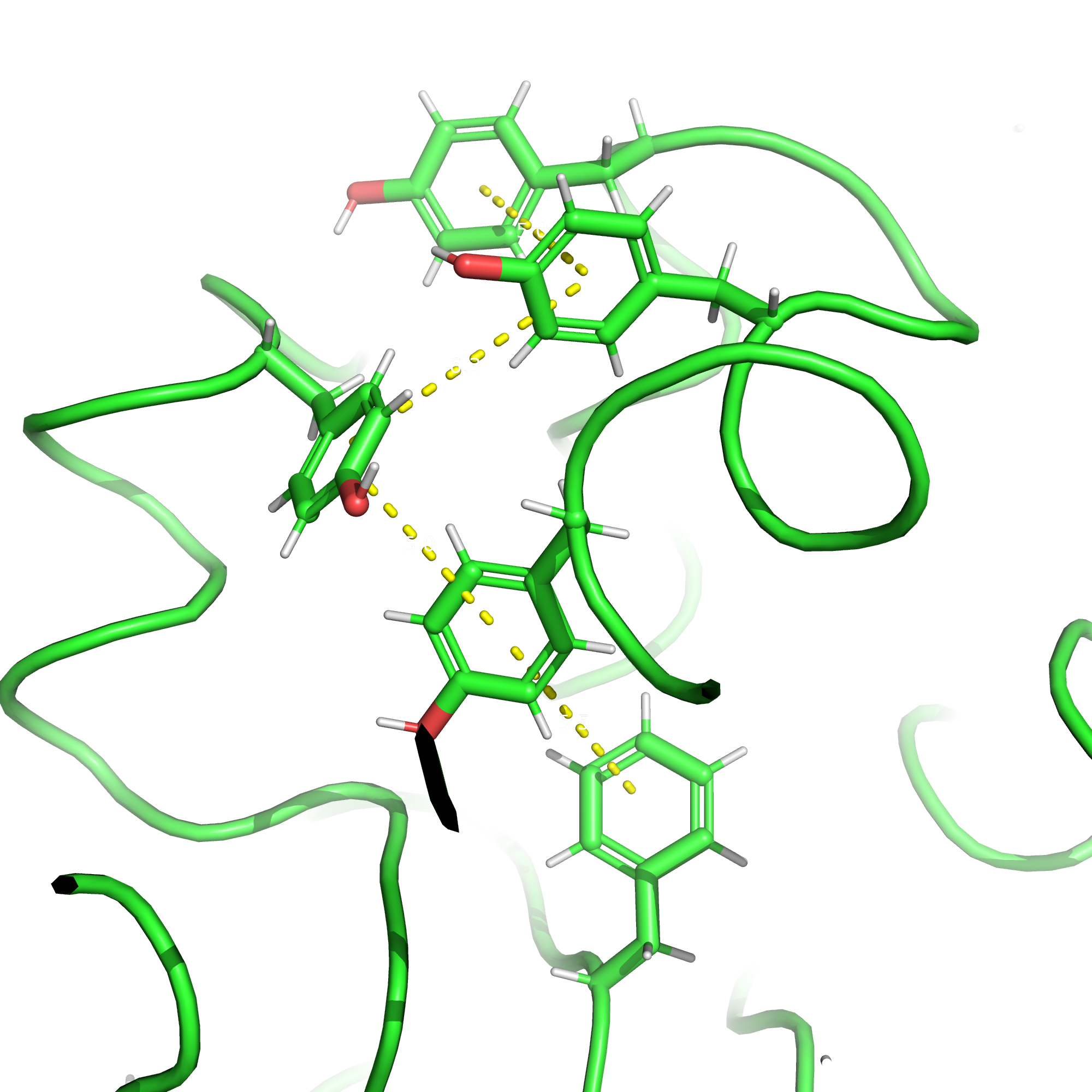
Стекинг-взаимодействия
Стекинг-взаимодействия образуются между ароматическими кольцами засчёт перекрывания орбиталей π-электронов.