Альтернативные положения, B-фактор, кристалл
В данном практикуме анализировалась структура белка лизоцима (PDB ID: 6RT3). Ссылка на PDB-файл.
Задание 1. Альтертнативные положения
При анализе кристаллизованного образца в нём иногда обнаруживаются остатки, имеющие различную конформацию. Зачастую число альтернативно расположенных остатков невелико, и на расшифровке есть консенсус, однако изредка встречаются ситуации, когда число ячеек с альтернативной конформацией сопоставимо с основной (или вовсе нельзя понять, какая из конформаций основная). Анализируемый остаток: аспарагин на позиции 59. У него было выявлено три конформации - B, C и D.
Pymol-сессия работы для задания 1.
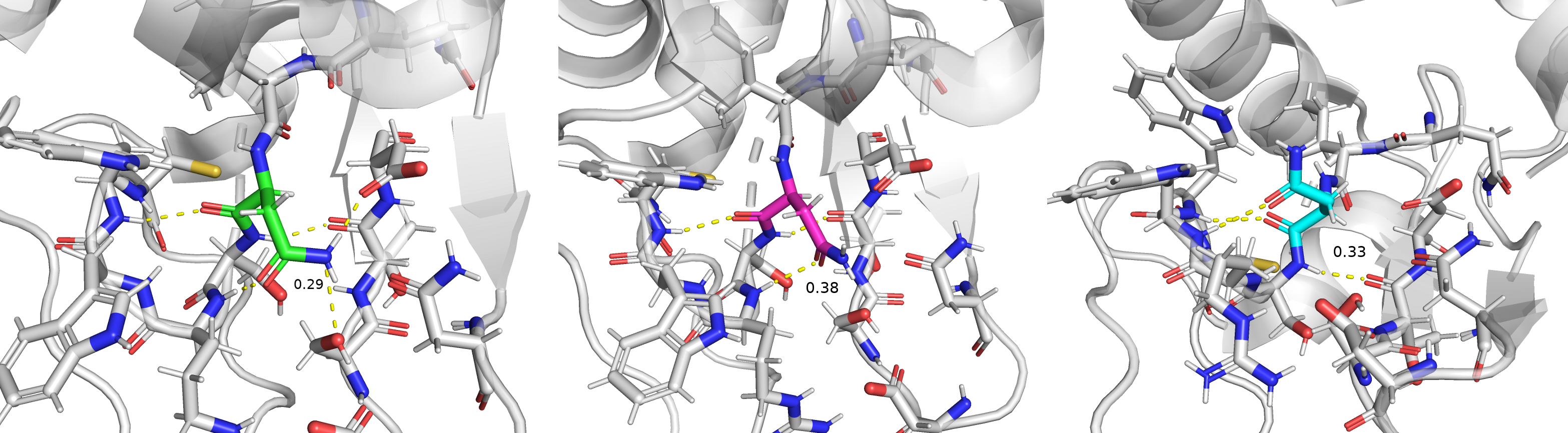
В конформации B 5 водородных связей, две у атомов остова ASN-59 и три у боковой группы. Мне эта конформация показалась наиболее стабильной, хотя её occypancy не самый высокий. В конформации C 3 водородных связи, все имеют аналоги в конформации B, но по сравнению с ней отсутствуют водородные связи у азота аминогруппы. В конформации D те же три связи, что и в C. Думаю, что конформация B будет наиболее стабильна в физиологических условиях, но в кристалле связи с азотом аминогруппы по той или иной причине исчезают и аминокислота меняет положение.
Задание 2
В задании 2 рассматривался B-фактор остова белка, целого белка и отдельно взятой аминокислоты, для которой также рассматривался mesh электронной плотности при разных уровнях подрезки. В-фактор описывает неточность положения атомов, вызванную либо тепловой подвижностью, либо наличием нескольких возможных конформаций, которые "наслаиваются" друг на друга.
Pymol-сессия работы для задания 2.
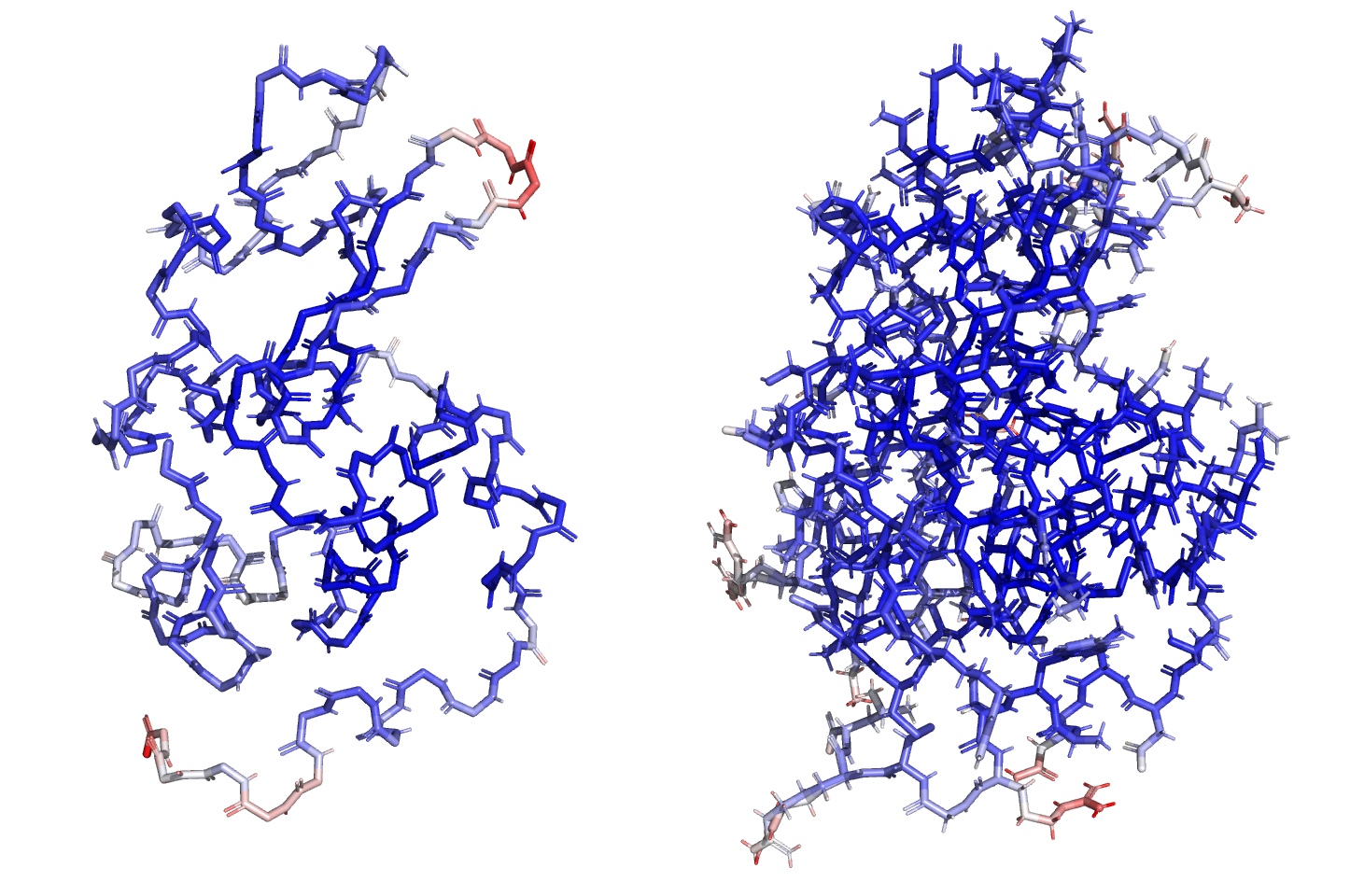
Видно, что внутренние участки конформационно стабильны, в то время как концевые участки и свободные петли имеет более высокий B-фактор, что скорее всего объясняется их высокой подвижностью. Я выбрала для анализа аминокислоту ARG-125, которая "смотрит наружу", и B-фактор по ходу её боковой цепи значительно увеличивается.
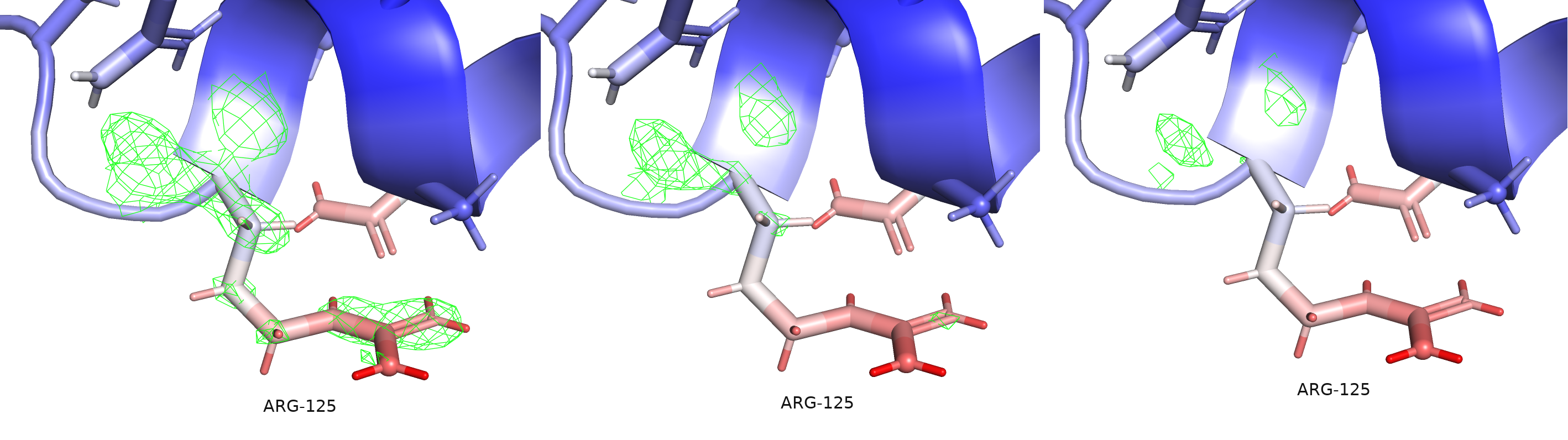
Для удобства обсуждения связи B-фактора и наблюдаемых изменений при увеличении уровня подрезки процитирую вывод своего второго практикума: "При повышении уровня подрезки постепенно исчезает отображение электронной плотности на концевых участках и в свободных петлях белка, в то время как внутренняя часть mesh практически не изменяется. Это объясняется более высокой подвижностью свободных и концевых участков в пространстве, что снижает электронную плотность (электронная плотность "размазывается" при изменении положения) и приводит к "выпадению" таких участков из отображения при увеличении уровня подрезки по сравнению с менее подвижными внутренними участками." В-фактор также может быть обусловлен подвижностью участка, и в случае рассматриваемой аминокислоты так скорее всего и есть. Однако B-фактор не учитывает индивидуальные свойства атома, такие как электроотрицательность.
Задание 3.
В задании 3 алгоритмически востанавливалась структура кристалла и рассматривались "соседи" белка по кристаллу с возможными взаимодействиями.
Pymol-сессия работы для задания 3.
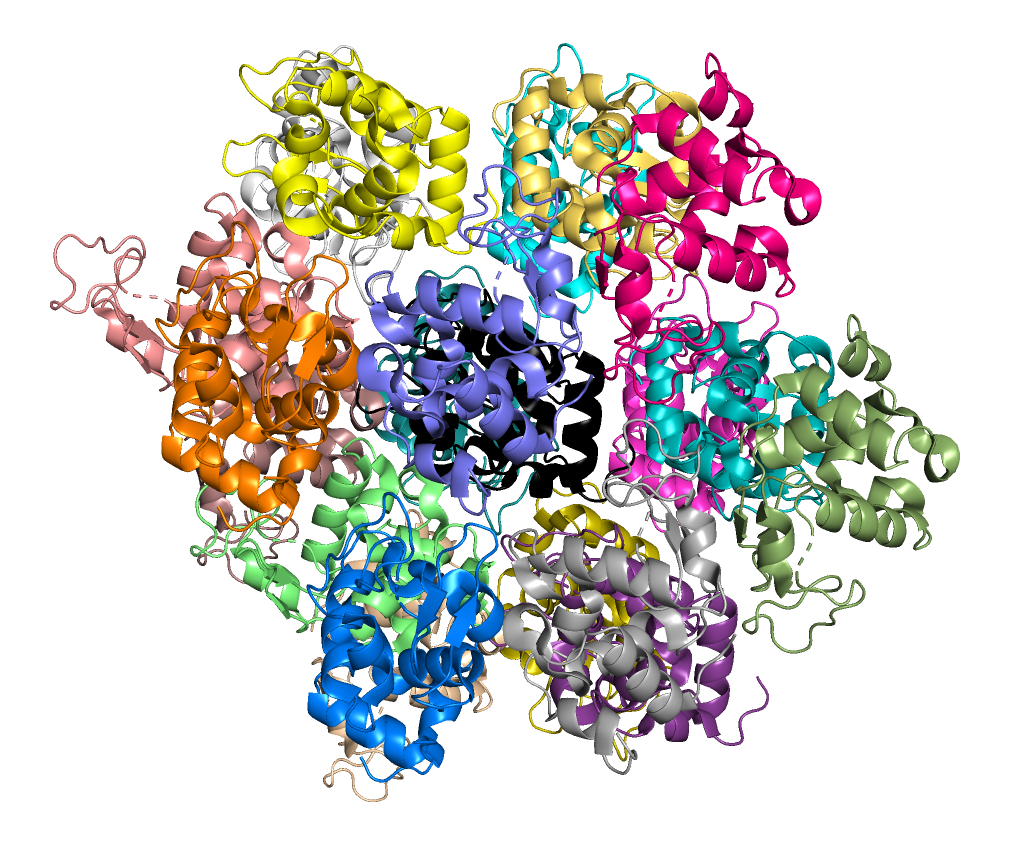
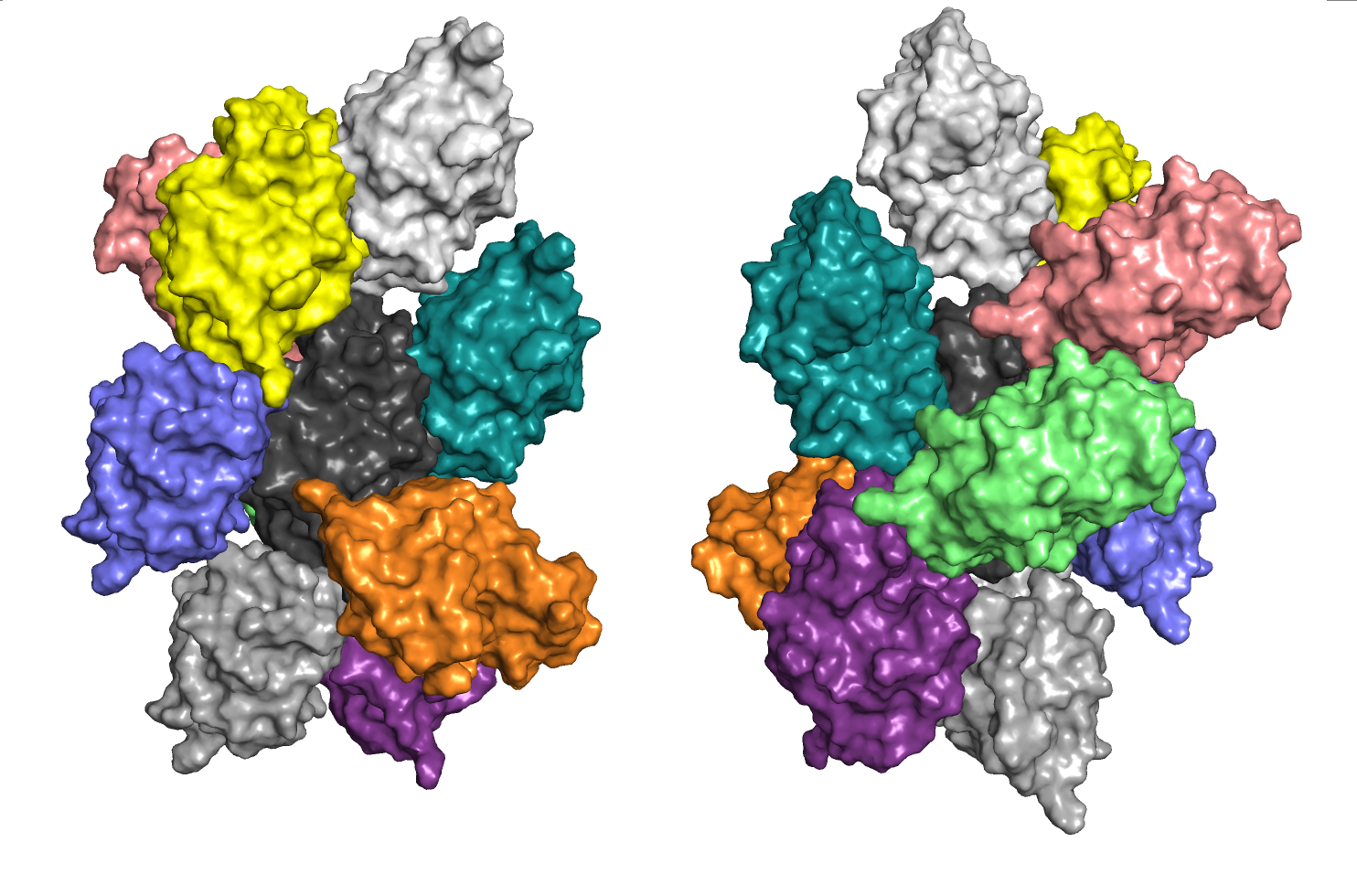
Явно видна кристаллическая структура. Любопытно, что с отдельно взятым элементом соседи взаимодействуют асимметрично, однако в целом симметрия соблюдается.