Сравнение структур, полученных ЯМР и РСА
Задание 1. Визуальное сравнение моделей
В задании 1 необходимо провести сравнение PDB-моделей 6OQH (набор из 10 построенных на основе ЯМР моделей) и 2F1C (структура, полученная РСА, с разрешением 2.3 ангстрем).
Обе модели репрезентируют расположенный на внешней бактериальной мембране грамотрицательной бактерии мономерный транспортёр OmpG из организма E. coli. В описании 6OQH упоминается, что набор из 10 моделей был отобран из 200 рассчитанных, отбор моделей для публикации проводился по минимальной свободной энергии.
При наложении (рис. 1) можно заметить, что структуры очень похожи в базовой форме "бочонка", характерного для транспортёрных белков. Сильна варьирует расположение соединительных петель. Стоит при этом заметить, что в структуре 2F1C (РСА) положение петель авторами вовсе не уточняется (петли показаны пунктиром, что означает неуверенность в их точном местонахождении в пространстве).
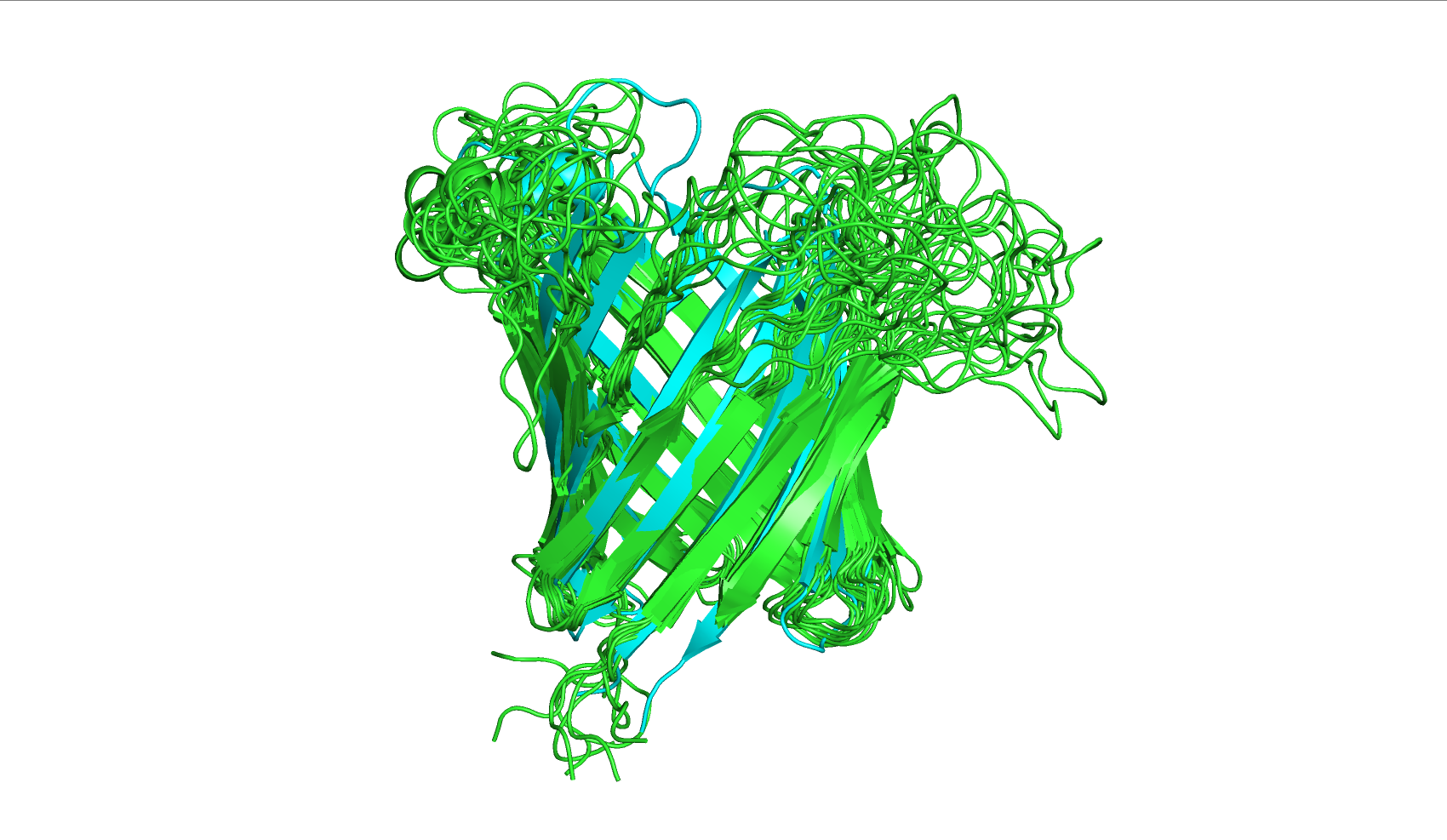
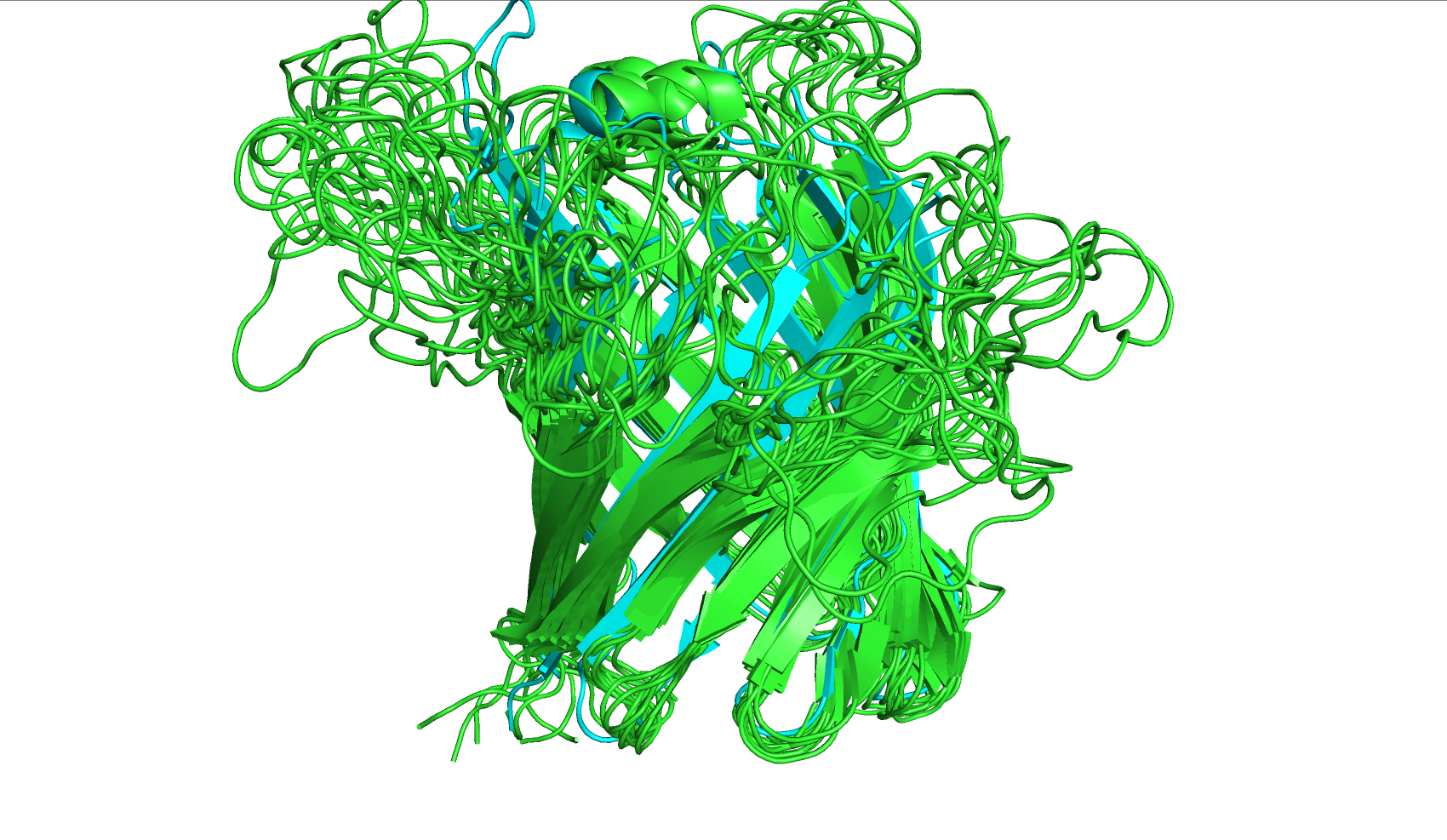
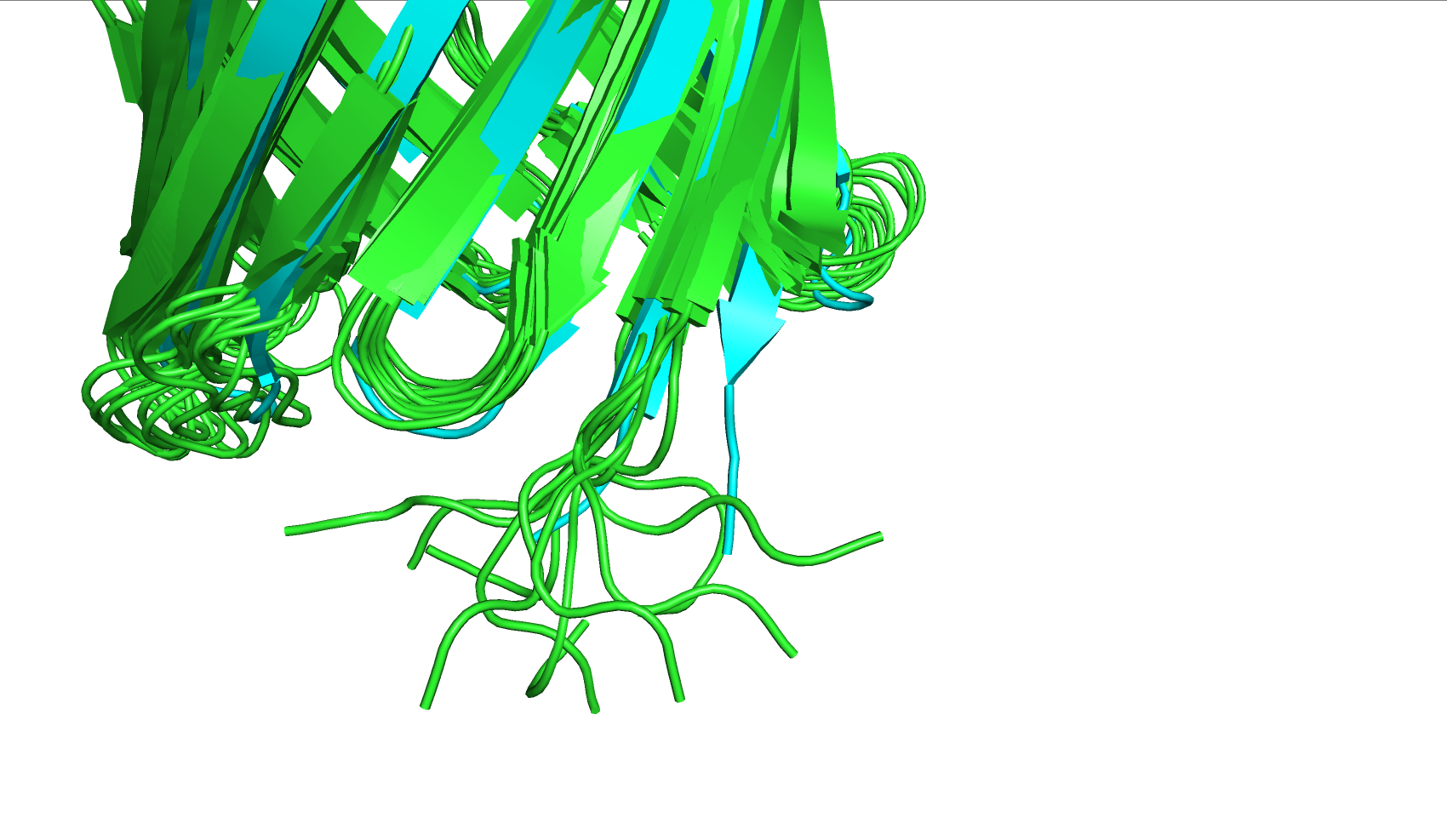
При более внимательном изучении видны дополнительные различия. Например, в нескольких местах бета-листы, размеченные как цельные на модели 2F1C (РСА), "разорваны" на два отдельных бета-листа (рис. 2), сами бета-листы укорочены или же участки, содержащие их, представлены как соединительная петля из аминкислот без вторичной структуры (рис. 3) - в структуре 6OQH половина "бочонка" представлена неоформленными аминокислотами. Исходя из биологической функции транспортёров, именно разметка центральной структуры "бочонка" имеет наибольшее значение для дальнейшего исследования белка, и то, что характерный паттерн из бета-листов, образующих канал в центре молекулы, не размечен, является существенным недостатком. Также структуры ЯМР и РСА различаются в аминокислотном составе и пространственной ориентации N-конца и C-конца (рис. 4), что может быть также связано с особенностями подготовки белковой молекулы к исследованию определённым методом. В ходе выполнения задания 2 было выявлено, что в модели 2F1C (РСА) не размечены первые три аминокислоты с N-конца, а с C-конца наоборот, отсутствует несколько аминокислот в моделях, полученных ЯМР, по сравнению с аналогом. В модели, полученной методом РСА, белок с C-конца, помимо значащих аминокислот, дополнительно имеет группу нескольких гистидинов подряд. Это говорит о том, что белок, скорее всего, выделяли с помощью гистидиновой метки.

Задание 2. RSMF
Разнообразие моделей в эксперименте ЯМР не всегда отражает подвижность участков структуры, так как оно также может быть вызвано шумом, неточностями интерпретации и неполнотой получаемых из эксперимента данных. Мерой подвижности динамических ансамблей конформаций в моделях ЯМР служит параметр RSMF.
В задании 2 для PDB-структуры 6OQH необходимо с помощью Prody вычислить средний RMSF по атомам для остатков в моделях. Аналогично предыдущему практикуму также был вычислен средний B-фактор по атомам для остатков в структуре 2F1C (РСА). Был построен scatter-plot зависимости одного от другого.
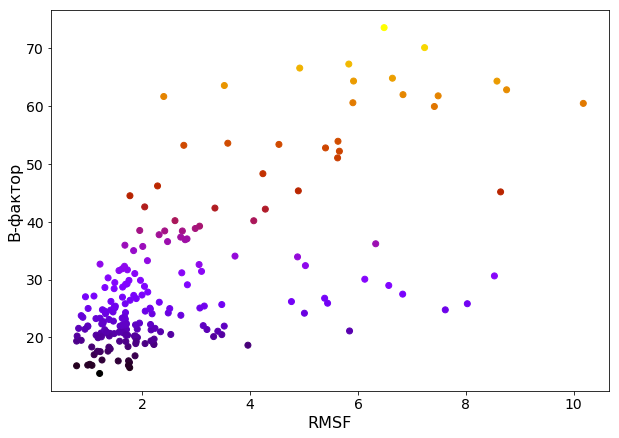
Scatter-plot не позволяет утверждать о наличии или отсутствии зависимости - есть группы остатков с высоким RSMF, но низким B-фактором и наоборот, и эти группы достаточно многочисленные по сравнению с группами, в которых низкие B-фактор и RMSF, либо оба параметра высокие.
В то время как подвижность в РСА-моделях можно в некоторой степени описать величиной B-фактора, RSMF в ЯМР-эксперименте описывает не подвижность напрямую, а разнообразие набора ЯМР-моделей. Хотя это разнообразие в части случаев является следствием подвижности элементов структуры или изменения конформации, в общем случае в условиях ЯМР-эксперимента этого утверждать нельзя, и использовать RSMF для описания подвижности без дополнительных данных тоже.
Задание 3. Водородные связи
В задании 3 в PDB-структуре 2F1C (РСА) необходимо найти три водородных связи, а затем исследовать соответствующие элементы в различных моделях ЯМР. Судя по заданию, предполагалась работа с более глобулярным белком, поскольку в выданном транспортере найти в ядре водородные связи было бы проблематично за отсутствием оформленного ядра, особенно между боковыми цепями - таковые находятся либо с наружной, либо с внутренней стороны канала и в любом случае оказываются близко к поверхности. Поскольку петли на структуре РСА выражены плохо, я внесла ещё одну правку в задание - третья водородная связь находится в "расплетённой" в моделях ЯМР области.
Используемая PyMOL команда: dist *object* and resi *resnum* and n. *atom*, *object* and resi *resnum* and n. *atom*, state=*state*
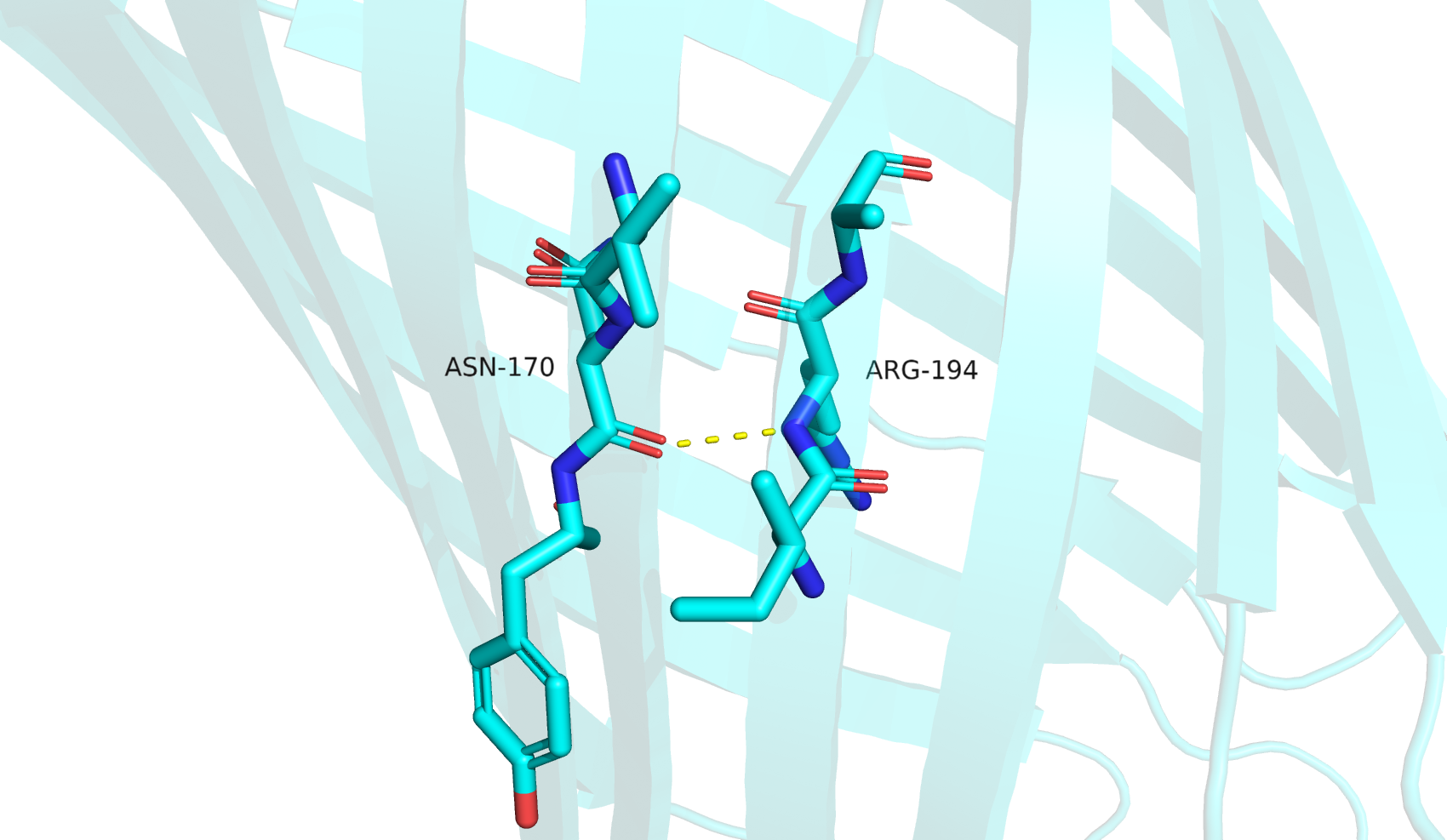
Первая водородная связь (между атомами остова бета-листа "бочонка") между остатками ASN-170 и ARG-194 сохраняется во всех структурах, находится внутри глобулы.
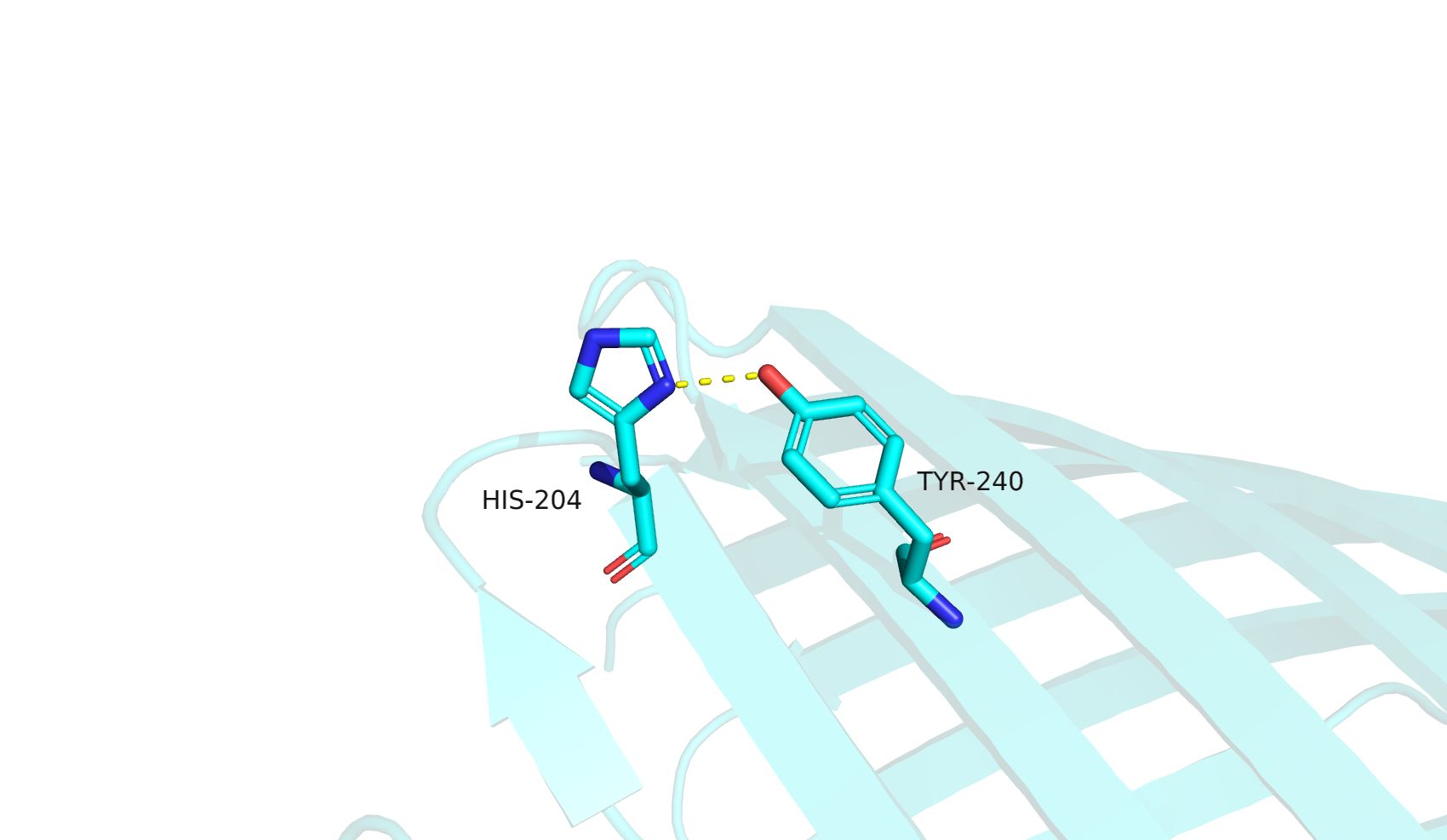
Вторая водородная связь между остатками HIS-204 и TYR-240 (между боковыми цепями двух аминокислот с наружной стороны канала, близко к поверхности) обнаружилась только в одной модели ЯМР. В ЯМР остаток TYR-240 имеет иную нумерацию, TYR-231. Кроме того, на азоте ND1 гистидина в ЯМР-моделях размечен водород. Азот ND1 в составе гистидина в физиологических условиях действительно способен к переходу в протонированную форму, однако она не является единственной. Таким образом, этот атом также является возможным участником-акцептором водородной связи в непротонированной форме гистидина. Предположу, что такое различие обусловлено разницей в условиях экспериментов и сопутствующим переходом гистидина в альтернативную форму.
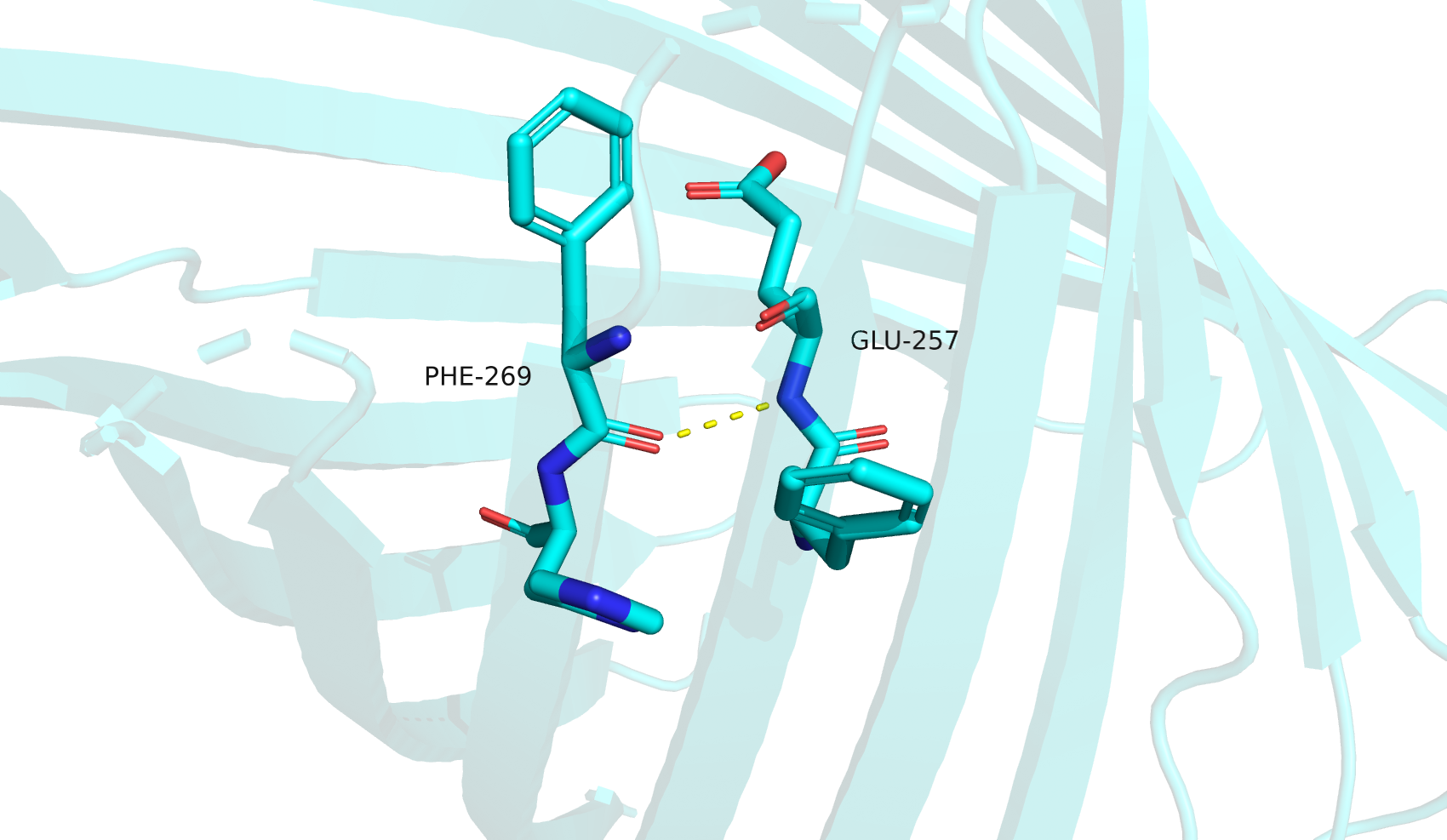
Третья водородная связь между остатками GLU-257 и PHE-269 (между атомами остова бета-листа "бочонка", близко к петле). В ЯМР остаток PHE-269 имеет иную нумерацию, PHE-260, как и GLU-257, имеющий иную нумерацию GLU-248. Эта водородная связь, как и ожидалось, не обнаруживается ни в одной модели (вторичная структура в этих моделях нарушена).
Степень сохранности вторичной структуры (бета-лист "бочонка), которая в моделях ЯМР на участке третьей водородной связи не сохраняется, зависит от стабильности водородных связей в этой области. Я изучила исходную статью [1] для этой структуры в поисках причин и выяснила следующее: во-первых, белок (в физиологических условиях находящийся в мембране как транспортер) в ЯМР-эксперименте находился в водном растворе; во-вторых, в условиях ЯМР-эксперимента могут происходить спонтанные конформационные перестройки (открытие/закрытие канала). Можно восстановить следующую логическую цепочку: подвижность ввиду нахождения в водном растворе без стабилизации мембраной и конформационные перестройки приводят к разрыву некоторых водородных связей, это дестабилизирует соседние взаимодействия и приводит к понижению вероятности образования вторичной структуры на соответствующем участке, что и наблюдается в ЯМР-модели. Кроме того, в статье уточняется, что наблюдаемые стабильные бета-тяжи были предварительно искусственно модифицированы как раз с целью снизить конформационную подвижность.