Связывание лигандов. Карманы связывания. Докинг
Задание 1. Изменения при связывании лиганда
В задании 1 для выданных моделей свободной и связанной с лигандом форм белка необходимо провести оценку изменений в белке при связывании лиганда.
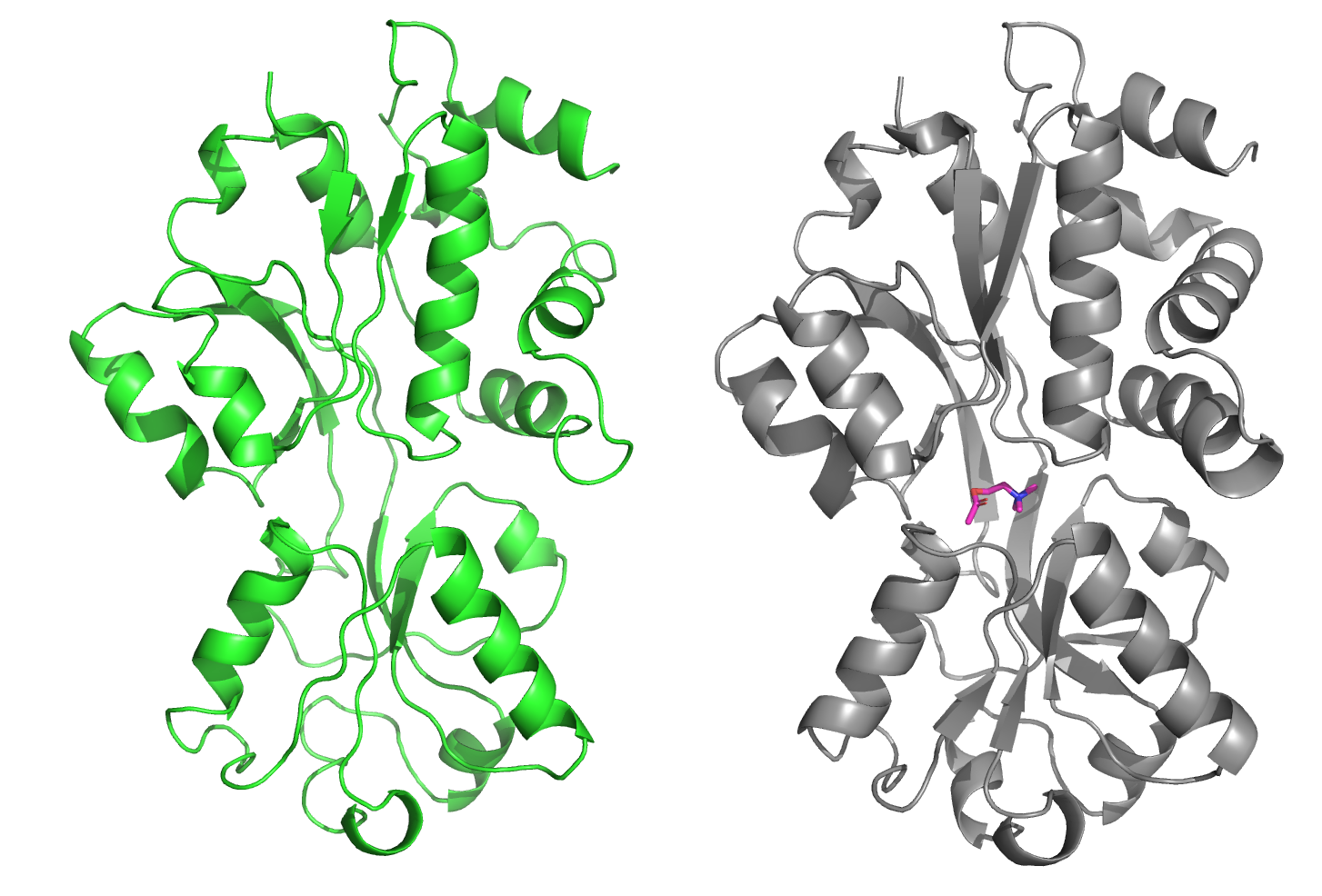
При рассмотрении белка как будто бы в целом видны значительные структурные изменения, но если присмотреться, мне кажется, что это просто различия в разметке вторичной структуры.
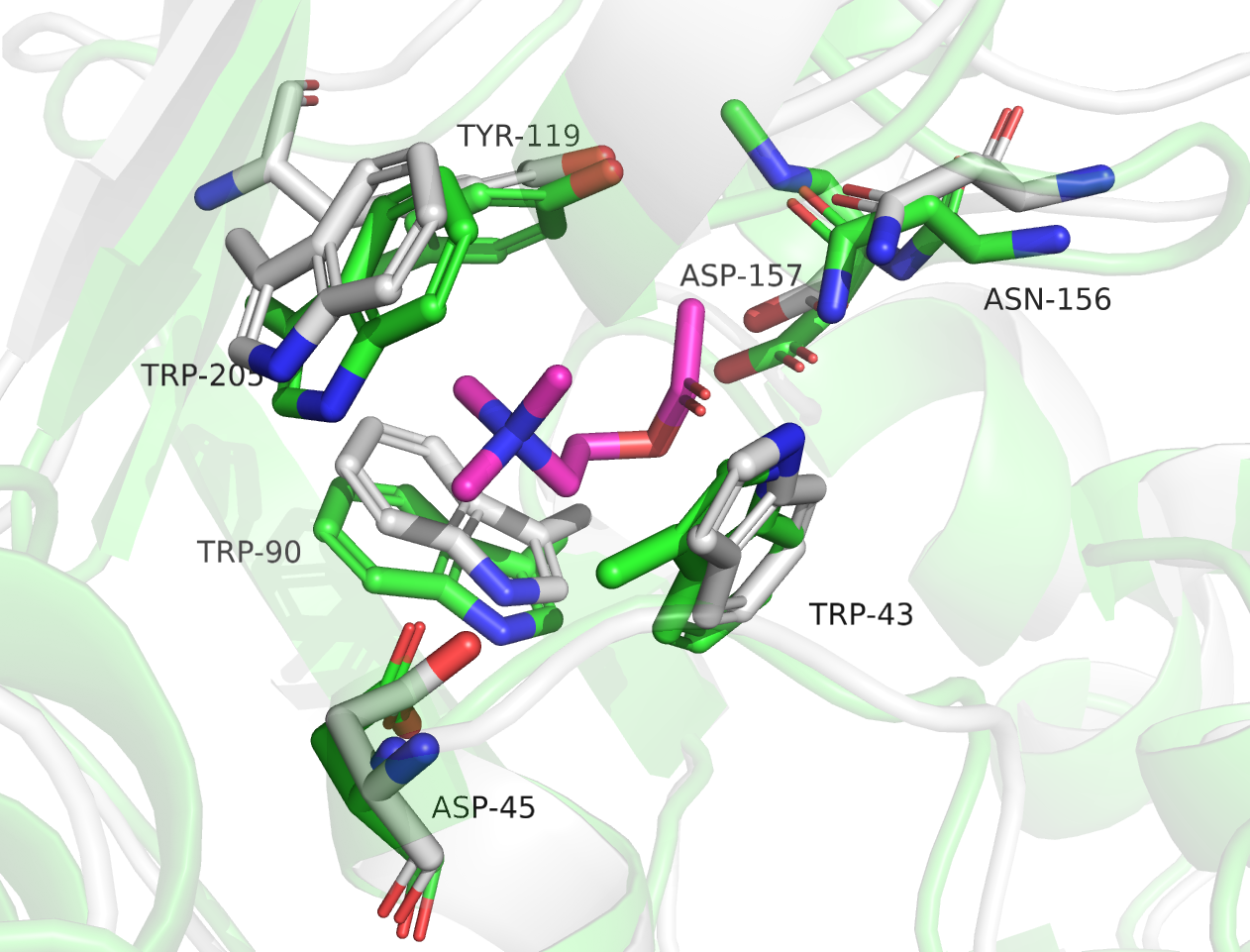
По общему виду сайта связывания можно сказать, что в составе и расположении входящих в него аминокислот ничего не изменилось. Остаток ASN-156 образует водородную связь с лигандом. Остаток ASP-45, заряженный отрицательно, образует солевой мостик с третичным амином (ацетилхолин). В качестве третьего различия я взяла образование "замка" из цепочки водородных связей между остатками THR-44, GLU-183, HIS-208.
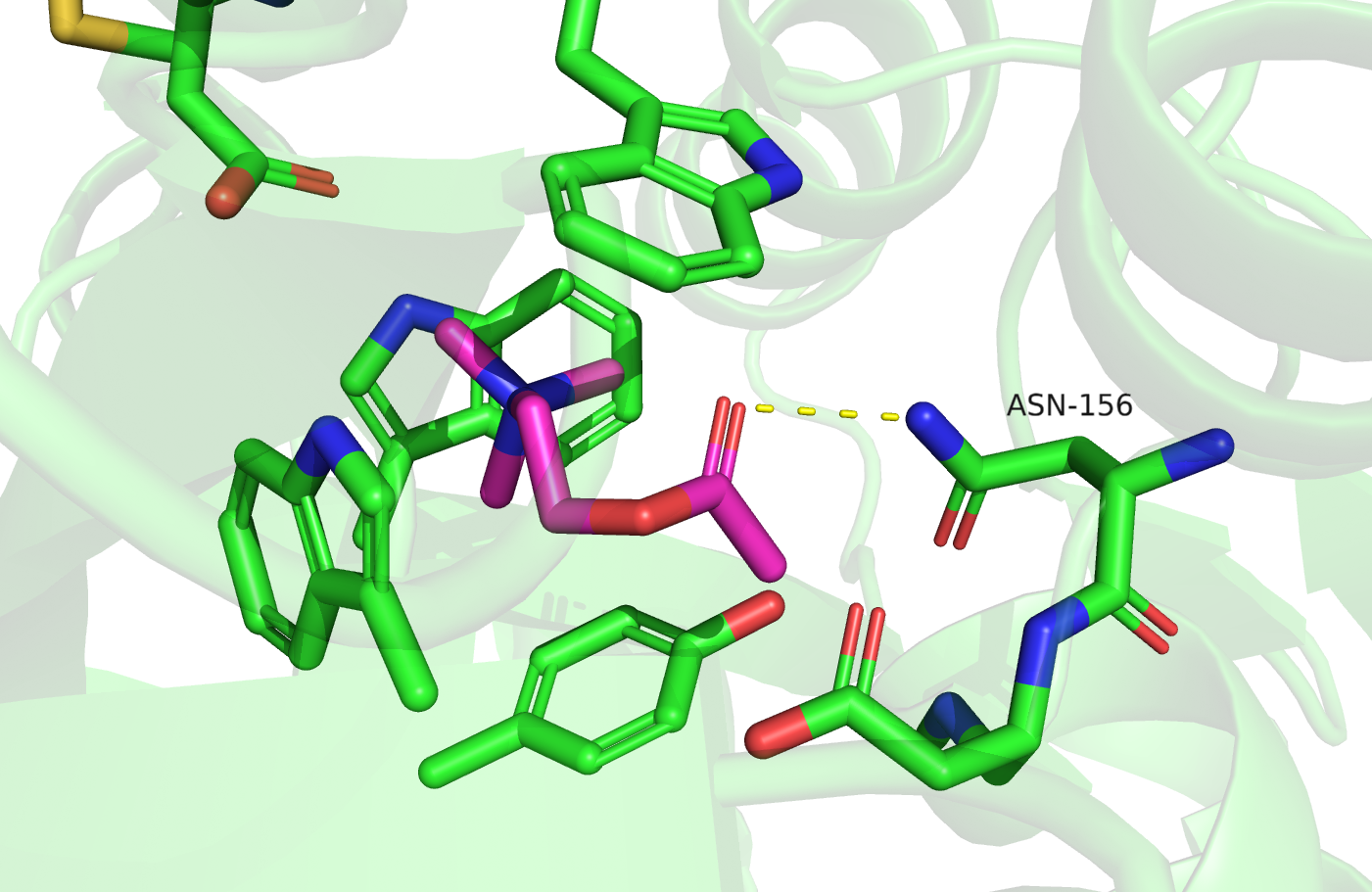
Водородная связь лиганда с остатком ASN-156. Как мне кажется, во многом именно это взаимодействие обеспечивает специфичность - сайт связывания в остальном преимущественно гидрофобный. Вокруг лиганда ароматическими аминокислотами создана гидрофобная "коробка", что ограничивает размеры и обеспечивает гидрофобный характер лиганда + пи-катионные стекинги с третичным амином (ацетилхолин), но не обеспечивает именно специфичность.
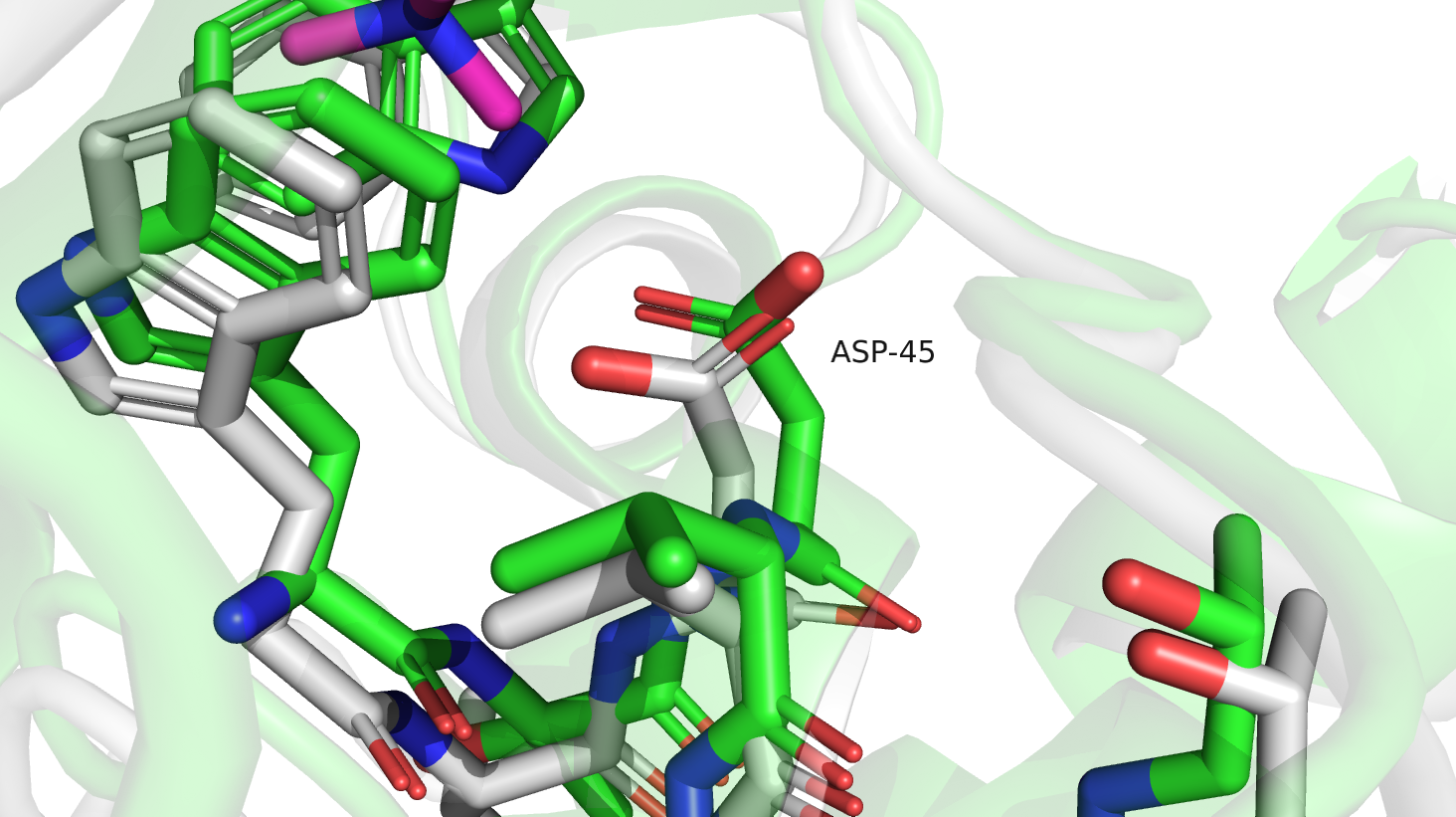
Остаток ASP-45, заряженный отрицательно, образует солевой мостик с третичным амином (ацетилхолин). Это взаимодействие обеспечивает специфичность и правильную ориентацию лиганда - если остаток будет неправильно ориентирован в гидрофобном кармане, солевой мостик образовываться не будет. Однако ASP-157, расположенный с противоположной стороны, также вызывает интерес - если бы лиганд был развёрнут наоборот, уже с ним мог бы образовываться солевой мостик, однако этого не происходит. Думаю, правильному ориентированию способствует начличие водородной связи с ASN-156.
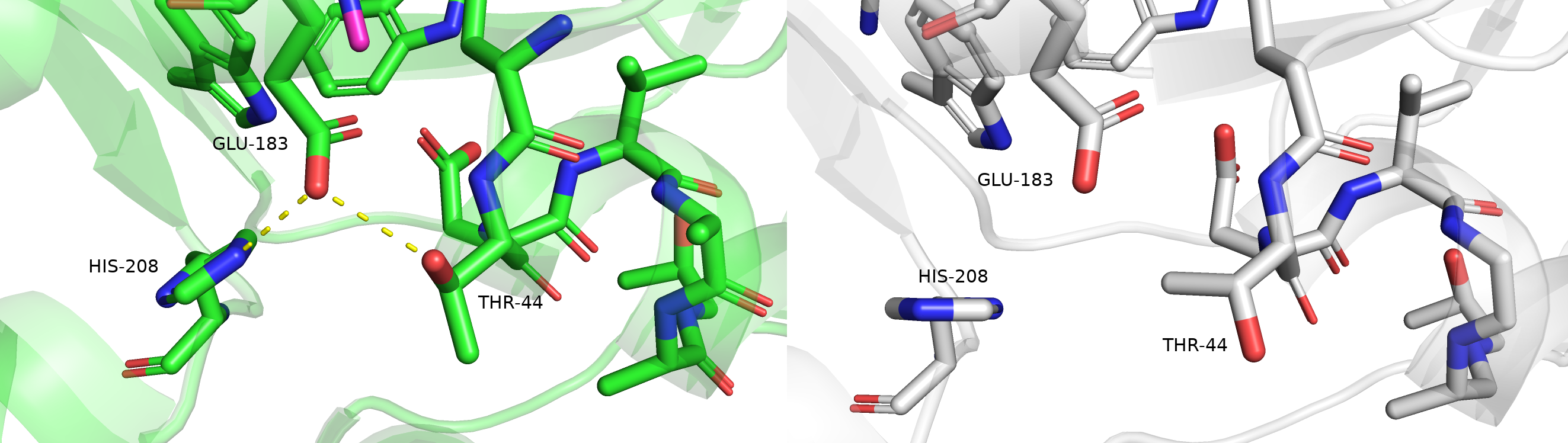
При связывании лиганда гидрофобный карман закрывается "замком" из водородных связей, образованных тремя аминокислотами: THR-44, GLU-183, HIS-208. GLU-183 является акцептором для сразу двух протонов от доноров THR-44 и HIS-208, и это взаимодействие "стягивает" три аминокислоты вместе, закрывая вход в сайт связывания, в то время как в структуре без лиганда этой особенности нет.
Задание 1а. POCASA
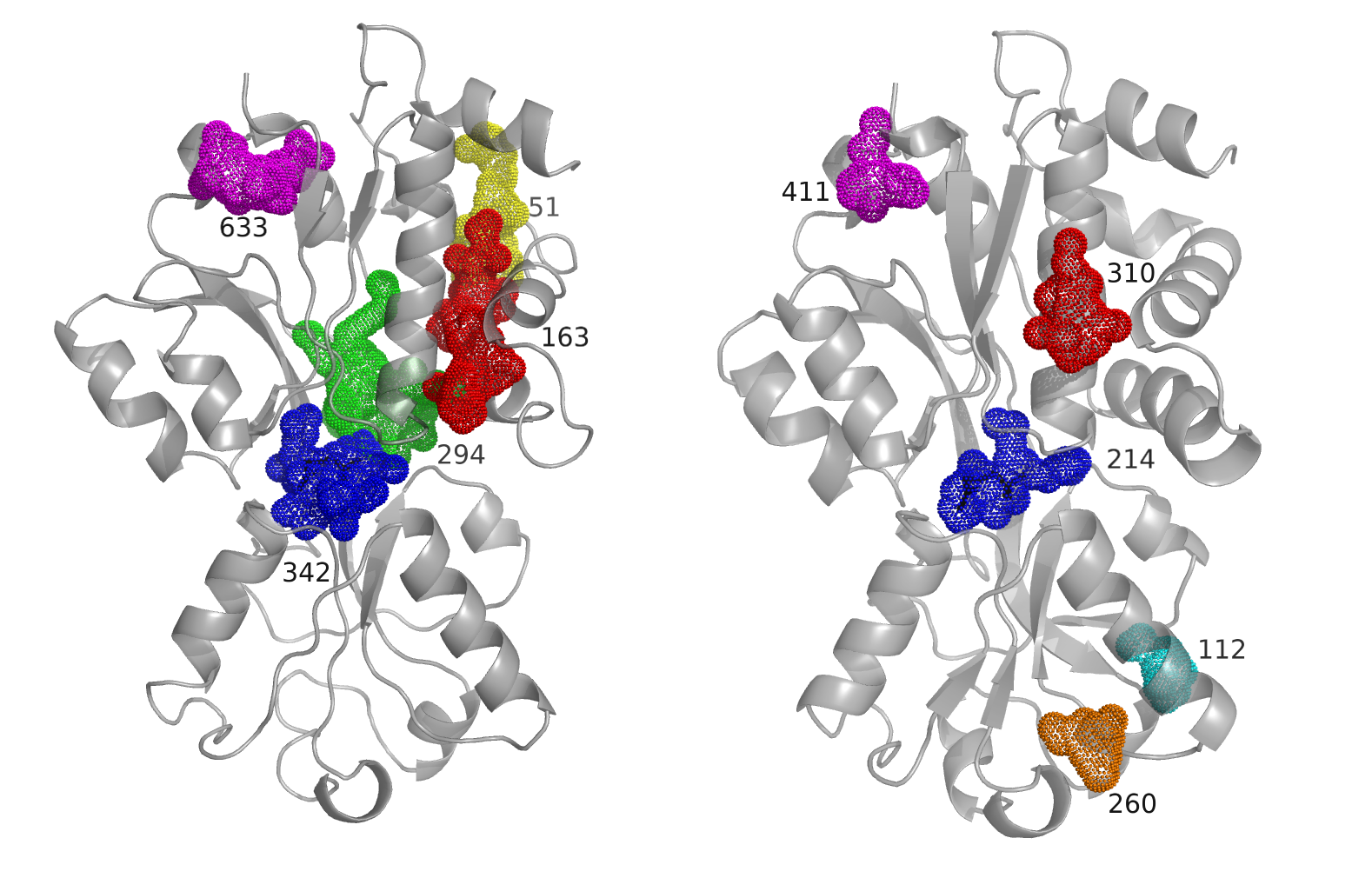
Для правильного нахождения карманов я модифицировала параметр Probe radius (моё значение 1, дефолтное 2). В свободной форме сервис POCASA нашёл все заданных 5 карманов, в связанной 4 кармана и одну полость. Объём кармана или полости, содержащих лиганд, в свободной форме 106 (карман 342), в связанной форме 43 (полость 214). Объём полости по сравнению с карманом значительно уменьшился! Можно сделать вывод, что видимые на общем плане структурные перестройки действительно имели место хотя бы частично.
Задание 2. Протонирование
В задании 2 было проведено добавление протонов: в структуру белка с помощью веб-сервиса PDB2PQR, в молекулу лиганда программой SPORES на kodomo.
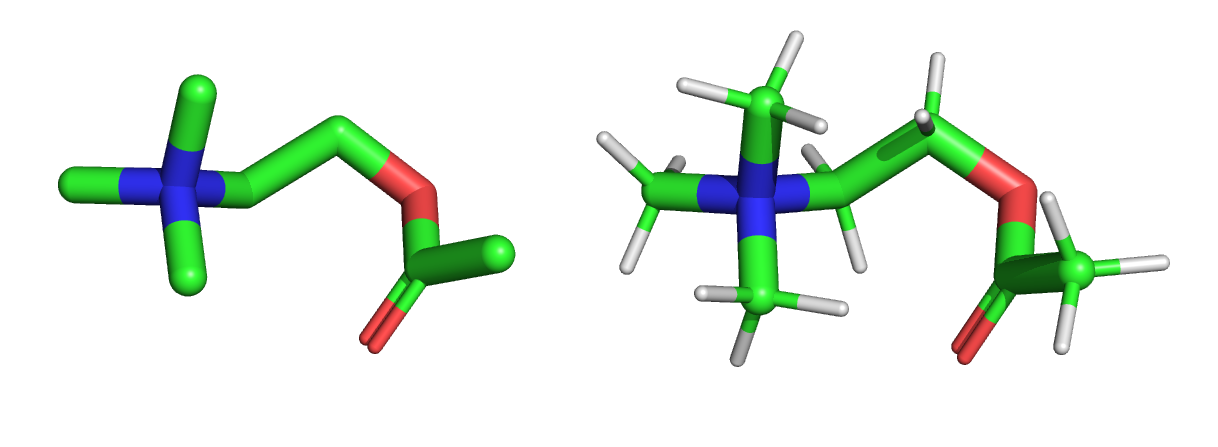
Добавление протонов в лиганд прошло успешно, никаких неоднозначностей или артефактов нет.
Задание 3. Докинг.
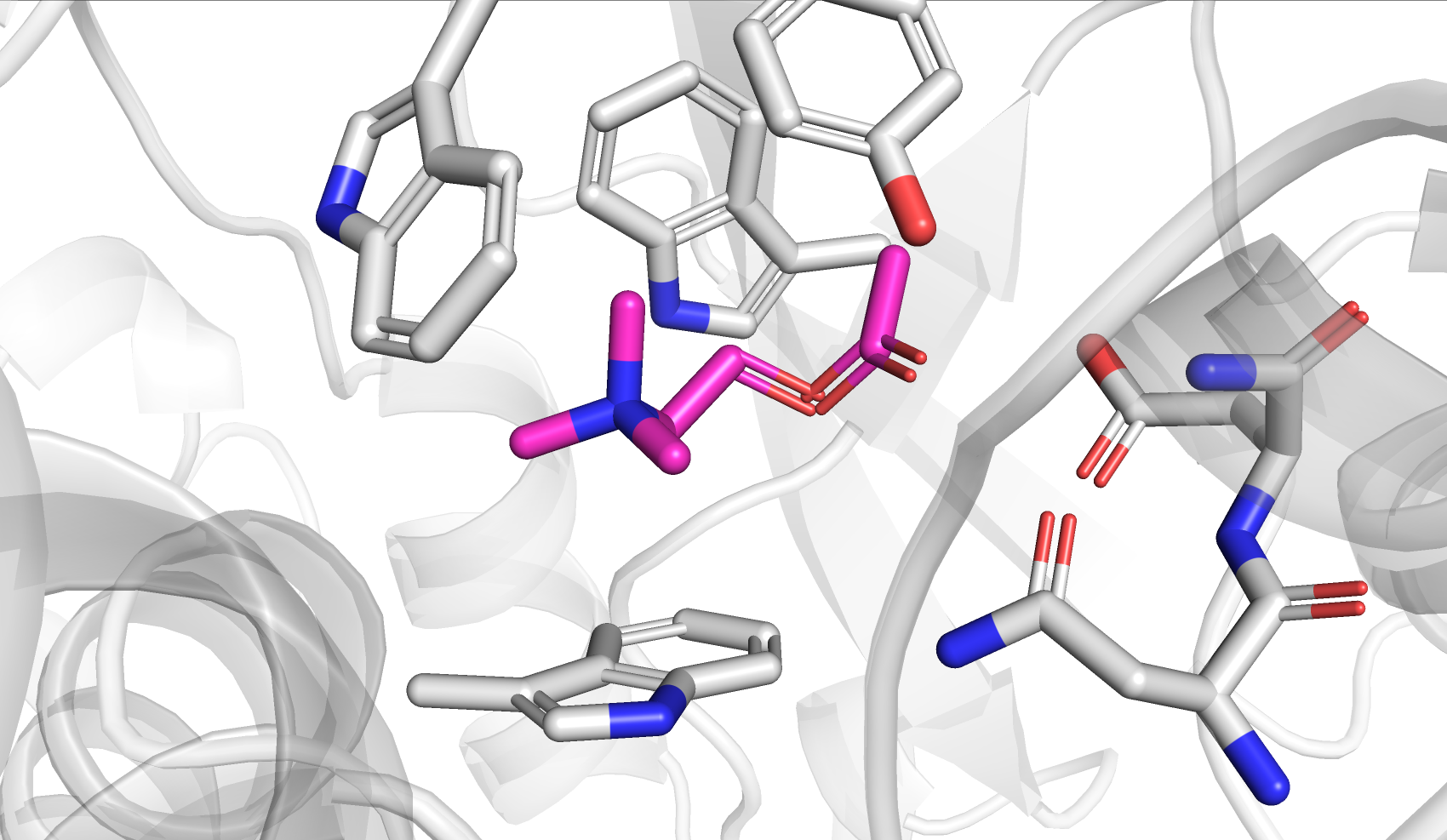
Лучшая поза из выдачи докинга похожа на наблюдаемый лиганд из связанной формы белка по положению, но не точно повторяет его. Взаимодействия анализировались для результата докинга в свободную форму со свободной формой из free.pdb и для лиганда в истинной позе из bound.pdb со связанной формой из bound.pdb.
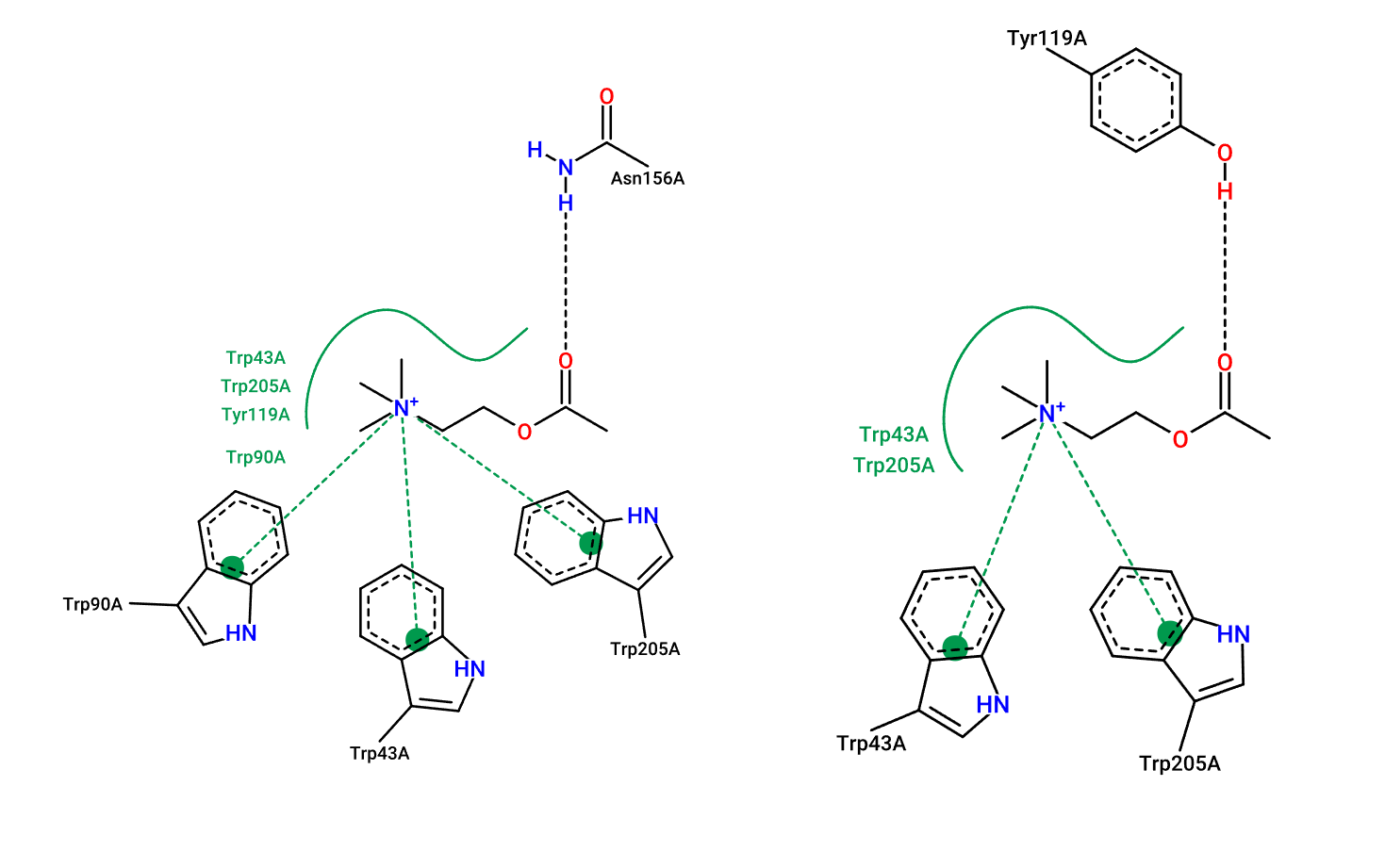
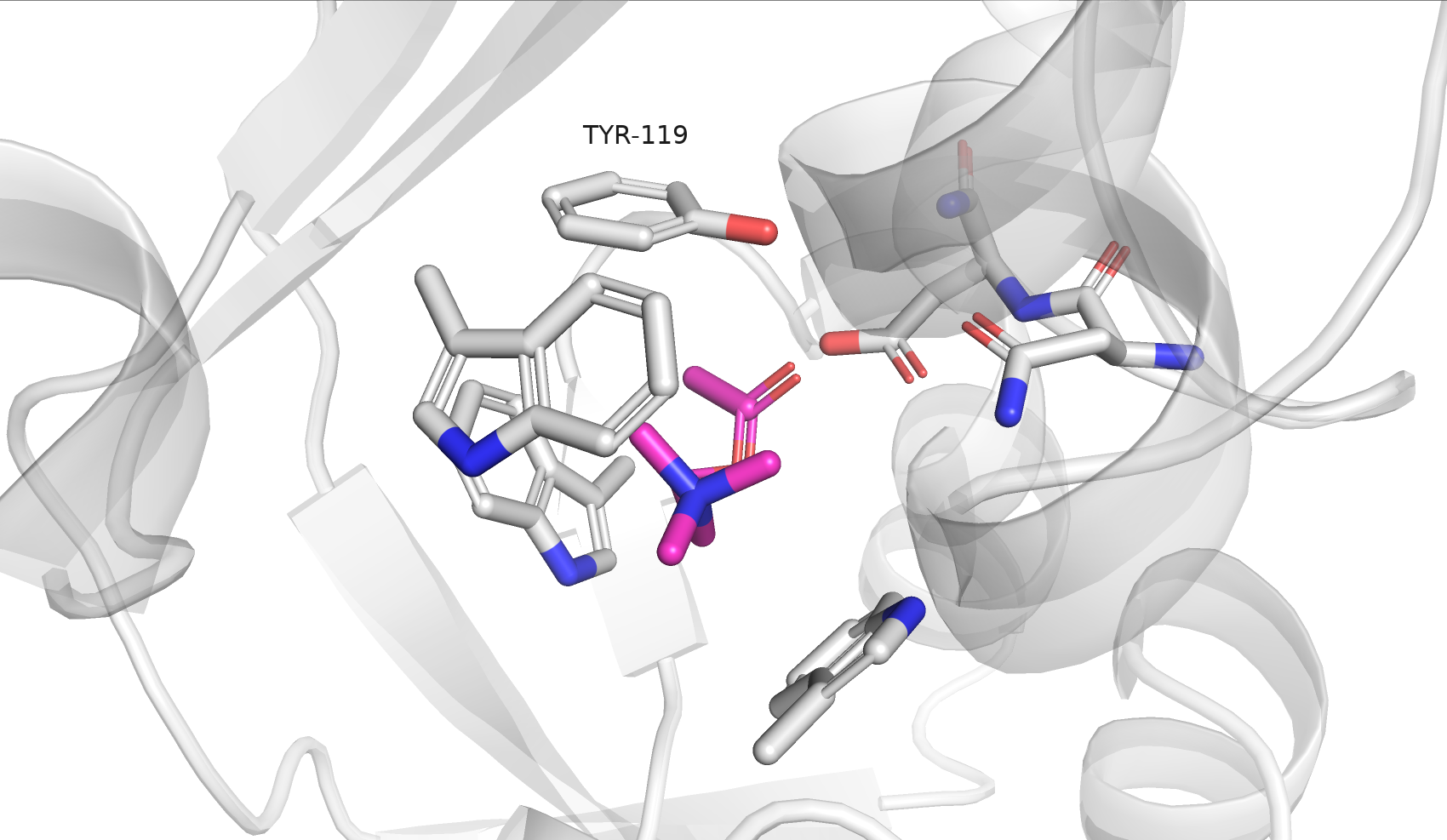
PoseView показывает гидрофобное взаимодействие и водородную связь ASN-156 с лигандом для связанной формы. Солевой мостик с ASP-45 он не обнаруживает. Для результата докинга он также выдаёт гидрофобное взаимодействие и водородную связь с TYR-119. На самом деле этой водородной связи не будет, так как водород гидроксильной группы при такой водородной связи находился бы не в плоскости кольца тирозина, что невозможно. Также "потерялось" одно гидрофобное взаимодействие при анализе PoseView, но визуально в структуре наблюдается всё тот же гидрофобный карман.
Проанализировав всё описанное, я могу предположить, что связывание ацетилхолина происходит за счёт гидрофобного взаимодействия с соответствующим карманом ароматических аминокислот с обеспечивающей правильную ориентацию и специфичность водородной связью. Важно заметить, что в свободной форме белок имеет в области лиганда гидрофобный карман, который в связанной форме является полостью, то есть карман "закрывается" при связывании лиганда. Скорее всего, необходимостью такого "закрытия кармана" и объясняются наблюдаемые структурные перестройки. Среди полученных докингом вариантов практически все (8 из 10) находились в гидрофобном кармане, но некоторые были развернуты. Как мне кажется, только при правильной ориентации лиганда при входе в карман (обеспечиваемой солевым мостиком с ASP-45) продолжается работа с лигандом, и в процессе дальнейшей ориентации и, возможно, каталитической активности, новое положение стабилизируется уже связью с ASN-156. Я не думаю, что здесь имеет место механизм Induced Fit, поскольку конформация сайта связывания и поза лиганда очень похожи как в свободной, так и в связанной форме, но точно имеют место конформационные перестройки при связывании лиганда (закрытие гидрофобного кармана "замком" как минимум).