Атлас контактов
Введение
1. Общая характеристика белка
В данной таблице представлены основные сведения об изучаемом белке.
Таблица 1. Общая характеристика и некоторые физико - химические свойства белка Lipase B
| Характеристика | Результат |
|---|---|
| Название | Lipase B |
| Uniprot ID | P41365 [1] |
| PDB ID | 1LBS [2] |
| Substance SID с PubChem | 318693618 [3] |
| Организм, из которого был получен белок | дрожжи Candida Antarctica |
| Название по IUPAC | triacylglycerol hydrolase (E.C.3.1.1.3) |
| Брутто – формула белка | C1902H1722N1902O1994S36P6 |
| Количество а.о. | 317 |
| Молярная масса | 33 кДа |
| Изоэлектрическая точка (pI) | 6,0 |
2. Описание и функциональная роль белка
Липаза B - это глобулярный белок, полученный из дрожжей Candida Antarctica (поэтому в сокращении иногда пишут CALB), в котором есть как альфа - спирали, так и бета - слои, он состоит из 317 аминокислотных остатков. В целом, третичная структура данного фермента похожа на другие липазы.[4]
Липаза B катализирует реакцию: triacylglycerol + H2O = diacylglycerol + a - carboxylate [5], в основном действует на границе раздела фаз (липид/вода). Кроме того, CALB участвует в синтезе сложных эфиров. Данный фермент проявляет хорошее сродство к субстрату даже при очень высоких температурах. [4]
В активном центре у липазы имеется характерная для подобных ферментов каталитическая триада из Ser105, Asp187 и His224, которые расположены на C - конце бета - листа. В активный центр можно попасть через узкий канал, образованный альфа - спиралями, стенки данного канала гидрофобны, поскольку там присутствует большое количество алифатических аминокислотных остатков. Также имеется так называемая крышка, которая дополнительно контролирует проход к активному сайту (предположительно, образована короткой альфа - спиралью). [4]
Рядом с Ser105 находится много полярных аминокислотных остатков (Thr40, Asp134 и Gln157, а также уже названный His224). Треонин, аспартат и глутамат образуют целую сеть водородных связей, доступную для растворителя. Это всё налагает ограничение на то, как молекулы, поступающие в активный центр, могут быть там ориентированы. [4] Серин - нуклеофильный остаток, который активируется только при наличии водородных связей между гистидином и аспартатом. Гистидин проявляет себя как более мощное основание, активируя нуклеофил серина. Основное участие в работе липазы как фермента принимает именно серин, поскольку при полимеризации сложных эфиров группа –CH 2 OH аминокислоты взаимодействует с карбонильным углеродом лактонового мономера, что приводит к образованию промежуточного ацил-фермента. [3]
Липаза B представляет особый интерес, поскольку она крайне стереоспецифична при своей работе по отношению к хиральным центрам субстрата. [4]
3. Описание низкомолекулярных лигандов в составе комплекса
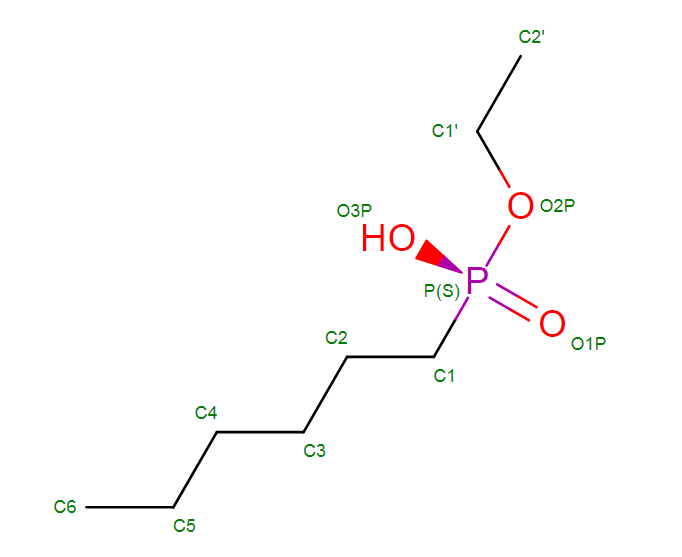
N-Hexylphosphonate ethyl ester (HEE)
Таблица 2. Общая характеристика лиганда HEE
| Характеристика | Результат |
|---|---|
| Название по IUPAC | ethoxy(hexyl)phosphinic acid [7] |
| Химическая формула | CCCCCCP(=O)(O)OCC |
| Брутто – формула | C8H19O3P [2] |
| Молярная масса | 194.21g/mol |
| Ссылка на идентификатор в базе данных | PubChem CID 446896 |
Функции лиганда:
HEE является сложным эфиром фосфоновой кислоты. Имеет угеводородную часть - n-гексил, расположенный в области выходящей жирной кислоты.
Также стоит отметить, что данный лиганд пришит ковалентно к одному из остатков каталитической триады, что, очевидно, мешает нормальному функционированию этого центра. Это лишний раз подтверждает тот факт, что лиганд является ингибитором[6]. Стоит ещё кое - что отметить: данный лиганд достаточно распространен в природе, этому свидетельствует его наличие как минимум в 4 белковых структурах, которые загружены в базу данных PDB. Таким образом, легко можно заметить, что данный лиганд является естественным ингибитором, который участвует в контроле активности липазы в живых организмах.
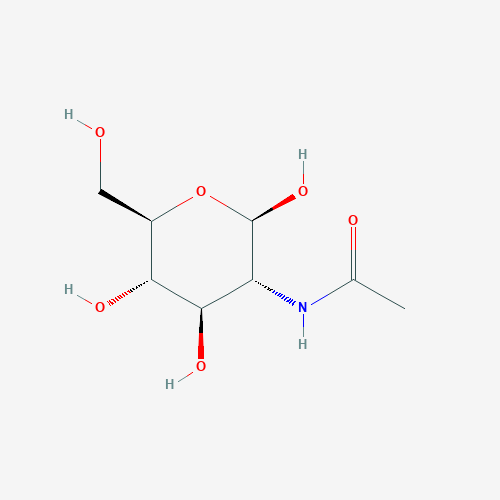
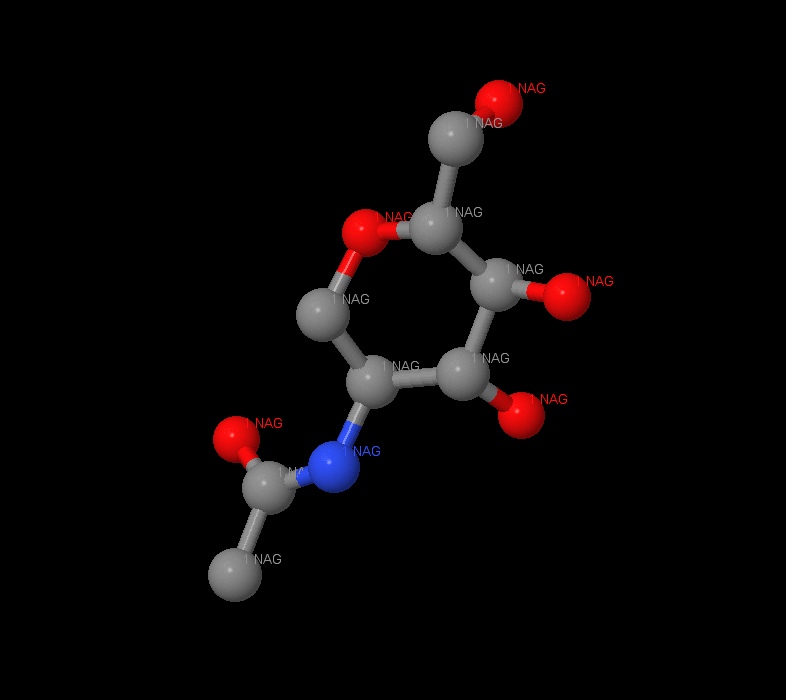
β-D-(Acetylamino)-2-deoxy-glucopyranose (NAG)
Таблица 3. Общая характеристика лиганда NAG
| Характеристика | Результат |
|---|---|
| Название по IUPAC | N-[(2R,3R,4R,5S,6R)-6-(hydroxymethyl)-2,4,5-tris(oxidanyl)oxan-3-yl]ethanamide [8] |
| Химическая формула | CC(=O)NC1C(C(C(OC1O)CO)O)O |
| Брутто – формула | C8H15NO6 |
| Молярная масса | 221.21 g/mol |
| Ссылка на идентификатор в базе данных | PubChem CID 24139 |
Функции лиганда:
N-Ацетилглюкозамин (сокр. NAG) — органическое соединение, N-ацетил производное аминосахара глюкозамина (ацетамид глюкозы), является основным компонентом множества биополимеров.[9] NAG - один из обязательных компонентов гликолизирования белка, происходящего в цисс-зоне аппарата Гольджи или в ER [9].
Модификация белков O-GlcNAc является важным механизмом регуляции многочисленных биологических процессов, критичных для нормальной функции клеток, таких как сигнальная трансдукция, активность протеосом, апоптоз, ядерный транспорт, трансляция и транскрипция. O-GlcNAcylation модифицирует те же остатки Ser/Thr, какие модифицируются и при фосфорилировании. Ряд исследований показал, что O-GlcNAc необходим для жизнеспособности клеток и что активация путей, приводящая к повышению уровня белка O-GlcNAc, улучшает толерантность клеток к широкому спектру стрессовых стимулов. [10]
Апплет с белок - белковыми и некоторыми лиганд - биомолекулярными контактами
Информация о белок – белковых контактах
1. Основные
Водородные связи – это форма внутримолекулярного или межмолекулярного взаимодействия, при котором атом водорода, связанный с одним электроотрицательным атомом, вступает в ковалентную связь с другим электроотрицательным атомом (N, O, F) [11]. Водородные связи делают вторичную структуру белка (альфа - спирали и бета - слои) прочной.
- альфа - спираль
Мы нашли альфа - спираль из 224-230 аминокислотных остатков, при помощи команд calculate hbond и hbonds on нашли водородные связи и измерили длину некоторых из них.

На рисунке 6 показаны водородные связи в альфа - спирали 224-230:A. В таблице представлены их длины.
Таблица 4. Длины водородных связей в альфа - спирали
|
Атомы |
Длина связи, А |
|
O(225ALA) - N(229THR) |
2.86 |
|
O(225ALA) - N(228LEU) |
3.09 |
|
O(224HIS) - N(228LEU) |
3.85 |
|
O(224HIS) - N(227SER) |
3.15 |
|
O(226GLY) - N(230SER) |
3.36 |
Средняя длина водородных связей в альфа - спирали составляет 3.262 ангстрема, что соответствует литературным данным. [12] Говорится, что стандартная длина водородных связей составляет около 2.7-3.0 ангстрем.
- бета - лист
Аналогичным образом, что и в альфа - спирали, мы выделили атомы аминокислот и отметили их номера. Далее предварительно, чтобы выбрать нужные атомы, мы скрыли все атомы командой Далее покрасили атомы, выделили связи внутри молекул, отредактировали их размер и выделили водородные связи следующими командами соответственно:
Для наглядности направления цепей в бета - листе используем команду Интересно заметить, что бета - листы состоят из параллельных цепей, а длина между одинаковыми парами аминокислот в каждых листах одинакова.
Далее были произведены измерения длин водородных связей и представлены в таблице :
Таблица 5. Длины водородных связей в бета - листе Атомы Длина связи, А O(VAL210) - N(TYR183) 2.78 O(ASN181) - N(VAL210) 2.65 O(LYS208) - N(ASN181) 2.85 O(THR179) - N(LYS208) 2.88 Средняя длина 2.79 Средняя длина водородных связей в бета - листе составляет 2.79 ангстрем, что также входит в диапазон нормы (2.7-3.0 А). [12]
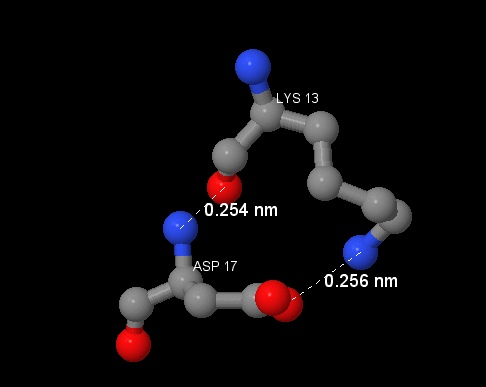
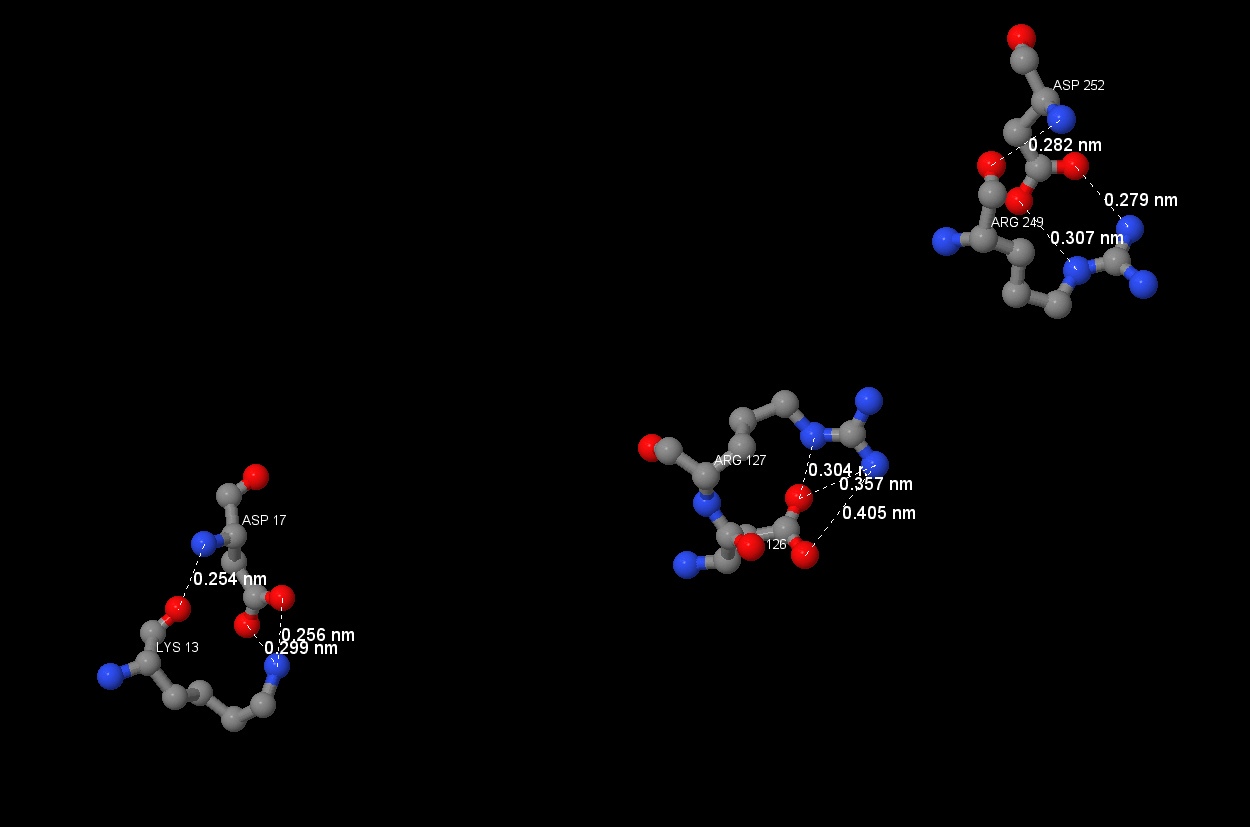
Солевые мостики образуются за счёт ионных и водородных взаимодействий. Они могут возникать между отрицательно заряженными и положительно заряженными аминокислотами, т.е. между аспарагиновой или глутаминовой кислотами и аргинином, лизином или гистидином. Обычно ионные связи образуются на расстоянии не более 4 ангстрем[13]. Солевой мостик участвует в стабилизации белка в свёрнутом состоянии.
В нашей работе на солевые мостики похожи взаимодействия между лизином и аспарагином, аргинином и аспарагином (рисунки 10 и 11). При помощи команды Одним из видов ковалентной связи являются дисульфидные мостики между двумя молекулами цистеина. Они укрепляют третичную структуру белка. Обычно дисульфидные связи имеют длину около 2.5A, а в базе данных PDB рассматривают также длину 3A [14].
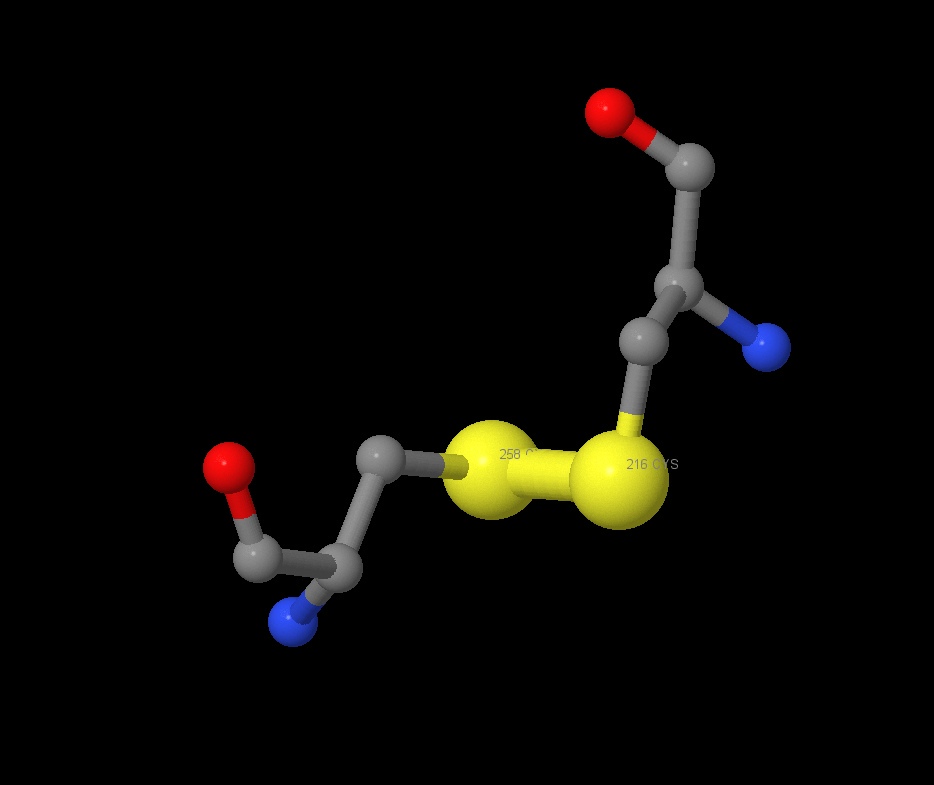
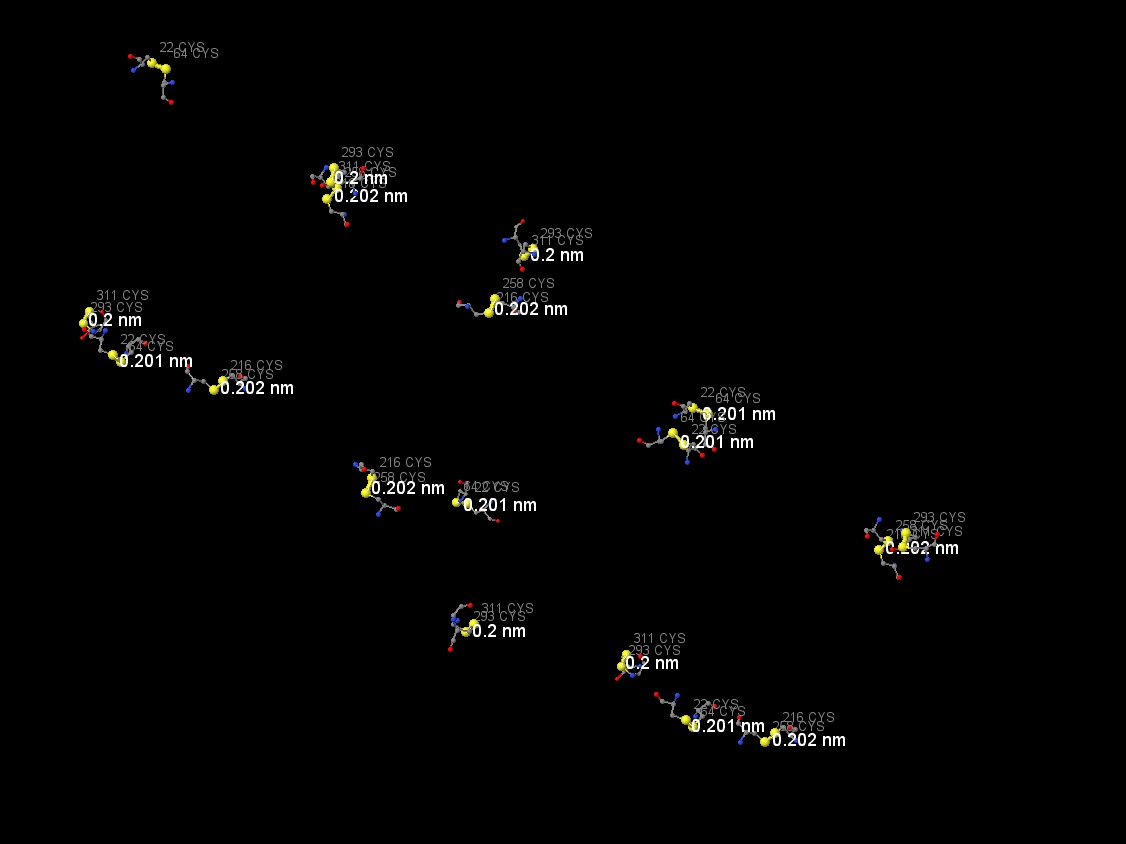
При помощи команды Таблица 6. Длины дисульфидных связей Атомы аминокислот Длина, А [CYS]258 - [CYS]216 2.02 [CYS]22 - [CYS]64 2.01 [CYS]293 - [CYS]311 2.00 Как можно заметить, длина дисульфидных связей в нашем белке очень стабильна и составляет в среднем 2.01A, что не превышает среднюю длину дисульфидных связей, указанную в литературных источниках.
Гидрофобное ядро образуется между неполярными радикалами в водной среде. Оно также способствует формированию третичной структуры белка. Большая часть глобулярных белков имеет гидрофобное ядро. [13]
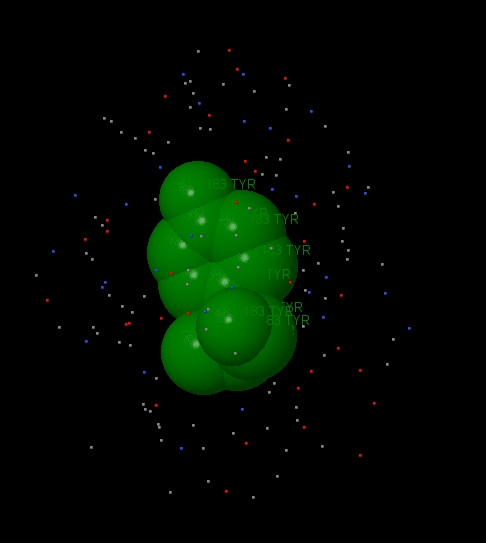
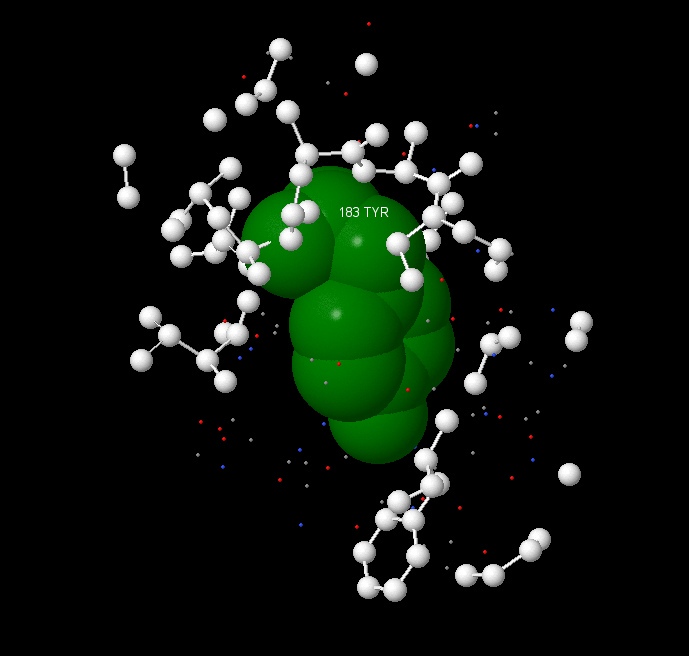
В нашей работе при поиске и исследовании гидрофобного ядра нами был выбран 183 тирозин, где наблюдалось большое количество гидрофобных аминокислот в ближайшем окружении. (рисунок 14) При помощи команды Проанализируем плотность упаковки гидрофобного окружения. На первом рисунке мы видим молекулу тирозина и гидрофобное окружение в радиусе 7А.
Из следующих рисунков видно, что уже на расстоянии 5 ангстрем атомы аминокислотных остатков достаточно плотно покрывают поверхность тирозина так, что атомов аминокислоты практически не видно.
Затем мы исследовали расстояние между соседними не связанными ковалентно атомами в белке. Данные представлены в таблице.
Таблица 7. Расстояние между не связанными ковалентно атомами
Аминокислота 1 Аминокислота 2 Длина связи, А C (TYR183) O (VAL210) 3.59 C (TYR183) N (VAL210) 4.32 C (TYR183) C (ASN209) 4.17 OH (TYR183) C (ASN209) 4.5 N (ALA212) O (TYR183) 2.65 C (SER202) C (TYR183) 3.5 C (ASP200) OH (TYR183) 3.57 0 (ASP200) OH (TYR183) 2.65 C (TYR183) C (GLN211) 3.97 C (TYR183) O (LEU182) 2.71 N (TYR183) C (LEU182) 1.33 C (TYR183) O (GLN193) 3.79 Таким образом, средняя длина составляет примерно 3.4A.
Для того чтобы понять, поместится ли между соседними атомами ещё один (например, атом кислорода в молекуле воды), проведём некоторые расчёты. Самое большое найденное расстояние - 4,5A. Это расстояние между кислородом и углеродом. Радиус кислорода составляет по литературным данным 1.4 ангстрема, углерода - 1.85 ангстрема [15]. Если вычесть радиусы из расстояние между атомами, то получится 1.25A. К сожалению, это меньше диаметра даже самого маленького атома, поэтому можно сказать, что никакой атом в промежутках между соседними в нашей молекуле не поместится.
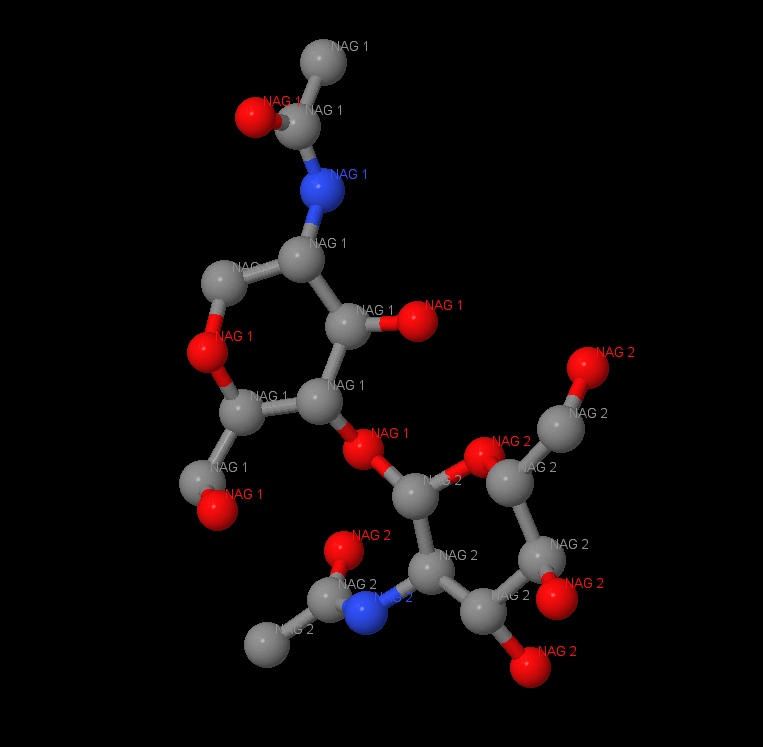
Всего было найдено два лиганда: N-hexylphosphonate ethyl ester (HEE) и β-D-(Acetylamino)-2-deoxy-glucopyranose (NAG). Все лиганды показаны на рисунке. Всего в липазе 6 лигандов HEE и 6 лигандов NAG одинакового строения в 6 цепях (A, B, C, D, E, F). Между этими молекулами связей найдено не было.
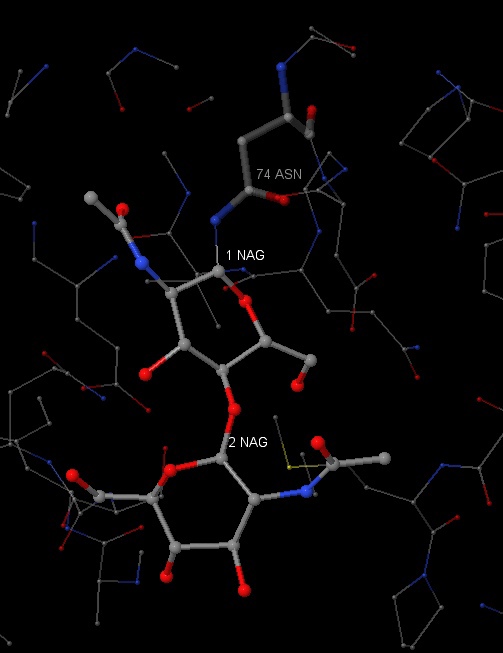
На рисунках представлены все NAG - димеры (рисунок 19) и один из этих димеров (рисунок 20).
NAG - это производное сахара глюкозамина N - ацетилглюкозамин. 1NAG соединён с 2NAG при помощи атома кислорода. Наблюдается ковалентная связь с ASN74, длина которой равна 2.7A. Также можно заметить ковалентные связи с GLN11, которая является полярной аминокислотой.
На данном рисунке можно наблюдать окружение NAG 1 и NAG2 в радиусе 7A. В окружении преобладают такие аминокислоты, как пролин, серин, глутамин, аспарагин, фенилаланин.
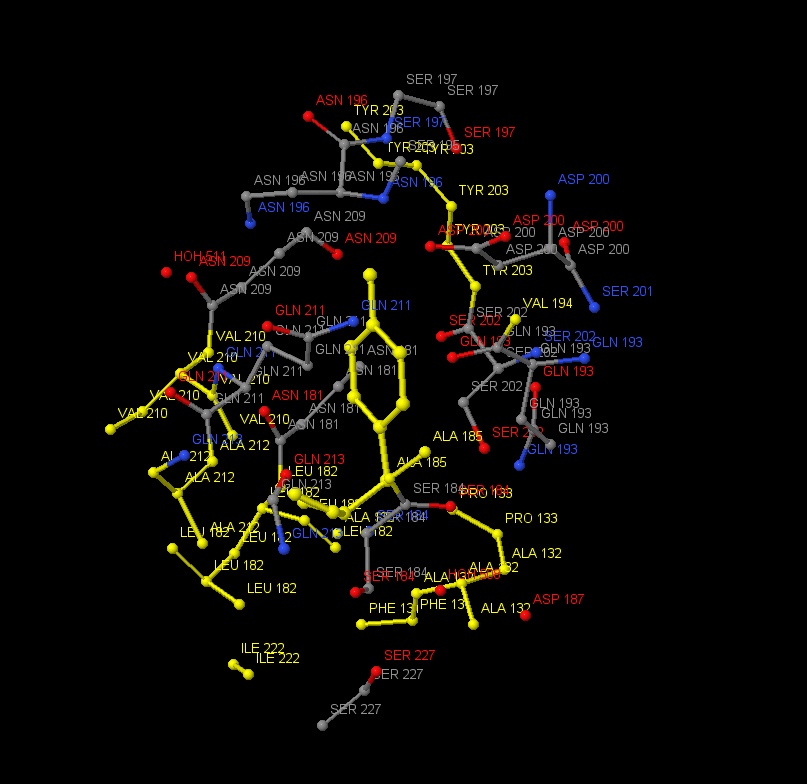
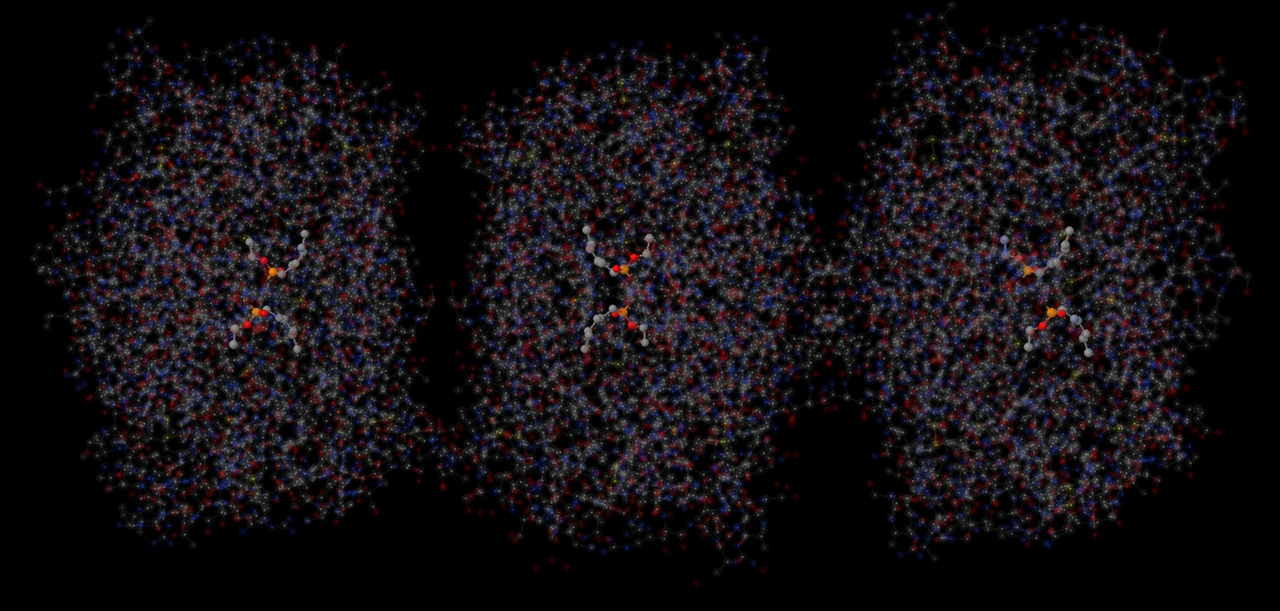
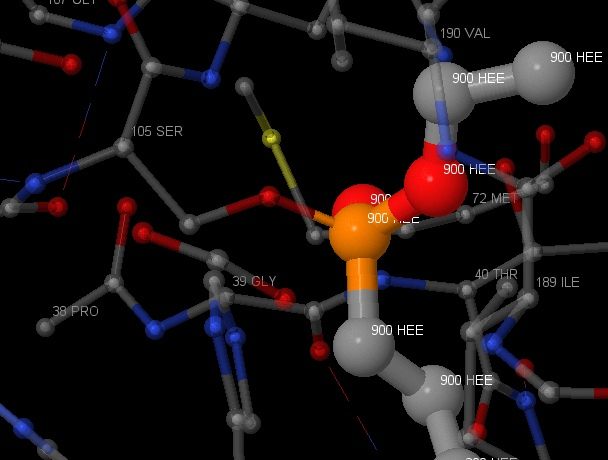
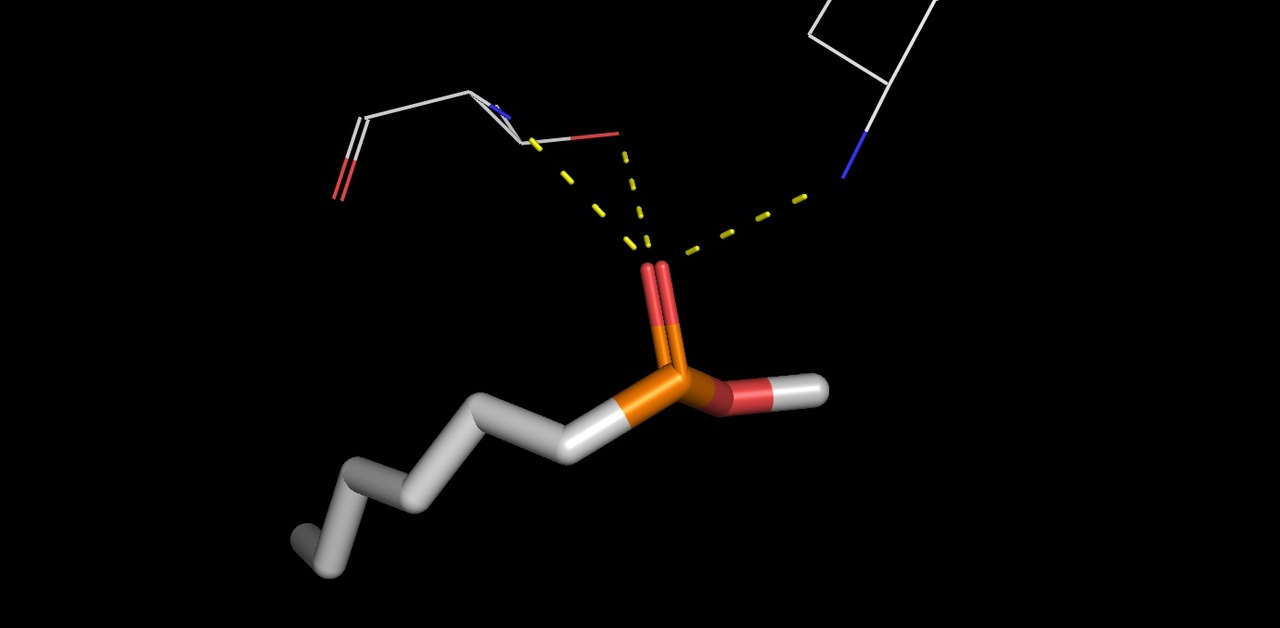
Также в липазе было найдено 6 лигандов HEE (представлены на рисунке 21). На рисунке 22 представлено ближайшее окружение одного из лигандов. Этот лиганд не имеет большое количество связей со своим окружением, можно наблюдать только
ковалентную связь со SER105 через кислород. На рисунке 23 данная связь показана ближе. Также можно наблюдать водородную связь HEE с остовом. Jmol не
может показывать водородные связи такого типа, поэтому рисунок 24 был сделан при помощи Pymol. Латорцева Дарья - скрипты по практически всем связям. Струкова Вера - поиск информации, написание введения и описания связей.
Тычкова Екатерина - поиск информации, скрипты по водородным связям бета - листа, описание лиганда NAG, вёрстка сайта.
Приносим благодарности всем преподавателям биоинформатики ФББ МГУ за неоценимый вклад в наше обучение, в частности, Александру Злобину и Валентине Масловой. Кроме того, благодарим Бориса Гукова, Екатерину Кузнеченкову и Ивана Шаповалова за консультации в процессе работы над проектом.
Отдельно хотим отметить помощь Ивана Шаповалова в написании скриптов и поиске информации о HEE.
hide all, а затем выбрали и показали необходимые командами
select (179-183 or 208-211) and backbone, display (179-183 or 208-211) and backbone сolor cpkcpk 100wireframe 20calculate hbondscolor hbonds whitehbonds 20cartoon.
define были найдены подходящие аминокислоты, within помог отрегулировать расстояние между аминокислотными остатками. Однако данные взаимодействия не являются солевыми мостиками, поскольку аминокислотные остатки встроены в полипептидную цепь, и там не может быть полного заряда,
который необходим для образования солевых мостиков. Таким образом, можно предполагать, что данного типа взаимодействий в нашем белке нет, либо возможности Jmol не позволяют его найти.
2. Дополнительные
restrict CYS были найдены цистеины, между которыми и происходит образование дисульфидных связей. На рисунке 12 представлена одна такая связь, на рисунке 13 - все найденные.
Плотность упаковки атомов в гидрофобном ядре
define под именем MyResidue мы определили аминокислотный остаток тирозина. Команды
select within(расстояние в ангстремах, MyResidue) и restrict within(расстояние в ангстремах, MyResidue) выделяли атомы окружения на разных расстояниях.
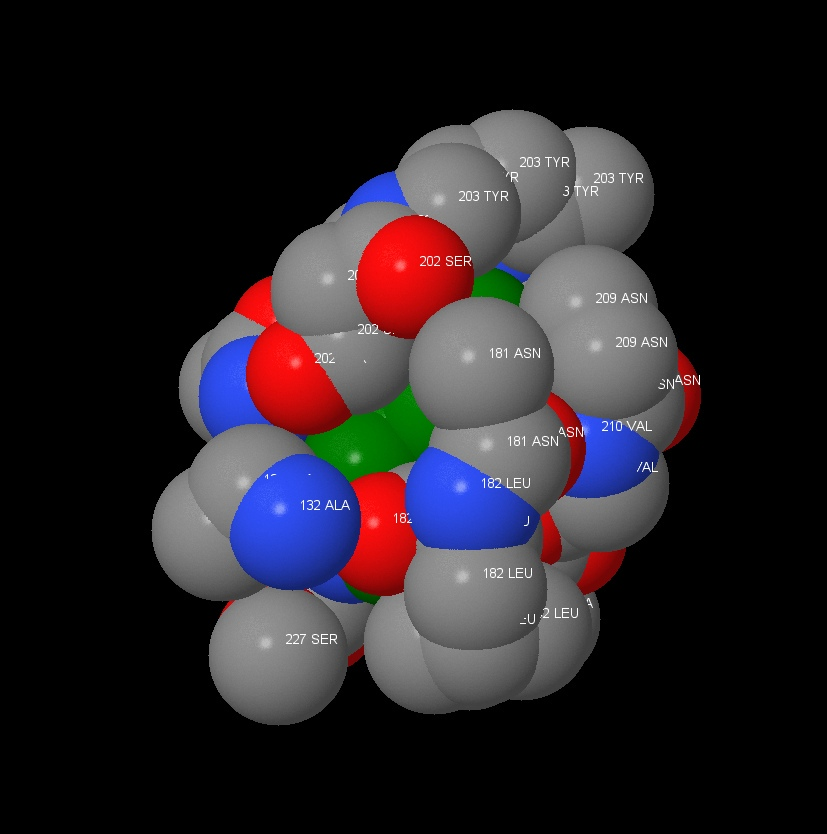
Информация о лиганд – биомолекулярных контактах
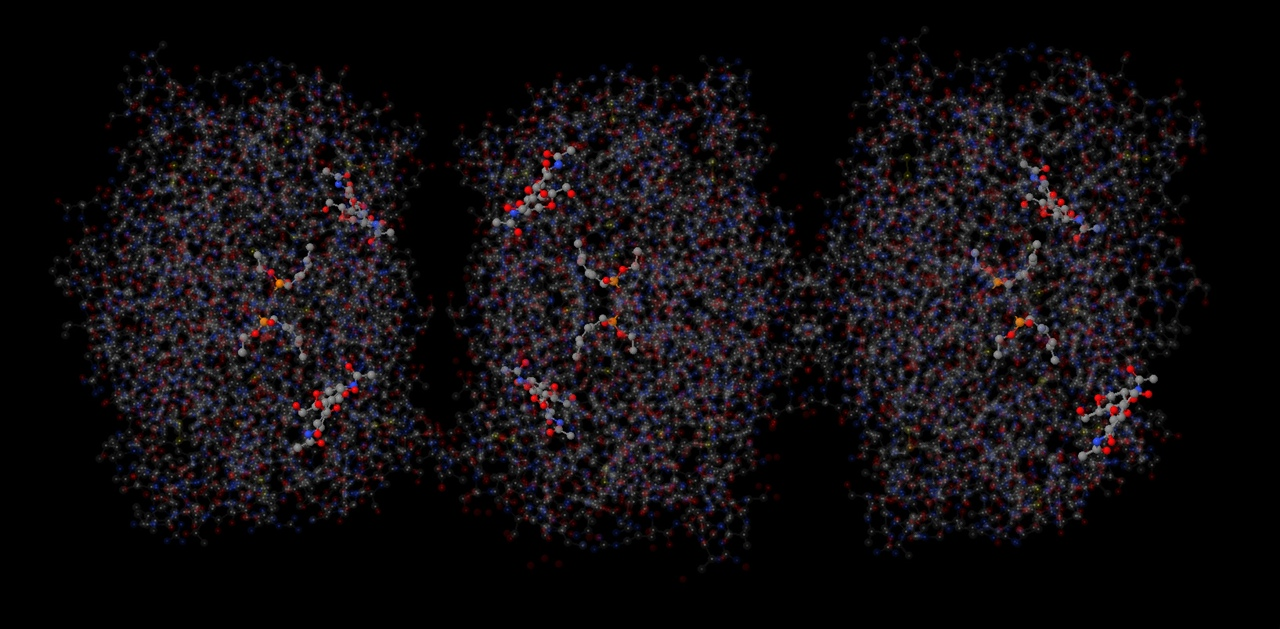
NAG
HEE
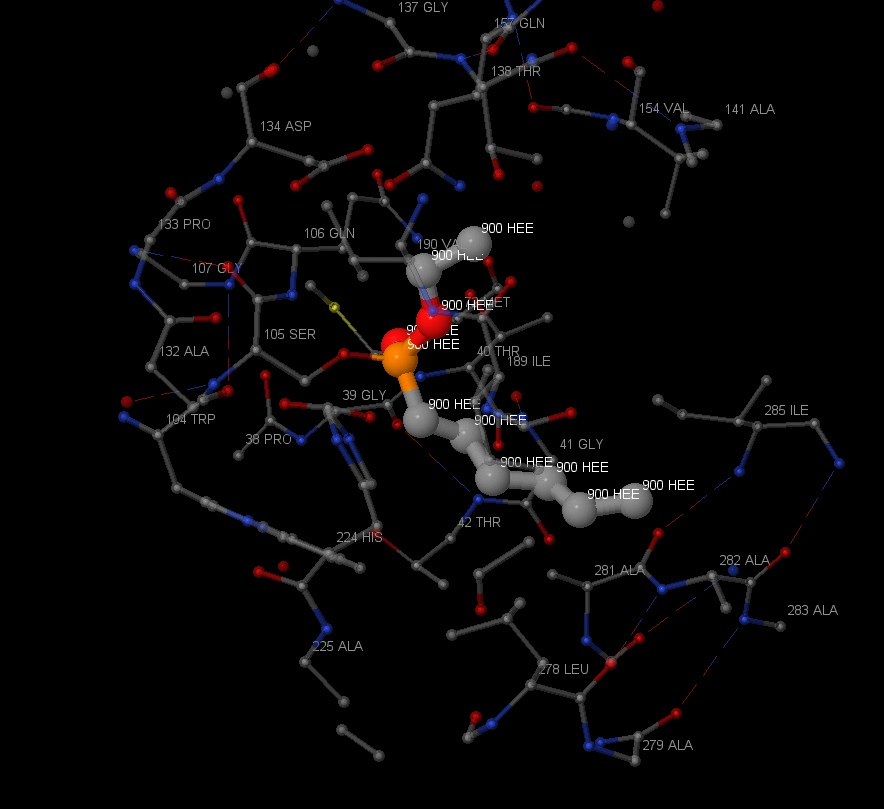
Личный вклад
Благодарности
Литература