ATP + L-Glutamate + NH3 <=> ADP + Orthophosphate + L-Glutamine
- Оксидоредуктаза;
- Воздействует на CH-NH2 – донорную группу;
- Акцептором является НАД + или НАДФ+;
- Фермент – глутамат-синтаза (НАДФН);
В этом упражнении предлагалось по названиям субстрата и продукта ферментативной реакции найти описание данное реакции в базе данных KEGG (Kyoto Encyclopedia of Genes and Genomes).
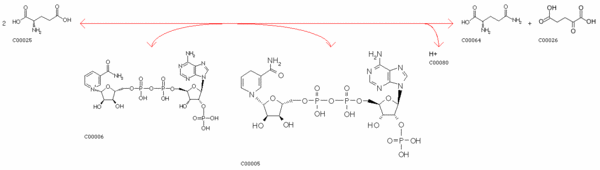
| Уравнение реакции | ATP + L-Glutamate + NH3 <=> ADP + Orthophosphate + L-Glutamine |
| Изображение с помощью структурных формул | 
|
| Название фермента | Глутамин-амид-2-кетоглутарат-аминотрансфераза (оксидоредуктаза, НАДФ) (glutamine amide-2-oxoglutarate aminotransferase (oxidoreductase,NADP)) |
| Код фермента и его расшифровка | EC 1.4.1.13
|
| Название метаболического пути | Метаболизм глутамата (Glutamate metabolism) |
В пределах данного метаболического пути данный субстрат мог появиться из 4-х возможных веществ (например, из 2-кетоглутарата). Данный продукт может превратиться в 9 возможных веществ (например, в карбамоил-P (сarbamoyl-P)).
В этом упражнении нужно по заданному названию метаболического пути найти его в базе данных KEGG, а затем найти в нем два фермента, катализирующих одну и ту же реакцию, наиболее различающихся кодами EC. Если вводить название пути без слов reference или map, то в KEGG обнаруживается очень много находок, представляющих собой метаболические пути разных конкретных организмов. Поиск с прибавлением этих слов дает один, общий, "справочный" путь, на котором показаны все возможные реакции этого метаболического пути у всех организмов, как бы наложение отдельных метаболизмов.

| Слева изображен выбранный фрагмент данного метаболического пути. Сравниваемыми
ферментами будут ферменты, катализирующие переход между β-аланином и карнозином
(обратимый – белок с ЕС 6.3.2.11 и необратимый – от карнозина к
β-аланину – с EC 3.4.13.3). По данным энциклопедии KEGG
можно провести следующее сравнение этих ферментов.
| ||||||||||||

| Я хотела проверить, в каких организмах вообще присутствуют данные
ферменты, и также установить, встречаются ли они вместе в одном организме
или нет. Если ферменты не встречаются в одном организме вместе, значит,
быть может, имело бы смысл говорить о каком-то разделении функций между ними.
Однако данное предположение было мной отвергнуто по двум причинам:
|
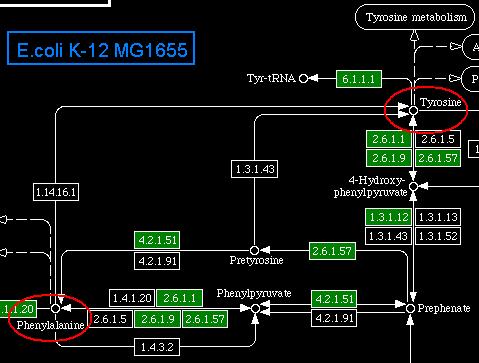
На сайте KEGG в разделе PATHWAYS был проведен поиск путей биосинтеза тирозина и фелиналанина (phenylalanin and tyrosine biosynthesis). Полученные полные карты путей метаболизма:
Ниже в таблице приведены те участки обеих карт, которые связаны непосредственно с синтезом фенилаланина и тирозина, а также их взаимопревращением. Предшественником для обеих аминокислот, как видно их схемы метаболизма для E.coli, является префенат (prephenate); он расположен в правом нижнем углу схемы. Цвета схем, взятых с сайта KEGG были для удобства просмотра на данном фоне обращены. Зеленая окраска показывает наличие данного фермента в метаболизме организма. Красными эллипсами окружены интересующие нас аминокислоты.
| 
|
Указанное в постановке задачи различие в метаболизмах бактерии и человека с помощью этих схем объясняется очень просто: у E.coli есть ферменты, катализирующие превращение префената в предшественники фенилаланина и тирозина (фенилпируват и 4-гидрокси-фенилпируват соответственно), а у человека таких ферментов нет. Хотя, что интересно, у человека ферменты, катализирующие превращение непосредственного предшественника в незаменимую аминокислоту, имеются!
Отвечая на поставленный вопрос, можно заметить, что у человека имеется фермент с EC 1.14.16.1, который катализирует одностороннее превращение фенилаланина в тирозин (на соответствующей схеме отмечен стрелкой и цифрой 1). Поэтому, если человек не будет получать тирозин с пищей, но будет получать фенилаланин, ничего страшного не произойдет — фенилаланин будет просто превращаться в тирозин.
Как видно на схеме метаболизма E.coli, у нее отсутствует такой фермент. Я могу предположить, что он просто не нужен для палочки, поскольку проще синтезировать каждую из аминокислот по отдельности, благо нужные для этого ферменты имеются.